丹参酮IIa诱导人胃癌细胞MKN-45凋亡及对端粒酶活性的影响
王亚明,张桂东,尹清臣,朱建平,王静
(1.邯郸市中心医院 普外一科,河北 邯郸 056001;2.上海市第一人民医院 危重病科,上海 松江 201620;3.邯郸市中心医院 病理科,河北 邯郸 056001)
丹参酮IIa诱导人胃癌细胞MKN-45凋亡及对端粒酶活性的影响
王亚明1,张桂东1,尹清臣1,朱建平2,王静3
(1.邯郸市中心医院 普外一科,河北 邯郸 056001;2.上海市第一人民医院 危重病科,上海 松江 201620;3.邯郸市中心医院 病理科,河北 邯郸 056001)
目的考察丹参酮IIa(tanshinone IIa,Tan IIa)诱导人胃癌细胞的凋亡作用,以及对端粒酶活性的影响。方法不同浓度TanⅡa处理人胃癌细胞株MKN-45后,显微镜下观察胃癌细胞形态变化,应用Annexin V/PI双重染色方法检测细胞凋亡比例,并用凋亡相关抗体检测通路情况,用RT-PCR以及TRAP-PCR法分别对胃癌细胞端粒酶基因hTert和端粒酶活性进行检测。结果TanⅡa处理胃癌细胞后,DAPI染色显示,细胞核内染色质聚缩,细胞核碎裂并有凋亡小体产生,提示TanⅡa诱导胃癌MKN-45细胞凋亡。Annexin V/PI双染结果显示,凋亡比例随化合物浓度提高而增加,40μM下晚期凋亡比例达到(45.02±6.48)%。凋亡相关蛋白的检测显示,PARP和Caspase-3活化,细胞色素C水平增加,而Caspase-8则无显著变化。同时TRAP-PCR结果显示,Tan IIa在诱导细胞凋亡的同时伴随端粒酶活性下调,并在40μM下显著抑制hTert基因的表达。结论TanⅡa对人胃癌细胞具有明显诱导细胞凋亡作用,且可能通过激活内源性途径引起细胞凋亡。TanⅡa还可抑制端粒酶活性和hTERT基因表达,这些可能是其发挥抗癌作用的重要机制之一。
丹参酮IIa;胃癌;MKN-45;凋亡;端粒酶
丹参是我国传统中药中应用较早,活性较为广泛的药物之一,近年来的研究结果显示,丹参脂溶性成分丹参酮类化合物具有明显的抗肿瘤作用。并有不少报道显示,其中的丹参酮IIa(tanshinone IIa,Tan IIa)可以通过细胞周期阻滞,显著抑制胃癌细胞增殖,并可诱导凋亡[2],针对其他肿瘤如白血病的研究结果还显示,除了可以诱导凋亡之外,Tan IIa可以发挥较为显著的诱导分化的作用[3]。然而,目前针对诱导凋亡相关信号通路的具体研究较少,而且对胃癌端粒酶活性是否有影响未见有报道,因此,本研究着重对丹参酮IIA针对胃癌凋亡相关通路进行研究,以期进一步阐明Tan IIa诱导凋亡的作用机制,此外将明确其对端粒酶的活性,有利于进一步挖掘我国传统抗肿瘤天然成分以及结构类似物的潜力。
1 材料和方法
1.1 材料 人胃癌细胞株MKN-45为本实验室保存。凋亡检测试剂盒购自南京凯基公司。噻唑蓝(methyl thiazolyl tetrazolium,MTT),二甲基亚砜(dimethyl sulfoxide,DMSO),4',6二脒基-2-苯吲哚 (4',6-diamidino-2-phenylindole,DAPI)购自Sigma公司,Tan IIa(中国食品药品检定研究院,批号110766-200619)中药化学对照品,用二甲亚砜配制为10 mM储液,除菌过滤储存于-20℃冰箱避光备用,临用时根据要求使用完全培养液稀释为目标浓度。无血清细胞冻存培养基(roswell park memorial institute,RPMI)-1640培养液为 Gibco公司产品,小牛血清购自杭州四季青生物科技有限公司。其余试剂均为分析纯或者分子试剂级别。
1.2 方法
1.2.1 细胞培养及化合物处理:胃癌细胞株MKN-45培养在含10%胎牛血清(fetal bovine serum,FBS)的 RPMI-1640培养液中(含100 U/mL的青-链霉素),细胞常规培养和传代。实验前,将对数生长期的MKN-45细胞用胰酶消化后,含FBS的培养液终止消化并吹打为单细胞悬液,细胞计数后用完全培养液调节细胞浓度为8×104/mL,接种至96孔或6孔板中。细胞贴壁生长24 h后,加入化合物,即取Tan IIa储液用完全培养液稀释至目标浓度,替换原来培养液,空白对照组换新鲜的完全培养液。
1.2.2 细胞凋亡形态观察:细胞爬片后,用Tan IIa不同浓度处理48 h后,冷甲醇固定,使用DAPI进行染色5min,磷酸缓冲液(phosphatic buffer saline,PBS)洗1次,将有细胞的一面倒扣于事先滴加有荧光防淬灭剂载玻片上。用倒置荧光显微镜观察。
1.2.3 凋亡细胞比例检测:使用膜联蛋白V(annexin V)/PI细胞凋亡检测试剂盒检测凋亡比例,不同浓度丹参酮IIa处理48h后,消化收集胃癌细胞,吹打成单细胞悬液,离心后弃上清,冷PBS再洗2次,用试剂盒中1×结合缓冲液重悬细胞,加入5μL异硫氰酸荧光素标记的膜联蛋白V和5μL碘化丙啶,弹匀后置于暗处室温孵育15min,取出细胞悬液过10μm孔径尼龙膜后转移至流式细胞样本管中,流式细胞仪进行分析检测。设置空白对照和单染组细胞用于流式细胞设“门”,每次分析10 000个细胞,实验重复3次,取均值。
1.2.4 免疫印迹:使用冷的PBS淋洗2遍,细胞置于冰上,加入RIPA裂解液裂解细胞。收集细胞蛋白后在10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)胶上电泳。蛋白分离后经恒流1.5 h电转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜后,使用含5%脱脂牛奶的封闭液封闭1 h,与Bcl-3特异性抗体室温孵育1 h或者4℃过夜后,次日加入二抗室温作用1 h后,洗膜缓冲液(tris buffered saline tween,TBST)洗膜3次,取出膜后加入增强型化学发光底物(enhanced chemiluminescence,ECL)发光液,暗室中压片显影。
1.2.5 端粒酶表达检测:不同浓度Tan IIa处理的胃癌细胞使用冷PBS漂洗一遍后,使用Trizol(Invitrogen)进行RNA提取,具体方法参考Trizol使用说明,使用Nanodrop 2000检测所得RNA的质量。用M-MLV逆转录试剂盒将得到的RNA为模板,使用Oligo dT为引物转录为cDNA,所得cDNA用Nanodrop 2000检测产量和纯度,按照以下方法以cDNA为模板,扩增端粒酶催化亚单位,所用引物序列,hTERT:hTERT:上游5’-TCC ACT CCC CAC ATA GGA ATA GTC-3’,下游5’-TCC TTC TCA GGG TCT CCA CCT-3’,扩增产物为 110bp;β-actin:上游 5’-CATGTACGTTGCTATCCAGGC-3’,下游 5’-CTCCTTAATGTCACGCACGAT-3’,扩增产物为250 bp。按照标准的PCR反应体系配置PCR反应液,置于PCR仪中按照以下程序进行反应:95℃变性5min后,按照94℃ 30 s,68℃20 s,72℃ 40 s,进行33个循环,72℃延伸7min,16℃保温。PCR产物在2%琼脂糖凝胶上分离后,使用天能成像系统拍照并使用随机软件进行条带灰度分析,以hTERT/β-actin比值作为最后的结果。
1.2.6 端粒酶活性检测:采用TRAP-PCR银染法检测端粒酶活性,具体操作按北京天恩泽试剂盒说明书进行。分别收集经不同浓度TanⅡa作用48 h后的胃癌细胞1×106个,预冷的PBS洗涤,细胞沉淀加入200μL的细胞裂解液,涡旋10s后冰浴30min充分裂解细胞,12 000 g 4℃离心20min后收集上清分装、测定蛋白浓度后用于端粒酶延伸反应。设置好阴性对照,根据试剂盒中说明配置反应体系,室温30min后模板DNA上可以加上不同数量的6 bp长的重复序列(TTAGGG),93℃3min灭活端粒酶,得到的混合反应体系加入引物和Taq DNA聚合酶1μL后直接用于PCR扩增,根据说明书中设置扩增条件,取20μLPCR反应产物用于10%非变性PAGE电泳,分离得到的凝胶使用银染法进行显色和拍照。
2 结果
2.1 TanⅡa对胃癌细胞凋亡的影响 使用不同浓度的TanⅡa作用MKN-45胃癌细胞72 h后,用Dapi对细胞核进行染色,如图1A所示随着浓度的升高,凋亡细胞所占的比例逐渐增高,使用1000倍观察后显示不少细胞出现典型的凋亡情况,包括染色质凝聚(引起荧光信号强度增加),核碎裂,凋亡小体产生等(图1B),以上结果显示丹参酮IIa对MKN-45具有比较强的凋亡诱导效应。
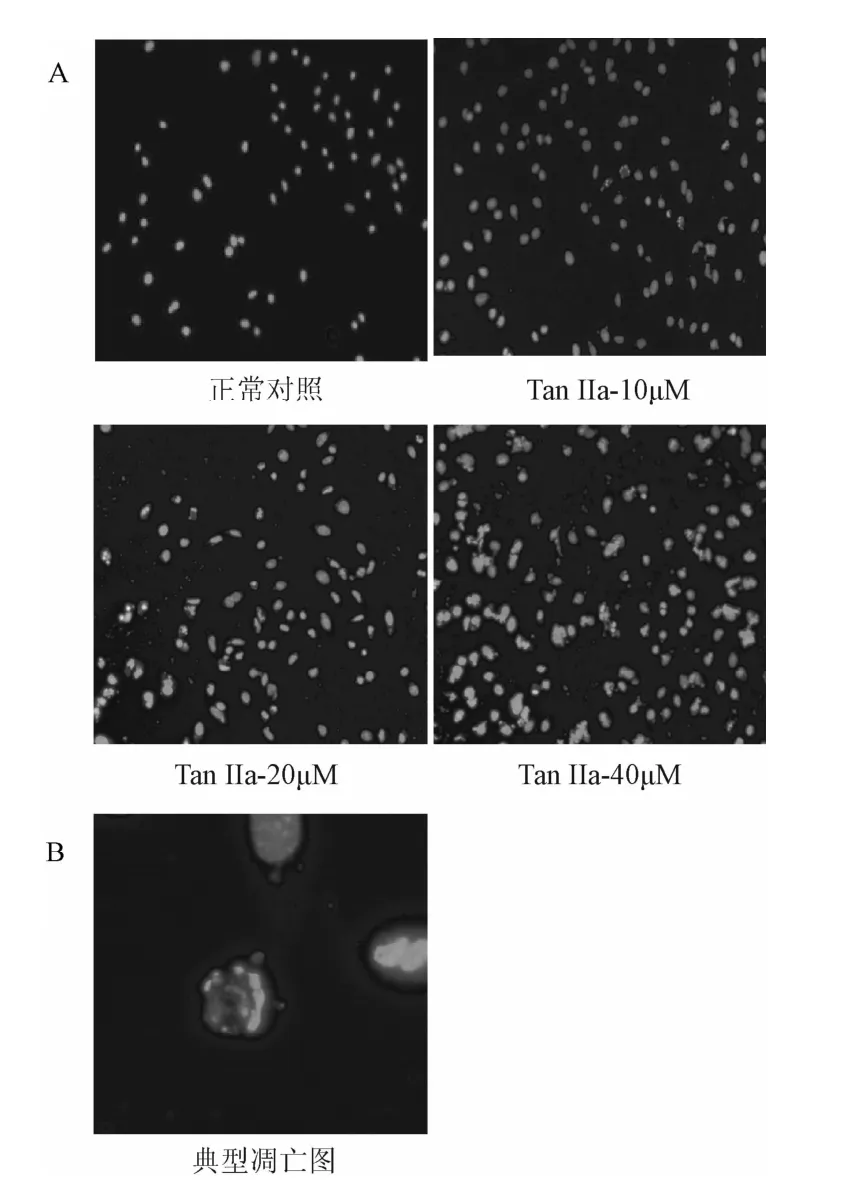
图1 TanⅡa作用MKN-45 72 h后细胞核DAPI染色结果A:200倍放大倍率下所得的图像;B:放大TanⅡa 40μM处理组1000倍以后得到的图像。标尺显示为100μmFig.1 Stained result of nucleiMKN-45 with 72 h-treatment of TanⅡaA:The image was obtained with themagnification of200 times;B:MKN-45 was treated with TanⅡa at40μM and an enlarged image was obtained with magnification of1 000 times.Sale display is 100μm
进一步收集Tan IIa处理48 h的胃癌细胞,使用Annexin V/PI双染检测不同时期凋亡细胞比例,得到表1的结果,从结果中可以发现高浓度丹参酮IIa处理后,细胞发生大量凋亡,也有不少比例的细胞发生坏死。晚期凋亡细胞与对照组比较具有显著差异(P<0.05),且随着剂量增加,早期凋亡、晚期凋亡与坏死细胞比例逐渐升高,说明Tan IIa对胃癌细胞诱导凋亡效应呈现剂量依赖性。
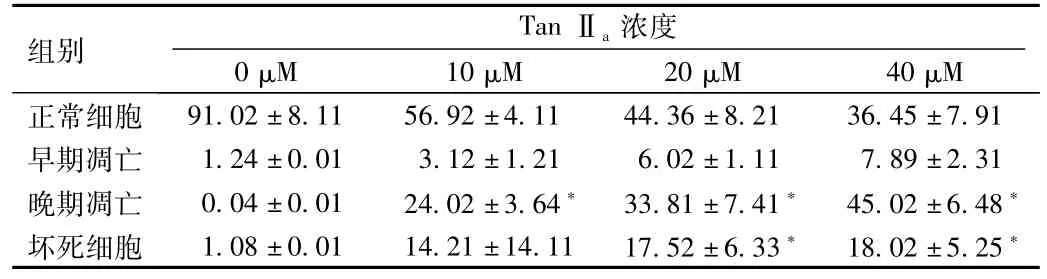
表1 TanⅡa对胃癌细胞凋亡的影响(%)Tab.1 Apoptosis rate of gastric cancer after treatmentwith TanⅡa(%)
2.2 TanⅡa对凋亡相关信号通路的影响 为了进一步探索TanⅡa作用胃癌细胞引起凋亡的具体作用机制,首先对PARP和Caspase-3进行检测,MKN-45细胞与不同浓度的Tan IIa作用48h后,裂解细胞,进行免疫印迹,检测凋亡相关蛋白。与2.1结果相一致的是,随着Tan IIa浓度的升高,代表DNA损伤的PARP剪切形式也逐渐的增加,Caspase-3被活化,其前体水平逐渐下调,活化形式增加(见图2A)。为了进一步区分凋亡是通过内源性还是外源性途径,对细胞色素C(Cyto C)和Caspase-8进行检测,结果显示代表内源性途径的细胞色素C在Tan IIa作用下从线粒体中释放入胞浆中,而Caspase-8的水平未见有显著的变化,以上的结果不仅进一步证实Tan IIa诱导细胞凋亡的发生具有浓度依赖性,而且提示主要通过内源性凋亡途径发挥作用。
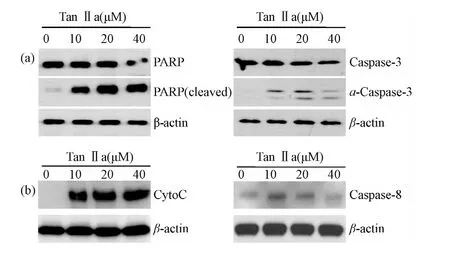
图2 Tan IIa对凋亡相关信号分子的影响图A不同浓度Tan IIa作用后对PARP和Caspase-3活化的影响;图B不同浓度Tan IIa作用后对细胞色素C(Cyto C)和Caspase-8表达的影响Fig.2 Diagram show of the influence of apoptosis-related signalingmolecules after treatment with difference concentration of Tan IIaFig.A Activation of PARP and Caspase-3 were detected by western blot;Fig.B The expression of cytochrome C(Cyto C)and Caspase-8 with treatmentwith different concentrations of Tan IIa
2.3 Tan IIa对hTert表达以及活性的影响 Tan IIa处理后,以β-actin表达为内参,得到以下表达数据(见表2),hTert的表达水平略有下降,但是不同浓度中,在20μM 48 h以及40μM 24 h和48 h时候,出现显著的表达差异(P<0.05)。进一步的对hTert活性进行检测后显示,随着Tan IIa浓度的增加,hTERT的活性逐渐下调,表现为间隔6 bp左右的银染条带组逐渐减弱。
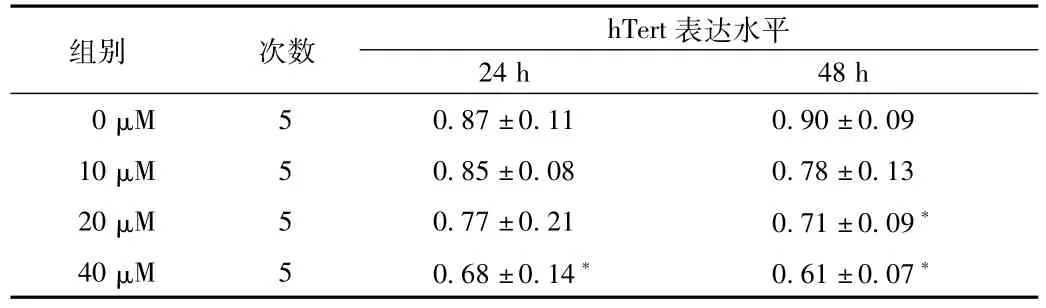
表2 TanⅡa对hTert表达水平的影响Tab.2 The expression of hTERT gene after treamentwith TanⅡa
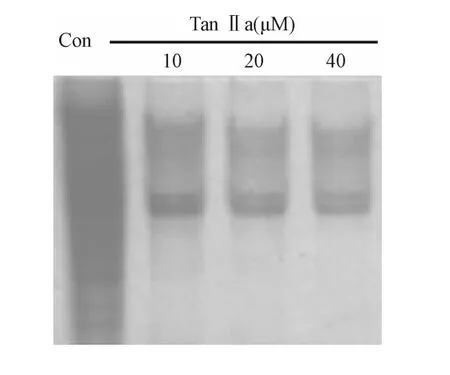
图3 TRAP-PCR法检测不同浓度Tan IIa对端粒酶活性的影响Fig.3 Telomerase activity of MKN-45 was detected by TRAP-PCRmethod with different concentrations of Tan IIa
3 讨论
目前针对丹参的化学成分研究主要集中在其脂溶性成分方面,可以大概分为2类,即丹参酮类和罗列酮类,本文所研究的丹参酮Ⅱa即属于前一类,为一种生物碱,在目前分离得到近40余种的丹参类生物碱中,以TanⅡa的抗肿瘤活性最强[4]。本研究首先在体外加入不同浓度的Tan IIa,利用DAPI荧光染色后,可以将细胞核进行染色,DAPI染色后,可以在荧光显微镜观察细胞核的形态,即染色质浓缩并主要聚集于核膜下,呈现境界分明的颗粒状,有部分细胞出现核碎裂和凋亡小体,以上都提示TanIIa处理MKN-45后有细胞出现典型凋亡状态,随浓度增加,镜下显示这种具有凋亡特征的细胞比例增加,用Annexin/PI双染后检测凋亡细胞比例的分析手段进一步证实,随药物浓度增加,凋亡比例增加。提示TanⅡa对MKN-45胃癌细胞生长的抑制作用存在一定剂量和时间范围内具有显著的量效关系,提示丹参酮具有直接杀伤能力,因此,诱导凋亡是TanⅡa体内外抗肿瘤的机制之—。
进一步分析Tan IIa的分子结构可以发现,其分子环中存在菲环、呋喃环和醌类结构,菲环可以结合DNA,而呋喃环和醌类结构可以产生自由基,进而引起DNA损伤[5],这点在本研究中通过多聚(ADP-核糖)聚合酶(PARP)的检测得到比较明显的体现,PARP在DNA损伤以及细胞程序性死亡中活化并上调,可作为凋亡早期的敏感标志[6]。进一步对Caspase-3的检测不仅验证前面的DAPI染色的现象,而且在分子水平证明存在比较明确的凋亡现象。
Caspase-3在Caspase家族中属于执行蛋白,处于Caspase分子级联“瀑布”下游,作为关键的蛋白酶,通过激活Caspase-3,可以促进肿瘤细胞凋亡。研究发现,Tan IIA不仅能激活反应DNA损伤程度的PARP,而且可以上调Caspase-3活化形式表达,最后诱导细胞凋亡。
根据凋亡发生途径的差异,可将凋亡类型大致分为内源性途径和外源性途径,前者又称为线粒体途径,主要表现为线粒体内相关蛋白如细胞色素C(Cyto C)释放,Bax表达以及线粒体膜电位改变等,而后者则主要以 Fas/FasL为代表,体现为下游Caspase-8的活化。本研究显示Tan II诱导的凋亡主要可能为线粒体途径,表现TanⅡa作用后细胞色素C的大量表达。针对Caspase-8的检测也提示有一定程度的活化,但是程度不如细胞色素C明显,这也提示,细胞中的信号通路往往不是非此即彼的关系,可能还存在较多的交互作用网络,比如Zhang等人研究显示,大蒜素可通过同时活化外源性和内源性2条途经诱导胃癌细胞凋亡[7]。
尽管国内有不少体外实验表明,TanⅡa对多种肿瘤细胞有抑制或杀伤作用,对血液系统肿瘤如K562、HL260以及肝癌HepG2细胞均有明显的抑制作用[8],并能诱导凋亡和细胞分化。但是既往的研究着重对于丹参酮Ⅱa在细胞增殖方面的研究[2,9-10],通过引起细胞周期阻滞,上调p53引起细胞增殖抑制等方面[11]。虽然也提示存在凋亡现象,但对于引起凋亡所涉及的具体通路鲜有涉及,而本研究恰恰弥补了该方面的空白,通过对凋亡内、外途径中典型代表蛋白进行分析,基本阐明其信号通路主要通过内源性途径(也就是线粒体途径)实现。通过释放细胞色素C,激活Caspase-3系统,最后引起细胞凋亡。
端粒酶是一种特殊的逆转录酶,主要由端粒酶相关蛋白(TPl)、端粒酶 RNA(hTR)和 hTERT3部分组成[12]。正常细胞在分裂时候,在染色体末端会出现进行性缩短,导致分裂次数受限,细胞可以分化或凋亡,而不至于无限制的增殖。而端粒酶的作用是在复制期时,在染色体末端提供TTAGGG这样的重复片段,使细胞得以无限增殖,导致细胞永生和肿瘤的产生[13]。端粒酶的活性和表达水平提示细胞无限增殖的水平和能力,本研究显示Tan IIa不仅可诱导MKN-45发生凋亡,而且可以抑制端粒酶的活性以及对应基因的表达,并呈现剂量依赖性,在高浓度时,效应尤为显著,提示细胞凋亡与端粒酶抑制可能同时发生,并存在密切联系。该结果也与丹参酮I(Tan I)在单核粒细胞白血病的研究结果相一致,该研究也发现,丹参酮I体外作用单核粒细胞白血病细胞系U937,THP-1和SHI1后,引起Caspase-3活性的上调和端粒酶活性下降[14]。研究显示,凋亡过程中由于存在细胞膜完整性的破坏以及凋亡相关基因的表达和活化,这些因素都可以直接或者间接的影响到端粒酶基因的表达和活性[15]。但是相关调控的时序性以及具体细节有待进一步的研究和丰富。因此,TanⅡa如何是否通过影响凋亡抑制基因如Caspase-3等的表达而影响端粒酶活性,有待进一步的研究。总的来看,TanⅡa不仅可以通过内源性途径诱导胃癌细胞凋亡,而且可以显著抑制端粒酶的表达和活性,从不同角度抑制癌细胞的增殖和进展,因此对其构效关系的研究以及凋亡相关蛋白和端粒酶活性之间的相关研究,将为进一步挖掘丹参酮类似物以及进一步的结构改造提供坚实的基础,也为发扬我国传统中药,实现中药现代化以及天然药物的分子活性研究提供范例。
[1] 吴成举,谢鑫,柴纪严,等.胃癌患者的端粒酶的表达[J].中国民族民间医药,2013,(02):25-27.
[2] 宗绪山,冯玉光,王鑫,等.丹参酮ⅡA对低氧培养下人胃癌SGC7901细胞增殖、凋亡及HIF-1α表达的影响[J].世界华人消化杂志,2009,17(7):642-646.
[3] 李熙鸿,刘忠强,王慧卿,等.丹参酮ⅡA对HL-60细胞人端粒酶反转录酶表达的影响[J].实用儿科临床杂志,2012,(3):170-172.
[4] 杨雪鸥,王小云,开国银,等.丹参酮Ⅱ_A抗肿瘤作用及其新剂型的研究进展[J].中成药,2011,(08):1389-1392.
[5] 朱春霞,白育庭.丹参酮的临床研究进展[J].咸宁学院学报(医学版),2008,22(6):543-546.
[6] ME Smulson CMS.Roles of poly(ADP-ribosyl)ation and PARP in apoptosis,DNA repair,genomic stability and functions of p53 and E2F-1[J].Adv Enzyme Regul,2000,40:183-215.
[7] W Zhang MH,Y Gong YX.Allicin induces apoptosis in gastric cancer cells through activation of both extrinsic and intrinsic pathways[J].Oncol Rep,2010.24(6):1585-1592.
[8] 李国红,梁启廉.丹参酮在消化道肿瘤中的应用及研究现状[J].中国热带医学,2007,7(11):2123-2124.
[9] 杨琼,叶再元,叶平.丹参酮ⅡA对人胃癌MKN-45细胞增殖及基质金属蛋白酶-2表达的影响[J].浙江中医药大学学报,2009,33(3):311-313,315.
[10] 唐良.丹参酮ⅡA抑制胃癌细胞株BGC823增殖活性研究[J].中国基层医药,2013,20(24):3762-3764.
[11] 董晓荣,伍钢,董继华,等.丹参酮ⅡA对MKN-45细胞生长的影响[J].肿瘤防治杂志,2005,12(19):1465-1468.
[12] EM Smekalova OSS,Zvereva MI.Telomerase RNA biosynthesis and processing[J].Biochemistry(Mosc).2012,77(10):1120-1128.
[13] C Mondello AIS.Telomeres,telomerase,and apoptosis.Biochemistry and cell biology,2004,82(4):498-507.
[14] XD Liu RFF,Y Zhang HZY,Fang ZG.Down-regulation of telomerase activity and activation of caspase-3 are responsible for tanshinone I-induced apoptosis in monocyte leukemia cells in vitro[J].Int JMol Sci,2010.11(6):2267-2280.
[15] Blackburn EH.Telomeres and telomerase:their mechanisms of action and the effectsofaltering their functions.Febs Letters,2005,579(4):859-862.
(编校:谭玲)
Tanshinone IIa induced apoptosis on human gastric cancer cells MKN-45 and its effect on telomerase activity
WANG Ya-ming1,ZHANG Gui-dong1,YIN Qing-chen1,ZHU Jian-ping2,WANG Jing3
(1.First Department of General Surgery,Central Hospital of Handan,Handan 056001,China;2.Department of Critical Care,The First People's Hospital of Shanghai,Songjiang 201620,China;3.Department of Pathology,
Central Hospital of Handan,Handan 056001,China)
ObjectiveTo investigate the induced apoptosis effect of tanshinone IIa(Tan IIa)on human gastric cancer cells,aswell as telomerase activity.MethodsAfter treatmentwith different concentration of TanⅡ,gastric cancer cell line MKN-45 cellswere stained with DAPIand morphology changes were observed under amicroscope,Annexin V/PI double staining was carried to detect the proportion of apoptosis cells,furthermore apoptosis pathway relateswere also detected by western blot.Then RT-PCR and TRAP-PCRmethodswere used to detect the expression of telomerase gene hTERT and telomerase activity respectively.ResultsAfter Tan IIa treatment of gastric cancer cells,DAPI staining showed that the nuclear chromatin condensation and polymerization,nuclear fragmentation and apoptotic bodies produced,all of which indicated Tan IIa could induce the apoptosis of gastric cancer cell line MKN-45.Annexin V/PIdouble staining showed that the proportion of apoptotic increased with the increased concentration of Tan IIa,and ratio of later apoptotic cells could reached(45.02±6.48)%at 40μM.Detection of apoptosis-related proteins showed that,PARP and Caspase-3 activation,Cyto C levels increased,and Caspase-8 showed no significant changes.Meanwhile,TRAP-PCR results showed that,in company with Tan IIa-induced apoptosis,telomerase activity and the expression of hTERT genes were significantly inhibited under 40μM.ConclusionTan IIa induce the apoptosis of human gastric cancer cells through activation of endogenous pathways,futhermore,the inhibition of telomerase activity and hTERT gene expression,which may be one of the importantmechanisms by these pharmacologic activity.
tanshinone IIa;gastric cancer;apoptosis;telomerase
R735.2
A
1005-1678(2014)05-0044-05
胃癌已成为常见的消化道恶性肿瘤之一,发病率和死亡率居高不下,肿瘤发展与细胞增殖过度和分化失调密切相关,其中端粒酶的活性与肿瘤的增殖和分化均密切相关,端粒酶的活化引起细胞永生,端粒的长度可影响癌细胞分化。胃癌患者中端粒酶hTert阳性率可高达97.5%[1],可作为评价胃癌病情发展的重要指标之一。
邯郸市科学技术与发展计划项目(1223108085-4)
王亚明,男,本科,主治医师,研究方向:消化系统肿瘤的发病机制及综合治疗,E-mail:drwyming@126.com。

