MiR-34a通过调控Fra-1影响人胃癌细胞侵袭转移
杜益萍,王同杉,邱天竹,周鑫,刘平
(南京医科大学第一附属医院 肿瘤科,江苏 南京 210009)
MiR-34a通过调控Fra-1影响人胃癌细胞侵袭转移
杜益萍,王同杉,邱天竹,周鑫,刘平Δ
(南京医科大学第一附属医院 肿瘤科,江苏 南京 210009)
目的探讨过表达miR-34a对胃癌细胞侵袭转移增殖能力的影响,以及其可能的作用机制。方法通过转染miR-34a mimics上调其表达,利用划痕迁移实验、transwell侵袭实验和CCK8实验检测过表达miR-34a对SGC-7901,BCG-823细胞的迁移、侵袭和增殖能力的影响。采用生物信息学预测及双荧光素酶实验考察miR-34a对靶基因Fra-1的靶向调控机制。结果转染miR-34a mimics过表达miR-34a能显著抑制胃癌细胞SGC-7901,BCG-823的迁移、侵袭和增殖能力。miR-34a能够靶向负性调控Fra-1的表达,影响下游侵袭转移相关蛋白分子MMP9、Cyclin D1的表达。结论过表达胃癌细胞系中miR-34a可靶向抑制Fra-1的表达,从而抑制胃癌细胞的侵袭转移增殖能力,影响胃癌进展。
胃癌;miR-34a;迁移;侵袭;Fra-1
Micro RNA是一类存在于真核生物体内长度约为19~25个核苷酸的非编码小分子RNA,在转录后水平影响下游基因的表达从而发挥重要生物学功能[5]。研究表明,miRNA作为类似癌基因或者抑癌基因,不仅影响胚胎早期发育,细胞生长增殖,细胞表面各种因子异常表达,而且在肿瘤侵袭转移中发挥重要作用[6]。MiR-34a是非编码小RNA分子中重要一员,作为抑癌基因位于人类染色体抑癌区域1p36.23,与p53信号通路调节相关,在多种癌症中由于启动子甲基化、基因缺失和p53基因突变失活等原因而表达异常[7-8]。已有文章研究表明:miR-21、miR-107、miR-34a、miR-145、miR-199、miR-335等在胃瘤中表达异常,并在侵袭转移中发挥一定作用。MiR-21在胃癌中高表达,通过靶向PTEN促进胃癌细胞侵袭转移;miR-335的促进侵袭转移作用与转录因子sp1相关,但是相关调控机制的研究还有待于更进一步的研究[9-11]。
本实验通过在2种胃癌细胞系中过表达miR-34a,研究其在肿瘤生长增殖、侵袭转移方面的影响,并进一步探究miR-34a影响胃癌肿瘤转移的内在机制,进而为临床胃癌转移的早期诊断及预后判断提供一定的实验依据。
1 材料与方法
1.1 材料 人胃癌细胞株SGC7901、BCG-823购自上海细胞生物研究所。RPMI1640培养基,小胎牛血清购自美国Gbico公司。TRIzol,Lipofectamine购自美国Invitrogen公司。CCK8试剂盒购自日本 Dojindo公司,miR-34a mimics以及阴性对照(negative control)购自上海吉码制药技术有限公司。荧光素酶报告基因试剂盒购自美国Promega公司。Fra-1-3'-UTR荧光素酶报告质粒由广州锐博生物有限公司构建。Fra-1抗体购自美国Santa Cruz公司,MMP9抗体,Cyclin D1抗体购自美国Cell signal公司。羊抗兔二抗购自美国Bioworld公司。
1.2 方法
1.2.1 细胞培养及转染:人胃癌细胞株SGC7901、BCG823用含10%胎牛血清和100 U/mL青霉素和100mg/mL链霉素的RPMI1640培养基,置于37℃,5%CO2,饱和湿度的细胞培养箱中培养,2~3 d换液,细胞呈贴壁生长,当细胞融合度达到80%~90%时,用0.25%胰酶消化传代。取对数期生长细胞以每孔5×105铺于6孔板,贴壁24 h后,按照Lipofectamine说明书将miR-34amimics以及negative control分别转染到胃癌细胞系中。
1.2.2 划痕迁移实验:将分别转染miR-34a,negative control的细胞分别铺6孔板,每孔细胞数为5×105个。待细胞80%贴壁后,用10 uL的白色枪头在6孔板中间划开一条缝隙,每隔12 h观察缝隙处细胞的融合状态,并拍照记录,待缝隙逐渐变窄,细胞停止培养。
1.2.3 Transwell侵袭实验:按上所述分别转染2种细胞,生长48 h后,消化细胞并计数,在均匀铺有Matrigel胶的transwell上层小室加入200 uL含有5×104细胞的无血清培养基,下层小室加入500 uL含10%血清的培养基;置于37℃、5%CO2恒温箱孵育24 h,取出小室,PBS洗2遍,用4%的多聚甲醛固定细胞10min;PBS再重复洗2遍,结晶紫染色15min,PBS洗2遍,用棉签小心的擦去上层小室的细胞,显微镜下随机取8个视野拍照记录。
1.2.4 细胞增殖实验:按上所述分别转染2种细胞,生长48 h后,消化细胞并计数,在96孔板中每孔加入100 uL含有5000个细胞的悬液,将培养板置于37℃,5%CO2恒温箱下待贴壁后,向每孔加入10uL的 CCK-8试剂溶液,分别在24、48、72 h用酶标仪测定450 nm处的吸光度。以时间为横坐标,以吸光值为纵坐标绘制细胞生长曲线。
1.2.5 Western Blot检测转染前后蛋白表达差异:细胞以每孔5×105分别铺于6孔板,贴壁24 h后,将miR-34amimics以及negative control分别转染细胞。培养72 h后,蛋白裂解液抽提总蛋白,BCA法测定蛋白浓度,10%聚丙烯酰胺凝胶电泳分离蛋白质,以 GAPDH为内参。检测转染 miR-34a前后 Fra-1,MMP9,Cyclin D1的表达差异。MMP9,Cyclin D1抗体稀释度均为1∶1 000,Fra-1抗体稀释度为1∶500,二抗稀释浓度为1∶5 000。
1.2.6 双荧光素酶实验:构建包含Fra-1-3'UTR区野生型和突变型序列的报告基因质粒。人胚肾细胞系HEK293T以每孔1.5×105的浓度铺于24孔板中,置于37℃,5%CO2恒温箱孵育24 h,按照 Lipofectamine说明,将野生型或突变型 pGL3-Fra-1-3'UTR,与miR-34a mimics或者negative control按照实验设计共同转入细胞,24 h后,运用双荧光素酶报告基因测试系统检测荧光素酶活性。
1.3 统计学方法 每组实验至少重复3次,由SPSS11.0进行统计分析,正态计量数据用“±s”表示,两样本均数间比较采用t检验,多组间比较采用单因素方差分析及q′检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MiR-34a过表达对细胞侵袭转移能力的影响 划痕结果显示,与阴性对照组相比,转染miR-34amimics组细胞的迁移能力明显减弱(见图1)。Transwell实验结果显示:与阴性对照组相比,SGC7901和BCG823细胞中转染miR-34a后侵袭转移能力明显下降(见图2)。

图1 miR-34a过表达对2种细胞迁移能力的影响Fig.1 Effect ofmiR-34a overexpression on cell invasion of GC cell lines BCG-823 and SGC-7901

图2 miR-34a过表达对2种细胞侵袭转移能力的影响Fig.2 Effect ofmiR-34a overexpression on cell invasion and migration of GC cell lines BCG-823 and SGC-7901
2.2 MiR-34a过表达对BCG-823、SGC7901细胞增殖的影响 细胞转染miR-34amimics和negative control后,按要求加入CCK8试剂,置于37℃,5%CO2恒温箱培养,不同时间段测定吸光度绘制生长曲线。结果显示:与阴性对照组相比,转染miR-34a后细胞生长受到明显抑制(见图3)。

图3 miR-34a过表达对BCG-823(A),SGC7901(B)细胞增殖能力的影响Fig.3 Effect of overexpression miR-34a on GC cell lines BCG-823(A),SGC-7901(B)proliferation
2.3 MiR-34a靶基因的验证 通过TargetScan分析软件预测Fra-1可能是miR-34a的靶基因。在双荧光素酶实验中,与转染阴性对照片段和Fra-1-3'-UTR的对照组相比,实验组共转染miR-34a mimics和Fra-1-3'-UTR后荧光素酶活性显著降低,而将Fra-1-3'UTR结合位点突变后,荧光素酶活性显著降低(见图 4)。

图4 荧光素酶报告基因检测结果*P<0.05,与转染阴性对照组比较Fig.4 Dual luciferase assay results*P<0.05,compared with the negative control
2.4 Western blot检测结果 与阴性对照组相比,转染miR-34a mimics的 BCG823,SGC7901细胞 Fra-1、MMP9、Cyclin D1表达均明显下降(见图5)。
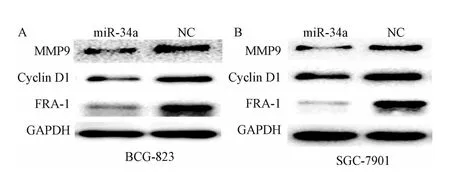
图5 Western印迹法检测转染miR-34amimics后BCG-823(A)和SGC7901(B)细胞中Fra-1、MMP9和Cyclin D1蛋白的表达Fig.5 Expression of Fra-1,MMP9,Cyclin D1 protein in BCG-823(A)and SGC-7901(B)cells aftermiR-34amimics transfection
3 讨论
胃癌是消化道常见恶性肿瘤,占世界范围内因癌症死亡人数的第二位。它的发生发展是多因素调控的复杂连续过程,例如癌基因抑癌基因的突变,DNA甲基化,非编码RNA的表达异常等。侵袭和转移是癌细胞的重要特征之一,是瘤细胞从原发部位脱离后向周围和(或)远处组织侵袭和转移的一个复杂过程,涉及肿瘤细胞的黏附性改变,细胞外基质(extracellular matrix,ECM)的降解增加,肿瘤细胞的迁移,新生血管生成等一系列过程,上述过程涉及许多基因的异常表达及一系列基因结构功能的异常[12]。MiR-34a,miR-126,miR-145等作为抑制乳腺癌转移的影响因素已被人们广泛了解接受,miR-34a在结直肠癌中的研究也显示miR-34a的高表达是抑制肿瘤侵袭转移的重要因素[13-14]。这些研究表明,miRNA在调控肿瘤细胞的侵袭、转移过程中起着非常重要的作用,有可能作为将来胃癌诊断治疗的分子标记物。
MiR-34a在胃癌细胞系SGC-7901,BCG-823中呈现过表达已在文献中有所报道[15-16],本实验通过过表达miR-34a来研究其对胃癌细胞生物学功能的影响。划痕实验和Transwell侵袭实验结果表明:过表达miR-34a后,胃癌细胞系SGC-7901和BCG-823细胞的侵袭能力、迁移能力和增殖能力均受到明显抑制。
肿瘤侵袭转移是一个多因素多步骤的复杂过程,miRNA通过不同途径发挥促进或抑制作用。目前miRNA在肿瘤侵袭转移过程中的作用机制已得到广泛研究,有研究表明:在乳腺癌中miR-21主要通过抑制BCL-2、TPM1、PDCD4、PTEN和 MASPIN等靶基因来促进肿瘤发生和侵袭转移,这些靶基因对肿瘤发生和侵袭转移具有重要的调控作用。最近研究发现在侵袭性乳腺上皮细胞中miR-155表达上调,通过TGF-β/Smad 4通路调节TGF-β,从而诱导上皮间质转化,细胞粘附性降低和迁移能力增强,从而促进肿瘤侵袭转移的发生[17-18]。在结直肠癌中miR-499通过调控靶基因PDCD4和FOXO4等的表达发挥促进转移的作用[19]。最近研究表明:miR-145能够抑制包括肺癌、胃癌和结肠癌等癌症的侵袭转移;肺癌中,其通过调节靶基因c-Wyc和IRS-1来抑制NSCLC癌细胞的增殖作用,而且还能特异性地调节G1/S期的mRNA使细胞G1期阻滞,从而抑制细胞增殖进展[20]。
另外,本研究通过生物信息学方法预测miR-34a可能通过作用靶基因Fra-1从而影响肿瘤的侵袭转移。通过双荧光素酶进行验证,结果显示miR-34a对细胞中靶基因Fra-1具有调控作用,通过与其3′-UTR区结合,抑制其表达翻译及下游周期相关蛋白MMP9,Cyclin D1的表达,从而影响肿瘤的侵袭转移。Fra-l属原癌基因,位于染色体 llgl3,编码长度约为1.7kb的成熟mRNA分子,其表达产物Fra-l蛋白由27l个氨基酸组成,相对分子质量为29000,为核蛋白Fos家族的重要成员[21]。Fra-1过表达可促进恶性肿瘤细胞的浸润转移,其主要机制为可诱导MMP9、MMP1、TMP-1的表达,增强细胞的侵袭能力,调控VEGF、BCL2、BCL-XL、FASL表达,在血管生成和细胞凋亡方面发挥重要作用。研究表明:Fra-1通过诱导MMP-1的高表达可以增强骨肉瘤细胞的侵袭性。在结直肠癌中,Fra-1作用于RAS-ERK和TGFb信号通路影响肿瘤的进展,对肿瘤侵袭转移有一定促进作用。Fra-1在乳腺癌中已得到广泛研究,Fra-1过表达促进了肿瘤进展相关基因的转录及诱导上皮细胞间质化(EMT),如人MCF-7乳腺癌细胞,过表达Fra-1可上调侵袭转移相关基因MMP-9、MMP-1、VEGF、Cyclin D1(细胞周期素 D1)和 TIMP-1表达,增强细胞的增殖侵袭和血管生成能力,转染后的MCF-7细胞侵袭力显著增强[22-23]。Andersen等[23]研究发现,Fra-1可诱导人乳腺癌细胞骨桥蛋白(osteopontin,OPN),血小板反应(thrombospondin)和CD44的表达,这3个蛋白均与肿瘤的转移有着十分紧密的联系。在本试验中,通过在胃癌细胞中上调miR-34a,可以靶向抑制Fra-1及其下游分子MMP-9和CyclinD1的表达。CyclinD1能促进细胞周期依赖性激酶激活从而促进细胞从G1期过渡到S期,实现细胞增殖,MMP-9与细胞外基质和基底膜的降解密切相关。
目前关于胃癌细胞中miR-34a异常表达的上游调控机制研究很少,具体机制仍待进一步研究。通过查询UCSC数据库(http://genome.ucsc.edu)发现,在肿瘤细胞中存在 miR-34a基因的启动子区域CpG岛甲基化现象,推测启动子甲基化程度的差异可能引起了不同肿瘤中miR-34a的表达差异,但是具体的机制还需要进一步的实验来阐明。
综上所述,过表达miR-34a能显著减弱胃癌细胞的侵袭转移能力,并且miR-34a的调控作用是通过靶向调控基因Fra-1及其下游分子MMP9、Cyclin D1的表达实现的,提示miR-34a过表达在胃癌的进展及远处器官转移过程中起重要作用,这将有可能为未来临床上胃癌的早期诊断和药物治疗等提供有效的分子标记物。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer JClin,2011,61(2):69-90.
[2] Fidler IJ.The pathogenesis of cancer metastasis:the“seed and soil”hypothesis revisited[J].Nat Rev Cancer,2003,3(6):453-458.
[3] Zhang L,Pan HY,Zhong LP,et al.Fos-related activator-1 is overexpressed in oral squamous cell carcinoma and associated with tumor lymph nodemetastasis[J].JOral Pathol Med,2010,39(4):470-476.
[4] Tulchinsky E.Fos family members:regulation,structure and role in oncogenic transformation[J].Histol Histopathol,2000,15(3):921-928.
[5] Bartel DP.MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell,2004,116(2):281-297.
[6] Wu WK,Lee CW,Cho CH,et al.MicroRNA dysregulation in gastric cancer:a new player enters the game[J].Oncogene,2010,29(43):5761-5771.
[7] Gaur A,Jewell DA,Liang Y,et al.Characterization of microRNA expression levels and their biological correlates in human cancer cell lines[J].Cancer Res,2007,67(6):2456-2468.
[8] Kato M,Paranjape T,Muller RU,et al.The mir-34 microRNA is required for the DNA damage response in vivo in C.elegans and in vitro in human breast cancer cells[J].Oncogene,2009,28(25):2419-2424.
[9] Xu Y,Zhao F,Wang Z,etal.MicroRNA-335 acts as ametastasis suppressor in gastric cancer by targeting Bcl-w and specificity protein 1[J].Oncogene,2012,31(11):1398-1407.
[10]Zhang BG,Li JF,Yu BQ,et al.microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J].Oncol Rep,2012,27(4):1019-1026.
[11]Shi Z,Wei Q,She J.MicroRNAs in gastric cancer metastasis[J].Crit Rev Eukaryot Gene Expr,2014,24(1):39-53.
[12]Chambers AF,Groom AC,MacDonald IC.Dissemination and growth of cancer cells in metastatic sites[J].Nat Rev Cancer,2002,2(8):563-572.
[13]O'Day E,Lal A.MicroRNAs and their target gene networks in breast cancer[J].Breast Cancer Res,2010,12(2):201.
[14]Wu J,Wu G,Lv L,et al.MicroRNA-34a inhibitsmigration and invasion of colon cancer cells via targeting to Fra-1[J].Carcinogenesis,2012,33(3):519-528.
[15]Cao W,Fan R,Wang L,et al.Expression and regulatory function of miRNA-34a in targeting survivin in gastric cancer cells[J].Tumour Biol,2013,34(2):963-971.
[16]Peng Y,Guo JJ,Liu YM,et al.MicroRNA-34A inhibits the growth,invasion and metastasis of gastric cancer by targeting PDGFR and MET expression[J].Biosci Rep,2014,34(3):e00112.
[17]Johansson J,Berg T,Kurzejamska E,etal.MiR-155-mediated loss of C/EBPbeta shifts the TGF-beta response from growth inhibition to epithelial-mesenchymal transition,invasion and metastasis in breast cancer[J].Oncogene,2013,32(50):5614-5624.
[18]Wickramasinghe NS,Manavalan TT,Dougherty SM,et al.Estradiol downregulates miR-21 expression and increases miR-21 target gene expression in MCF-7 breast cancer cells[J].Nucleic Acids Res,2009,37(8):2584-2595.
[19]Liu X,Zhang Z,Sun L,et al.MicroRNA-499-5p promotes cellular invasion and tumormetastasis in colorectal cancer by targeting FOXO4 and PDCD4[J].Carcinogenesis,2011,32(12):1798-1805.
[20]Feng Y,Zhu J,Ou C,et al.MicroRNA-145 inhibits tumour growth and metastasis in colorectal cancer by targeting fascin-1[J].Br JCancer,2014,110(9):2300-2309.
[21]Matsui M,Tokuhara M,Konuma Y,et al.Isolation of human fos-related genes and their expression during monocyte-macrophage differentiation[J].Oncogene,5(3):249-255.
[22]Belguise K,Kersual N,Galtier F,etal.FRA-1 expression level regulates proliferation and invasiveness of breast cancer cells[J].Oncogene,2005,24(8):1434-1444.
[23]Andersen H,Mahmood S,Tkach V,et al.The ability of Fos family members to produce phenotypic changes in epithelioid cells is not directly linked to their transactivation potentials[J].Oncogene,2002,21(31):4843-4848.
(编校:吴茜)
MiR-34a inhibit invasion and migration via targeting Fra-1 in gastric cancer
DU Yi-ping,WANG Tong-shan,QIU Tian-zhu,ZHOU Xin,LIU PingΔ
(Department of Oncology,The First Affiliated Hospital of Nanjing Medical University,Nanjing 210009,China)
ObjectiveTo investigate the effect ofmiR-34a on the proliferation,migration and invasion of gastric cancer(GC)cell lines SGC-7901,BCG-823 and find out the potential target genes.MethodsMiR-34a mimics were transfected into two GC cell lines.Wound healing assay,transwell assay and CCK8 testwere performed to explore the effect ofmiR-34a on the proliferation,migration and invasion of gastric cancer(GC)cell lines.Bioinformatics and Dual luciferase experiment were performed to investigate the potential target genes.ResultsUp-regulation of miR-34a could inhibit the proliferation,migration and invasion of SGC-7901,BCG-823 cells.Dual luciferase experiment confirmed that Fra-1 was a potential targetgene ofmiR-34a,which could reduce the expression of downstream molecular(MMP-9 and Cyclin D1).ConclusionOverexpression miR-34a could inhibit the proliferation,migration and invasion of GC cell lines through or partly via regulating the target gene Fra-1 and its downstream molecular MMP-9 and Cyclin D1.
gastric cancer;miR-34a;invasion;migration;Fra-1
R735.2
A
1005-1678(2014)05-0001-04
胃癌是全球常见恶性肿瘤之一,居男性常见肿瘤的第四位和女性的第五位,在亚洲地区呈现高发。由于早期诊断率低,确诊的胃癌患者大部分已经处于疾病进展期并伴有淋巴结或腹腔脏器的远处转移,手术切除或有效的辅助治疗后,胃癌死亡率仍然很高,位居全球第二,其中肿瘤晚期的侵袭转移引起的病人死亡占重要部分[1]。肿瘤的侵袭和转移是一个涉及多因素的复杂生物学过程,基因学与表观遗传学同时发挥着重要作用。一些癌基因、核转录因子、生长因子等通过影响下游相关的信号通路,控制细胞生长增殖,引起上皮间质化转变,从而在肿瘤的侵袭转移过程中发挥重要作用[2]。
原癌基因Fra-1是FOS基因家族的一员,其表达产物通过亮氨酸拉链结构域与JUN家族蛋白结合,共同构成同源或者异源二聚体形成转录因子AP-1[3]。AP-1是重要核转录因子中的一员,其信号转导通路的活化与多种重要生物学效应有关,例如细胞的癌变、增殖分化、凋亡等生物学过程,尤其在肿瘤细胞的运动迁移、细胞外基质的降解、肿瘤细胞的异常黏附及新生血管生成等多个侵袭转移相关环节中发挥着重要作用[4]。
国家自然科学基金(81201796)
杜益萍,女,硕士,研究方向:miRNA与胃癌侵袭转移,E-mail:Duyp1989@126.com;通信作者:刘平,男,教授,博士生导师,研究方向:消化道肿瘤相关研究,E-mail:liu-ping@csco.org.cn。

