转铁蛋白受体介导载紫杉醇纳米粒对结肠癌细胞的靶向性研究
钟玲,李思齐,杨蔚,曾蓉,毛琴,陈嘉舅
(1.昆明医科大学,云南 昆明 650500;2.云南省第一人民医院 急诊科,云南 昆明 650032;3.昆明医科大学第二附属医院 急诊科,云南 昆明 650101)
转铁蛋白受体介导载紫杉醇纳米粒对结肠癌细胞的靶向性研究
钟玲1,2,李思齐3,杨蔚2,曾蓉2,毛琴2,陈嘉舅3
(1.昆明医科大学,云南 昆明 650500;2.云南省第一人民医院 急诊科,云南 昆明 650032;3.昆明医科大学第二附属医院 急诊科,云南 昆明 650101)
目的制备转铁蛋白受体特异结合肽T7修饰载紫杉醇纳米粒(T7-NPs-PTX),研究其对结肠癌RKO细胞的靶向抑制作用。方法采用薄层法利备纳米粒共聚焦显微镜观察结肠癌RKO细胞和血管内皮HUVEC细胞对T7-NPs-PTX的摄取情况。MTT实验研究T7-NPs-PTX对结肠癌RKO细胞的毒性;流式细胞仪检测T7-NPs-PTX对结肠癌RKO细胞的凋亡诱导作用。构建RKO细胞肿瘤球模型,研究T7-NPs-PTX对肿瘤球的生长抑制能力。构建结肠癌裸鼠异位模型,研究T7-NPs-PTX对裸鼠肿瘤生长抑制作用。结果RKO细胞对经过T7修饰后的T7-NPs-PTX摄取显著增加,但HUVEC细胞对T7-NPs-PTX的摄取无显著变化。T7-NPs-PTX对结肠癌RKO细胞的增殖抑制作用和细胞凋亡诱导作用显著强于NPs-PTX和PTX溶液。结论经过T7修饰后能够增强纳米粒与结肠癌RKO细胞的亲和力,T7-NPs-PTX是一种潜在、高效的结肠癌靶向给药系统。
转铁蛋白受体;紫杉醇;药物靶向;纳米粒
1 材料与方法
1.1 材料与仪器 Leica 7CSSP5双扫描激光共聚焦显微镜(Leica公司);DMEM高糖培养基(美国GIBCO公司);紫杉醇(连云港恒瑞药业);香豆素-6(coumarin-6,美国 sigma公司);胎牛血清(美国GIBCO公司)。聚己内酯-聚乙二醇2000(PCL-PEG2000,山东省医疗器械研究所);人源结肠癌细胞(RKO,上海细胞研究所),人脐静脉内皮细胞(HUVEC,美国ATCC)。雄性裸鼠(成都达硕实验动物公司,合格证号:SCDW2013-1154)。
1.2 方法
1.2.1 T7-NPs-PTX的制备:参照文献[5-6]方法合成 PCLPEG2000-T7。取 PCL-PEG2000-T7 12.88 mg、PCL-PEG2000 4.48mg和紫杉醇1.65mg,共同溶于丙酮,缓慢滴加入不断搅拌中的水中,搅拌2 h后,用旋转蒸发仪除去溶液中的有机溶剂,得到T7共修饰的紫杉醇纳米粒。用适量香豆素-6取代紫杉醇制备得到香豆素-6标记的纳米粒。
1.2.2 细胞摄取实验:将对数生长期的 RKO细胞和HUVEC细胞以5×105个/孔的密度接种于6孔板中,37℃培养24 h后,每孔加入适量载香豆素-6的不同纳米粒溶液,使孔中香豆素-6的浓度为20 ng/mL,37℃分别孵育4 h后将细胞用PBS漂洗3次,加入2μg/mL DAPI溶液,室温孵育15min,加冰 PBS漂洗3次,加4%多聚甲醛固定15min,弃去多聚甲醛,用冰PBS保存。置激光共聚焦显微镜观察细胞摄取。
1.2.3 细胞毒性实验:体外培养RKO细胞,接种于96孔板中,1×107个/孔。当孔板中细胞完全贴壁且处于对数生长期时加入经无菌过滤的T7-NPs-PTX、NPs-PTX和PTX溶液各20μL,调节培养基的量使孔中紫杉醇浓度分别为0.3、3、10、30μg/mL。将孔板移入37℃、5%CO2孵箱中培养48 h后取出,每孔加入5mg/mLMTT溶液20μL,继续孵育4 h,将孔板中液体倒出,每孔加入DMSO 200μL,37℃避光振摇15min,用酶标仪在490 nm处测定各孔的光密度值(OD),每组设3个复孔,计算细胞存活率。
1.2.4 细胞凋亡实验:按“1.2.3”项下培养细胞并给药,将RKO细胞给药孵育24 h,然后用冰PBS清洗细胞3次,FITC/PI双染,细胞避光放置15 min,采用流式细胞仪检测细胞凋亡数量。
1.2.5 肿瘤球生长抑制实验:取对数生长期的RKO细胞用0.125%胰酶消化后,用含血清的培养基中和胰酶,并将细胞吹打下来后离心,弃去上清液,用培养基重悬细胞后接种于用低熔点琼脂糖预处理的96孔板中,将96孔板移入37℃ CO2孵箱中培养。7 d后成长为肿瘤球。第8 d加入T7-NPs-PTX、NPs-PTX和PTX溶液。以PBS为阴性对照组,统计肿瘤球体积变化。
1.2.6 肿瘤生长抑制实验:RKO细胞经胰酶消化,离心后将其悬浮于DMEM培养液中,计数调节浓度至5×107个/mL。取4~6周龄,体质量20~30 g的雄性裸鼠,将准备好的RKO细胞悬浊液皮下接种于裸鼠背部,每只裸鼠接种0.1mL细胞悬浊液。接种后1~2周可见背部长出肿瘤块,证明接种成功。将优选后的40只荷瘤裸鼠随机分成4组,PBS组、PTX溶液组、NPs-PTX组和T7-NPs-PTX组。各组均采用尾静脉注射给药,第21天处死小鼠,剖肿瘤,称重。
1.3 统计学方法 采用SPSS21.0进行数据分析,正态计量数据以“±s”表示,2组间比较用t检验,多组间比较用方差分析。
2 结果
2.1 RKO细胞和HUVEC细胞对T7-NPs的摄取 体外细胞摄取实验表明,RKO细胞对T7修饰纳米粒的摄取量明显大于未经T7修饰纳米粒,T7-NPs组荧光强度显著强于NPs。HUVEC细胞对T7修饰纳米粒的摄取效率与未经T7修饰纳米粒相当,2者荧光强度相近(见图1)。
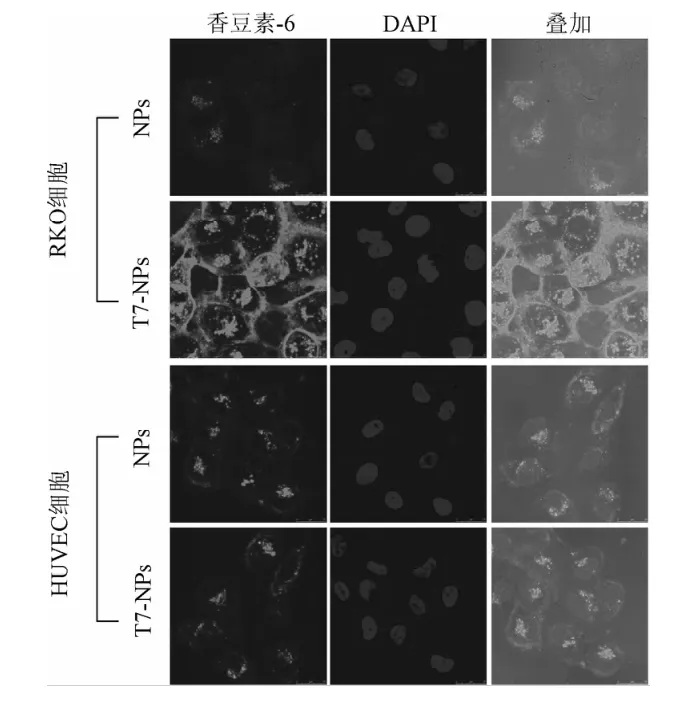
图1 激光共聚焦观察RKO细胞和HUVEC细胞对香豆素-6标记纳米粒的摄取Fig.1 Uptake of coumarin-6 loaded nanoparticles by RKO cells and HUVEC cells based on confocal laser scanningmicroscopy
2.2 T7-NPs-PTX对RKO细胞增殖的影响 MTT实验结果表明:T7-NPs-PTX、NPs-PTX和PTX溶液对肿瘤细胞的增殖抑制率随着浓度增大而增加,呈现浓度依赖性。T7-NPs-PTX对肿瘤细胞的增殖抑制能力强于NPs-PTX和PTX溶液,差异具有统计学意义(P<0.01,见图2)。
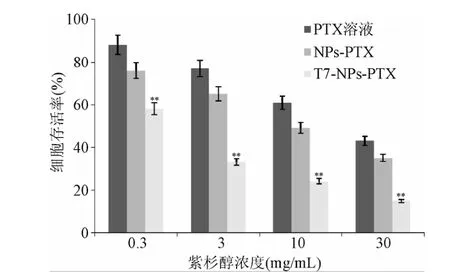
图2 紫杉醇脂质体对RKO细胞的增殖抑制率**P<0.01,与PTX溶液和NPs-PTX组相比Fig.2 RKO cell viability at various concentration of PTX**P<0.01,compared with PTX solution group and NPs-PTX group
2.3 T7-NPs-PTX对RKO细胞凋亡的影响 细胞凋亡的定量实验结果表明,T7-NPs-PTX、NPs-PTX和PTX溶液都能不同程度诱导乳腺癌细胞的凋亡。T7-NPs-PTX诱导肿瘤细胞凋亡率显著强于NPs-PTX和PTX,差异有统计学意义(P<0.01,见图3)。
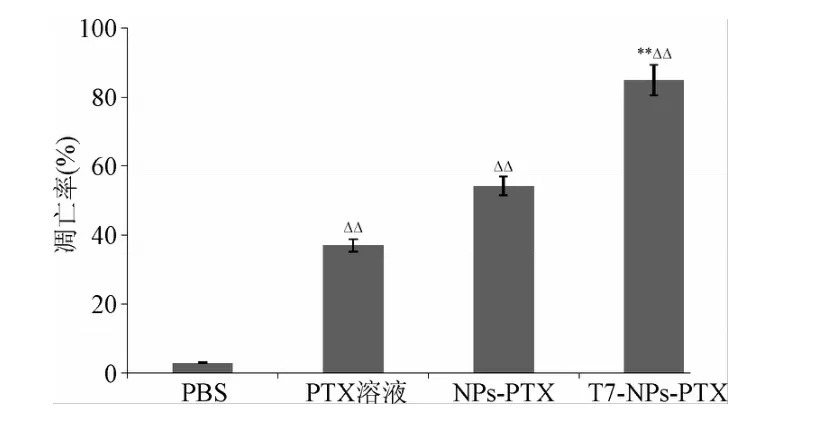
图3 不同药物干预对RKO细胞凋亡率的影响**P<0.01,与PTX溶液和NPs-PTX组相比;ΔΔP<0.01,与PBS组相比Fig.3 RKO cell apoptosis induced by PTX loaded nanoparticles**P<0.01,compared with PTX solution group and NPs-PTX group;ΔΔP<0.01,compared with PBS group
2.4 T7-NPs-PTX对RKO细胞肿瘤球生长的影响 肿瘤球生长抑制试验结果显示:RKO细胞肿瘤球给药7 d后,PTX溶液、NPs-PTX和T7-NPs-PTX的肿瘤体积分别减小到原体积的77.2%、59.3%和44.1%,但阴性对照组肿瘤球的体积增大了1.22倍,T7-NPs-PTX组与PTX溶液和NPs-PTX组比较,差异均有统计学意义(P<0.01,见表1)。
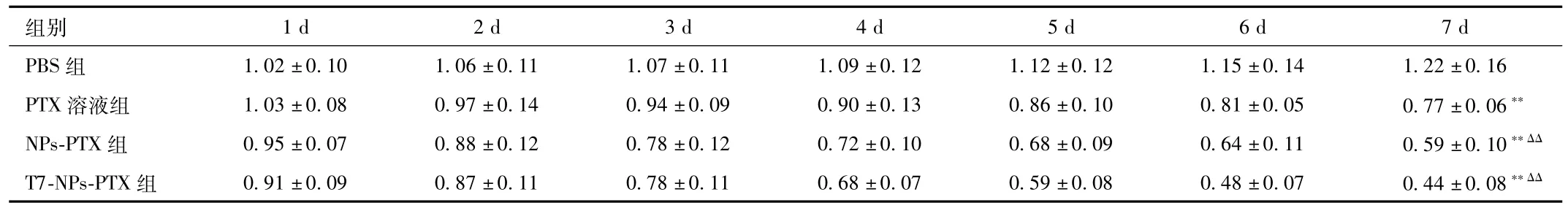
表1 不同给药对RKO细胞肿瘤球生长的抑制作用Tab.1 Inhibition of RKO cell tumor spheroid by different drugs
2.5 T7-NPs-PTX对荷瘤裸鼠肿瘤生长的影响 荷瘤裸鼠治疗实验结果显示,以PBS组为对照,经过20天后,PTX溶液、NPs-PTX和T7-NPs-PTX对肿瘤生长具有明显的抑制作用,T7-NPs-PTX与NPs-PTX组和PTX溶液组间差异具有统计学意义(P<0.01);这说明,经过T7修饰后能够增强纳米粒的肿瘤生长抑制能力(见表2)。

表2 不同药物干预对结肠癌移植瘤的抑制率Tab.2 Inhibition rate of tumor by different drugs
3 讨论
转铁蛋白(TF)可以与转铁蛋白受体(TFR)特异性结合,转铁蛋白受体在肿瘤细胞表面大量特异表达,转铁蛋白受体成为肿瘤靶向研究的热点[7-9]。T7(HAIYPRH)是一种由7个氨基酸组成的短序列肽,通过噬菌体展示技术从表达TFR的细胞中筛选得到,它也可以与TFR特异性结合,相比较于TF,T7修饰的纳米粒更有优势,TF为大分子蛋白,其存在免疫原性,不利于递药系统的多次给药[10-12],且蛋白构象的改变容易导致其功能的丧失[13],而作为多肽的T7则不存在此问题;TF修饰的纳米粒还会受到内源性TF的抑制,而T7修饰的纳米粒则不受到内源性TF的抑制[14]等。本研究将T7肽通过共价键连接到纳米粒的表面,利用结肠癌细胞表面大量表达的转铁蛋白受体介导纳米粒进入细胞,实现了结肠癌细胞的靶向给药。
本研究首先通过定性的共聚焦实验证实,T7修饰的纳米粒与结肠癌RKO细胞具有特异亲和力,而对正常的脐静脉内皮细胞无亲和力。这说明T7修饰纳米粒能够靶向结肠癌细胞,通过转铁蛋白受体介导入胞,而不会影响正常细胞。其次,本研究通过细胞增殖抑制实验证实了T7-NPs-PTX对于结肠癌细胞的增殖抑制活性,呈紫杉醇浓度依赖性,且经过T7修饰紫杉醇纳米粒对结肠癌细胞的增殖抑制作用显著强于游离紫杉醇溶液组和普通紫杉醇纳米粒组,这说明紫杉醇纳米粒发挥抗肿瘤作用依赖于肿瘤细胞对纳米粒的摄取。经过T7肽修饰后的纳米粒摄取量增强,毒性增强。细胞凋亡诱导实验也得到了与细胞毒性实验相同的结果。在某些实体肿瘤组织中,由于肿瘤组织致密生长,肿瘤内部压力高且血管少,因此给药系统很难进入肿瘤组织深部[15]。本研究构建了体外肿瘤球模型用于模拟评价T7-NPs-PTX对实体肿瘤的生长抑制作用,结果显示,经过T7修饰后增强了紫杉醇纳米粒对肿瘤球生长抑制作用。本研究还构建了结肠癌异位肿瘤模型,结果与体外实验结果相一致。综上所述,经过T7肽修饰后能够增强紫杉醇纳米粒进入结肠癌细胞,是一种潜在的结肠癌给药系统。
[1] 张德庆,祝建红,陈卫昌.塞来昔布联合5-FU抑制裸鼠结肠癌生长及其机制的探讨[J].中华肿瘤防治杂志,2013,20(1):15-20.
[2] Alessia C,Isabella O,Silvia D.Transferrin receptor 2 is frequently expressed in human cancer cell lines[J].Blood Cells,Molecules,and Diseases,2007,39(1):82-91.
[3] Shah N,Chaudhari K,Dantuluri P.Paclitaxel-loaded PLGA nanparticles surfacemodified with transferrin and Pluronic_P85,an in vitro cell line and in vivo biodistribution studies on rat model[J].J Drug Target,2009,17(7):533-542.
[4] Yao Q.Liposome formulated with TAT-modified cholesterol for improving brain delivery and therapeuticefficacy on brain glioma in animals[J].International Journal of Pharmaceutics,2011,420(2):304-312.
[5] Kuai R.Efficient delivery of payload into tumor cells in a controlled manner by TAT and thiolytic cleavable PEG co-Modified liposomes[J].Mol Pharmaceutics,2010,7(5):1816-1826.
[6] Chang SF.Targeted microbubbles for ultrasound mediated gene transfection and apoptosis induction in ovarian cancer cells[J].Ultrasonics Sonochemistry,2013,20(1):171-179.
[7] Garcia GE,Andrieux K,Gil S,Couvreur P.Colloidal carriers and Blood brain barrier(BBB)translocation:a way to deliver drugs to the brain[J].Int JPharm,2005,298(2):274-292.
[8] Gao HL.A cascade targeting strategy for brain neuroglial cellsemploying nanoparticles modified with angiopep-2 peptide and EGFP-EGF1 protein[J].Biomaterials,2011,32(33):8669-8675.
[9] Gao J.Inhibition ofhepatocellular carcinoma growth using immunoliposomes for co-delivery of adriamycin and ribonucleotidereductase M2 siRNA[J].Biomaterials,2013,34(38):10084-10098.
[10] CheeWG.Transferrin-conjugated nanoparticles of Poly(lactide)-D-a-Tocopheryl polyethylene glycol succinate diblock copolymer for targeted drug delivery across the blood brain barrier[J].Biomaterials,2010,31(32):7748-7757.
[11] Ulbrich K,Hekmatara T,Herbert E.Transferrin-and transferrin receptor-antibody-modified nanoparticles enable drug delivery across the blood-brain barrier(BBB)[J].Eur JPharm Biopharm,2009,71(2):251-256.
[12] Li J,Feng L,Fan L,et al.Targeting the brain with PEGPLGA nanoparticles modified with phage-displayed peptides[J].Biomaterials,2011,32(21):4943-4950.
[13] Zhan C,Gu B,Xie C.Cyclic RGD conjugated poly(ethyleneglycol)-co-poly(lactic acid)micelle enhances paclitaxel anti-glioblastoma effect[J].JControl Release,2010,143(1):136-142.
[14] Chang J,Jallouli Y.Characterization ofendocytosis of transferrin-coated PLGA nanoparticles by the blood-brain barrier[J].Int JPharm,2009,379:285-292.
[15] FrangioniJV.In vivo near-infrared fluorescence imaging[J].Curr Opin Chem Biol,2003,7(5):626-634.
(编校:吴茜)
Research of transferrin receptor mediated nanoparticles loaded paclitaxel targeting to colon cancer cell
ZHONG Ling1,2,LISi-qi3,YANGWei2,ZENG Rong2,MAO Qin2,CHEN Jia-yong3
(1.Kunming Medical University,Kunming 650500,China;2.Department of Emergency,First People’s Hospital of Yunnan Province,Kunming 650032 China;3.Department of Emergency,Second Affiliated Hospital of Kunming Medical University,Kunming 650101,China)
ObjectiveTo prepare T7 peptide conjugated nanoparticles loaded aclitaxel(T7-NPs-PTX),evaluate its properties and study its effect on colon cancer.MethodsNanoparticles were prepared by nanopreparation method.The cellular uptake of RKO cell and HUVEC cell in vitro were observed by confocal laser.The anti-proliferation efficiency of T7-NPs-PTX was evaluated by MTT assay.Tumor spheroids testwas used to evaluate antitumor ability of T7-NPs-PTX.RKO cell were xenografted into athymicmice to establish the animalmodel,which were used to evaluate the effectof anticancer.ResultsThe result demonstrated that T7-NPs uptaken by RKO cell was higher than that of LP.The MTT assay and the inhibition of tumor spheroids test in vitro confirmed strong inhibitory effect of T7-NPs-PTX.ConclusionT7-NPs-PTX is easy to prepare and it is a potential delivery system for the treatment of colon cancer.
transferrin receptor;paclitaxel;drug targeting;nanoparticles
R735.3
A
1005-1678(2014)05-0023-04
结肠癌是胃肠道常见肿瘤,发病率在我国呈逐年增高趋势[1]。化疗是目前结肠癌的重要治疗手段之一,患者的愈后在很大程度上取决于其对化疗的反应率。由于一般化疗药物有较大的不良反应,在杀灭肿瘤细胞的同时对正常细胞也有很大的影响,导致患者对化疗的顺应性低下。因此,寻找一种新的治疗途径来提高病人的化疗顺应性并杀灭肿瘤细胞,靶向治疗便显得尤为重要[2-3]。T7肽是从转铁蛋白中得到的一条有效多肽,研究表明,T7肽对于转铁蛋白受体表面的亲和力与转铁蛋白相近[4],这说明转铁蛋白与转铁蛋白受体的特异性结合主要是由T7所介导。本研究旨在通过将T7肽连接到纳米粒表面,以紫杉醇为模型药物,研究其对结肠癌细胞的靶向作用。
云南省应用基础研究重点项目(2011FA029);云南省科技厅-昆明医科大学联合专项基金项目(2010CD165)
钟玲,女,博士,研究方向:胃肠道肿瘤,E-mail:zhongl87189812@163.com;陈嘉勇,通信作者,男,硕士,主任医师,研究方向:胃肠道肿瘤,E-mail:xiaosha.dogy@163.com。

