卵母细胞体外成熟培养液的改良及研究
彭美莲
浙江省立同德医院妇产科,浙江杭州 310012
随着经济的发展,近年来不孕不育症的发生率逐年增高,卵母细胞体外成熟(IVM)是一项新的辅助生殖技术[1],是指应用少量促性腺激素或者不经过促排卵而直接从卵巢中获取体内未成熟的卵子,经过适当条件的体外培养,促使卵子成熟并具备受精能力,可以因减少刺激或无刺激而降低常规体外受精(IVF)中促排卵过程的高额费用,降低常规促排卵药物引起的卵巢过度刺激综合征等不良反应的发生率[2-3]。1991年人未成熟卵母细胞IVM技术获得首次成功[4],此后其发展一直较为缓慢,而卵母细胞IVM技术的一项重要内容即为IVM培养液,IVM培养液是IVM技术发展的首要前提。目前临床使用的培养液大多为在常规基础培养液上加入血清等成分,目前还没有一种价廉、现成、稳定和安全的商品化的IVM培养液。本研究中将小鼠各个时期卵母细胞置入不同配方卵母细胞IVM培养液中培养并进行IVF,比较所获得的卵母成熟率、卵裂率、IVF受精率,研制一种相对稳定的改良培养液,通过对IVM培养液成分的干预,改善卵母细胞IVM的条件,为探索辅助生殖新途径及临床应用提供参考。
1 材料与方法
1.1 材料
昆明小鼠50只,普通级,均为健康雌鼠未孕,6~10周龄,体重20 g左右,由中国科学院遗传与发育生物学研究所实验动物中心提供,所有小鼠适应性饲养1周,给予光照14 h,暗适应10 h,自由摄食摄水。根据培养液的不同将50只小鼠分为A组和B组,每组各25只。
1.2 IVM培养液的配制
A组:低糖培养基(DMEM),由美国Gibco公司生产;孕马血清促性腺激素(PMSG),由宁波第二激素厂生产;人绒毛膜促性腺激素(β-HCG)由珠海丽珠生物工程有限公司生产,加入基础培养液中进行培养。B组:采用含15%~20%胎牛血清的人类输卵管液 (HTF)加入基础培养液中进行培养(国产杭州四季青)[4]。
1.3 卵母细胞的收集
所有小鼠首先给予10 U PMSG(宁波激素制品厂)腹腔注射,46~48 h后收集卵母细胞。将小鼠断颈处死后取出卵巢,置于M2操作液冲洗过滤除去脂滴,在显微镜下用刺卵针收集卵丘-卵母细胞复合体(COCs),得到小鼠GⅤ期、MⅡ期卵母细胞[5-6],移入IM液中进行漂洗,再将A、B组移入IVM培养基中培养。
1.4 卵母细胞的体外培养
在37℃、5%CO2条件下培养[7],卵母细胞成熟的标志:拆除颗粒细胞后以排出第一极体即为卵母细胞成熟的标志[8]。对体外和体内成熟卵母细胞进行常规卵胞浆内单精子注射受精。观察受精12~16 h后原核的形成情况,随后将受精卵移入GM培养基中,每8小时观察1次胚胎发育情况。
1.5 观察指标及计算方法
①临床妊娠:指B超下能见到胚囊。②生化妊娠:指发生在妊娠5周内的早期流产,血中可以检测到HCG升高,大于25 U/mL或者尿妊娠试验阳性,但超声检查看不到孕囊,提示受精卵着床失败,又被称为“亚临床流产”。③卵裂胚胎评级:1级胚胎:细胞大小均匀,形态规则,透明带完整,胞质均匀清晰,没有颗粒现象;碎片0%~<10%之间。2级胚胎:细胞大小略不均匀,形态略不规则;胞质可有颗粒现象;碎片10%~<20%之间。3级胚胎:细胞大小明显不均匀,可有明显的形状不规则;胞质可有颗粒现象;碎片20%~<50%之间。4级胚胎:细胞大小严重不均匀,胞质可有严重颗粒现象;碎片在50%以上。其中1~3级为正常卵裂胚胎。④优质胚胎:正常受精来源,第2天为3~5个细胞,第3天为7~9个细胞,碎片≤20%,卵裂球大致均一且无多核、空泡等现象。⑤可移植胚胎:是指发育良好的正常卵裂胚胎,可以进行移植,为可移植胚胎。其中,正常受精率=(双原核受精卵数/成熟卵数)×100%;优质胚胎率=(优质胚胎数/正常卵裂胚胎数)×100%;卵裂率=(正常卵裂胚胎数/双原核受精卵数)×100%;可移植胚胎率=(可移植胚胎数/正常卵裂胚胎数)×100%;胚胎种植率=(胎数/种植胚胎数)×100%;妊娠率=[(临床妊娠周期数+生化妊娠周期数)]/种植周期数×100%;活产率=(活产周期数/临床妊娠周期数)×100%[9]。
1.6 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同发育阶段的卵母细胞
在显微镜下(400×)不同发育阶段的卵母细胞的具体发育情况见图1。

图1 不同发育阶段的卵母细胞
2.2 两种培养液对对卵子成熟及胚胎发育的影响
A 组小鼠的体外受精率[71.4%(140/196)]、正常受精率[65.7%(92/140)]及卵裂率[89.1(82/92)]与 B 组[67.6%(138/204)、68.1%(94/138)、85.1%(80/94)]比较,差异无统计学意义(P>0.05);A组小鼠的优质胚胎率[31.7%(26/82)]和可移植胚胎率[56.1%(46/82)]均优于 B 组[25.0%(40/80)、42.5%(34/80)],差异有统计学意义(P < 0.05)。 见表 1。
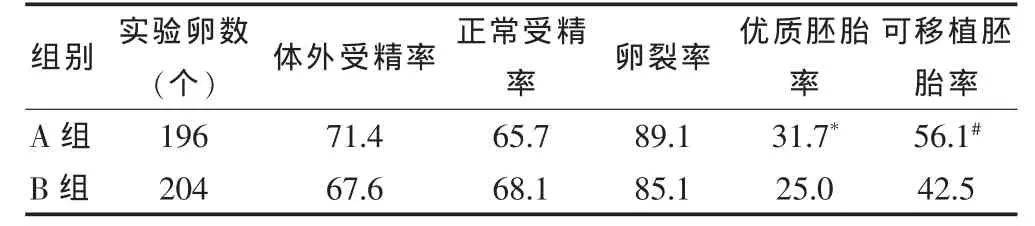
表1 两种培养液对对卵子成熟及胚胎发育影响的比较(%)
2.3 两种培养液对妊娠的影响
A组小鼠的妊娠率为23.3%(21/90),低于B组的32.6%(31/95),两组间差异有统计学意义(P < 0.05);但A组小鼠的活产率及胚胎种植率[17.8%(16/90)、66.7%(30/45)]与 B 组[18.9%(18/95)、68.8%(22/32)]比较,差异无统计学意义(P>0.05)。见表2。
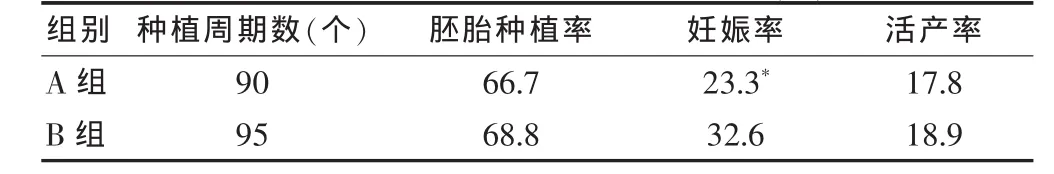
表2 两种培养液对妊娠影响的比较(%)
3 讨论
卵母细胞IVM是一项新的辅助生殖技术,其通过体外培养,使卵泡内的未成熟卵母细胞发育成为成熟的第2次减数分裂中期(MⅡ)卵母细胞,受精分裂成胚胎并移植获得妊娠的技术[9-10]。卵母细胞的内在质量是影像卵母细胞IVM的重要因素,卵母细胞的IVM包括核成熟、胞质成熟、胞膜成熟[11],细胞核完成第一次减数分离排出的极体即为核成熟,第一极体是判断核成熟的重要依据。卵母细胞在体内的发育过程中,胞质成熟和核成熟是同步完成的,卵母细胞体外培养后可恢复减数分裂并达到MⅡ期,可以受精、发育为正常胚胎[12]。与体内成熟的卵母细胞相比较,体外培养的卵母细胞可能并不能中分的成熟,卵母细胞的成熟依赖于特定时段特定基因的表达[13],卵母细胞的成熟受磷酸化/去磷酸化及蛋白质合成/降解等作用的影响[14]。目前关于卵母细胞体外培养的研究较多,但是各个研究报道的结果的差异较大,说明IVM技术尚未完全成熟,仍然需要进一步地改进和完善。虽然有大量的关于人类和哺乳类未成熟卵母细胞IVM的机制和能力的研究[15-16],但是IVM卵母细胞的妊娠率仍然比常规的体内成熟卵IVF的妊娠率低,说明IVM技术还有待进一步深入研究。
如何创建适合卵子发育的体外培养环境是完善未成熟卵母细胞体外培养系统的关键[17],目前虽然有大量关于人类和哺乳动物卵母细胞IVM的研究[18],但是其受精后的妊娠率均较低,效果不甚理想,说明卵母细胞细胞质和细胞核的成熟过程在体内是同步进行的,可以进一步阐明哺乳动物卵及胚胎在体外生长代谢时所需的营养条件。人类IVM技术专门针对一些卵子成熟障碍的不孕患者,特别是顽固的多囊卵巢综合征、卵巢过度刺激征、卵泡发育迟缓的患者,将此类患者未成熟的卵母细胞取出,在体外进行培养、受精,然后将胚胎移植到母亲子宫腔内生长,可能避免药物和治疗的副作用,减少费用,降低促排卵的风险。卵泡的大小和卵丘细胞对卵母细胞的成熟具有重要影响,卵泡的大小在一定程度上反映了卵母细胞的发育能力,正常的生理状态下只有优势卵泡可以排卵,多个动物实验研究证实,小卵泡中卵母细胞卵裂率和成熟率较低;多层卵丘包裹的卵母细胞的发育能力较强,卵丘细胞与卵母细胞之间的缝隙连接对卵母细胞的成熟有重要的意义,可能于一些生长因子可以通过两者的缝隙连接调节卵母细胞的成熟有关。
培养液是卵母细胞IVM技术发展的一项重要内容,卵母细胞体外培养基础培养液有组织培养基(TCM-199)、Ham F10、B2、Eagle 基本 DMEM、HTF 等[19]。体外基础培养液的选取对卵母细胞成熟率的高低有重要的影响,人类IVM的培养基通常加入一些生长因子、激素或者卵泡液,最常用的是胎儿胚胎血清和脐带血清[20]。目前关于人类卵母细胞培养基成分的报道少见,可能于GⅤ期卵母细胞的提取难度较大有关。有研究报道显示[21],激活素和抑制素也具有促进细胞核成熟和成熟卵母细胞的受精的作用。生长因子、激素或者卵泡液可显著促进卵母细胞的成熟率和卵裂率。
在IVM培养期间,人类卵母细胞对促性腺激素十分敏感,加入卵泡刺激素(FSH)和黄体生成素能够促进人类卵母细胞的成熟和卵裂,FSH能够加速细胞核的成熟,减少染色体异常的发生。另外,添加生长激素GH可以促进卵泡细胞的增殖,抑制细胞调亡。在培养基中加入5 mmol的视黄醛能够增加卵裂率,应用抗氧化剂有利胚胎的发育。但目前还没有一种现成、价廉、稳定和安全的商品化的IVM培养液提供。由此很有必要研制一种改良的IVM培养液并能够推广使用。
本研究结果显示,A组培养液的优质胚胎率和可移植胚胎率均优于B组,A组小鼠的妊娠率为23.3%,低于B组的32.6%,两组间差异有统计学意义(P<0.05),说明A组所有培养液的应用前景较佳。在卵母细胞的培养过程中,游离卵泡常出现聚集生长现象,抑制卵泡的生长,当较大卵泡在形成腔卵泡而被破坏或退化后,其紧邻的较小卵泡有些仍可恢复生长发育能力,继续生长,直至形成囊腔,说明卵泡之间存在一种相互作用机制,仍有待于深入研究。
[1]黄荷凤.现代辅助生育技术[M].北京:人民军医出版社,2003:116.
[2]孙新明,魏泓,赵永聚,等.昆明小鼠成熟卵母细胞体外受精及受精卵体外培养的研究[J].中国比较医学杂志,2005,15(3):129-132.
[3]钱云,师蔚群,丁家桐.哺乳动物体外受精的研究进展[J].动物科学与动物医学,2000,17(1):26-281.
[4]Ebeling S,Töpfer D,Weitzel JM,et al.Bone morphogenetic protein-6 (BMP-6):mRNA expression and effect on steroidogenesis during in vitro maturation of porcine cumulus oocyte complexes [J].Reprod Fertil Dev,2011,23(8):1034-1042.
[5]Tahaei LS,Eimani H,Yazdi PE,et al.Effects of retinoic acid on maturation of immature mouse oocytes in the presence and absence of a granulosa cell co-culture system[J].J Assist Reprod Genet,2011,28(6):553-558.
[6]Li Z,Zhang P,Zhang Z,et al.A co-culture system with preantral follicular granulosa cells in vitro induces meiotic maturation of immature oocytes[J].Histochem Cell Biol,2011,135(5):513-522.
[7]李媛,姜晶晶,陈子江,等.未成熟卵母细胞评分系统对人类未成熟卵体外成熟及发育潜能的评价[J].生殖与避孕,2006,26(7):408-413.
[8]Tkachenko OY,Delimitreva S,Isachenko E,et al.Epidermal growth factor effects on marmoset monkey(Callithrix jacchus)oocytein vitro maturation,IVF and embryo development are altered by gonadotrophin concentration during oocyte maturation[J].Hum Reprod,2010,25(8):2047-2058.
[9]宣恒华,冯定庆,刘然.干细胞条件培养液促进小鼠卵母细胞体外成熟[J].解剖学杂志,2012,35(3):272-276.
[10]Asimakopoulos B,Kotanidis L,Nikolettos N.In vitro maturation and fertilization of vitrified immature human oocytes,subsequent vitrification of produced embryos,and embryo transfer after thawing[J].Fertil Steril,2011,95(6):21-23.
[11]Kim M,Hong SJ,Lee JH,et al.Comparison of in vitro maturation media of immature oocytes:the effectiveness of blastocyst culture media[J].Fertil Steril,2011,95(2):554-557.
[12]Somfai T,Imai K,Kaneda M,et al.The effect of ovary storage and in vitro maturation on mRNA levels in bovine oocytes;a possible impact of maternal ATP1A1 on blastocyst development in slaughterhouse-derived oocytes[J].J Reprod Dev,2011,57(6):723-730.
[13]Pereira GR,Lorenzo PL,Carneiro GF,et al.Effect of incubation with different concentrations and durations of FSH for in-vitromaturation of murine oocytes[J].Zygote,2011,23(1):111-117.
[14]De Vos M,Ortega-Hrepich C,Albuz FK,et al.Clinical outcome of non-hCG-primed oocyte in vitro maturation treatment in patients with polycystic ovaries and polycystic ovary syndrome[J].Fertil Steril,2011,96(4):860-864.
[15]Vanhoutte L,Nogueira D,De Sutter P.Prematuration of human denuded oocytes in a three-dimensional co-culture system:effects on meiosis progression and developmental competence[J].Hum Reprod,2009,24(3):658-669.
[16]Leon PM,Campos VF,Kaefer C,et al.Expression of apoptoticgenes in immature and in vitro matured equine oocytesand cumulus cells[J].Zygote,2013,21(3):279-285.
[17]王辉田,罗光彬,王忠彬,等.兔卵母细胞体外成熟、体外受精及受精卵体外培养条件的研究[J].沈阳农业大学学报,2013,44(2):172-177.
[18]梅树江,林晓潭,王晓梅,等.小鼠腔前卵泡体外培养成熟染色体分析技术的建立[J].癌变·畸变·突变,2009,21(6):463-466.
[19]Pereira GR,Lorenzo PL,Carneiro GF,et al.The effect of growth hormone (GH)and insulin-like growth factor-I(IGF-I)on in vitro maturation of equine oocytes[J].Zygote,2012,20(4):353-360.
[20]韦多,谢娟珂,宋小兵,等.未成熟卵母细胞体外成熟培养技术研究进展[J].河南医学研究,2011,20(2):237-240.
[21]Vanhoutte L,Nogueira D,Dumortier F,et al.Assessment of a new in vitro maturation system for mouse and human cumulus-enclosed oocytes:three-dimensional prematuration culture in the presence of a phosphodiesterase 3-inhibitor[J].Human Reproduction,2009,24(8):1946-1959.
[22]张文红,朱伟杰,钟瑜,等.小鼠未成熟卵母细胞体外培养[J].暨南大学学报:自然科学版,2001,22(3):122-125.

