细胞周期蛋白D1在胆汁反流性胃炎和胃癌中的表达及其意义*
徐晓玲 曹 丽 沈 琴 戴跃青 王 璐 高苏俊 王庆娜 田秀春 朱海杭
江苏省苏北人民医院消化科 扬州大学临床医学院(225001)
胆汁反流性胃炎是慢性胃炎中的一种较常见类型,是由十二指肠胃反流引起的胃黏膜化学性炎症,与萎缩、肠化生等胃黏膜癌前病变有关[1-2]。细胞周期蛋白D1(cyclin D1)是细胞周期调节因子,属于原癌基因中的一种,其过表达可促进细胞增殖。既往研究[3]指出,cyclin D1与胃癌的关系密切。本研究通过探讨cyclin D1在胆汁反流性胃炎和胃癌组织中的表达及其意义,旨在为胃癌的临床防治提供理论依据。
对象与方法
一、研究对象
收集2012年6~12月江苏省苏北人民医院行胃癌根治术的胃癌组织标本50例、癌旁非癌组织(距癌组织边缘3~5 cm)标本50例、胃镜下取得的胆汁反流性胃炎组织标本50例。选取同期健康体检者胃黏膜组织标本50例作为正常对照。胃癌组织和癌旁非癌组织标本经HE染色后由组织病理学检查确诊。胃镜检查发现胃内有绿色或黄色胆汁伴胃黏膜糜烂或充血者诊断为胆汁反流性胃炎[4-5]。入选患者年龄、性别差异无统计学意义。
二、研究方法
1. 观察胆汁反流性胃炎胃黏膜病变情况:取胆汁反流性胃炎和正常对照组标本,采用新悉尼系统[6]评价胃黏膜组织肠上皮化生和异型增生的情况。
2. 免疫组化染色:取胃癌组、癌旁非癌组、胆汁反流性胃炎组以及正常对照组标本,蜡块切片,68 ℃烤片20 min,常规脱蜡,梯度酒精脱水,加热柠檬酸缓冲液1~2 min至96 ℃,切片置于缓冲液中,微波炉加热20 min,取出切片自然冷却至室温,滴加3% H2O2,37 ℃孵育10 min, PBS冲洗2 min×3次,滴加兔抗人cyclin D1单克隆抗体(北京中杉金桥生物技术有限公司)(1∶50),4 ℃冰箱过夜,PBS冲洗2 min×3次,滴加聚合物辅助剂,37 ℃孵育20 min,PBS冲洗2 min×3次,滴加通用型二抗(北京中杉金桥生物技术有限公司)(1∶50),37 ℃孵育20 min,PBS冲洗2 min×3次,DAB溶液(北京中杉金桥生物技术有限公司)显色,蒸馏水冲洗,苏木素复染,脱水、透明、干燥、封片,光学显微镜下观察。以PBS代替一抗作为阴性对照,以已知阳性切片作为阳性对照。
结果判断:每例切片随机选取5个高倍视野进行观察。Cyclin D1染色阳性为细胞核内出现棕黄色颗粒,且着色强度高于背景非特异性染色者。参考孙桂彬等[7]的研究,根据阳性细胞染色强度和阳性细胞比例综合判断染色结果。染色强度:0分,无色;1分,淡黄色;2分,棕黄色;3分,棕褐色。阳性细胞比例:0分,≤5%;1分,5%~25%;2分,25%~50%;3分,≥50%。阳性标记分数=阳性细胞染色强度分数×阳性细胞比例分数: 0分,(-);1~3分,(+);4~5分,(++);≥6分,(+++)。
三、统计学分析
应用SPSS 16.0统计软件,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、一般情况
胃癌组中男27例,女23例,年龄43~71岁,平均(58.7±7.8)岁;癌旁非癌组中男18例,女32例,年龄33~73岁,平均(56.4±8.7)岁;胆汁反流性胃炎组中男19例,女31例,年龄21~75岁,平均(51.0±16.1)岁;正常对照组中男21例,女29例,年龄19~74岁,平均(50.0±13.1)岁。四组患者性别构成、年龄差异无统计学意义(P>0.05)。
二、胆汁反流性胃炎胃黏膜病变情况
χ2检验结果显示,胆汁反流性胃炎组发生肠上皮化生和异型增生的比例显著高于正常对照组(P<0.05)(见表1)。
三、Cyclin D1表达情况
免疫组化染色结果显示,cyclin D1阳性率在正常对照组、胆汁反流性胃炎组、癌旁非癌组以及胃癌组中逐渐升高。胃癌组cyclin D1阳性率显著高于其余三组(P<0.05),胆汁反流性胃炎组cyclin D1阳性率显著高于正常对照组(P<0.05),癌旁非癌组与胆汁反流性胃炎组间的差异无统计学意义(P>0.05)(见表2)。
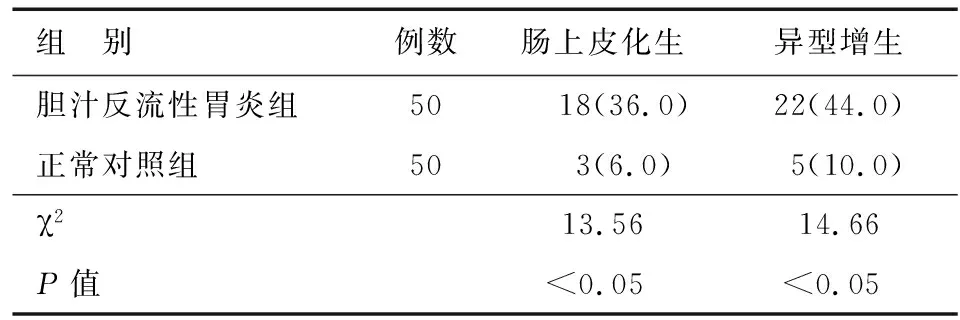
表1 胆汁反流性胃炎胃黏膜病变情况 n(%)
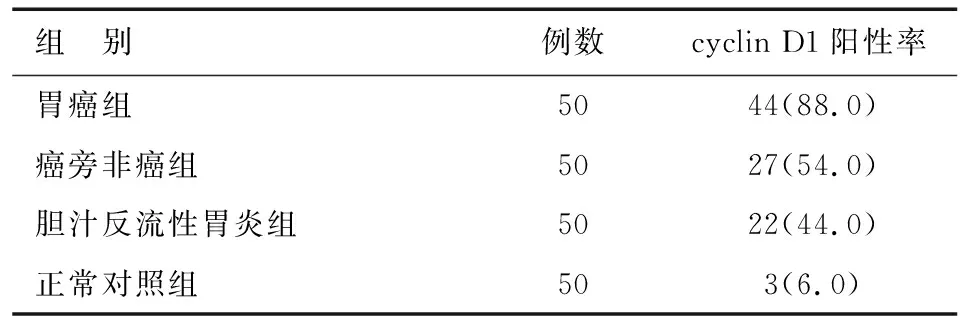
表2 四组间cyclin D1表达阳性率比较n(%)
讨 论
胆汁反流性胃炎是由于幽门功能不全、胃窦十二指肠协调运动障碍、胃排空延迟或胆囊功能障碍等因素导致过量含胆汁的十二指肠液返流入胃,破坏胃黏膜表面黏液屏障,损伤黏膜上皮,引起充血、水肿等炎性改变,其临床表现缺乏特异性,主要依靠胃镜诊断。研究[8-11]显示,长期胆汁反流可导致胃小凹上皮和食管鳞状上皮增生,并可能与肠化生甚至癌变有关。胆汁反流亦是导致Barrett食管及其恶性进展的重要因素。本研究中,胆汁反流性胃炎组发生肠上皮化生和异型增生的比例分别为36.0%和44.0%,显著高于正常胃黏膜组(分别为6%、10%),提示胆汁反流性胃炎可能与胃癌的发生有一定关系。
Cyclin D是一组调控真核细胞周期进展的重要蛋白分子,cyclin D1属于其中一个重要亚型,是癌基因中的一种。Cyclin D1可结合细胞周期蛋白依赖激酶4(CDK4)形成复合物cyclin D1-CDK4,使Rb蛋白磷酸化,解除Rb基因抑制G期的作用。生理状态下,细胞进入S期后cyclin D1迅速分解。cyclin D1过表达可缩短G1期,促进细胞进入S期[12]。对胃癌和癌前病变组织的研究[7,13]显示,胃黏膜上皮癌变早期阶段可见cyclin D1过表达,提示cyclin D1是重要的胃癌促发因素,可作为潜在的胃癌早期诊断的分子标志。
本研究显示,cyclin D1在正常胃黏膜组织、胆汁反流性胃炎组织、癌旁非癌组织以及胃癌组织中的阳性表达率逐渐升高,且在胃癌组织中显著高于其余三组,提示cyclin D1在胃癌恶性演变过程中发挥重要作用。此外,cyclin D1在胆汁反流性胃炎组织中的表达显著高于正常胃黏膜组织,但在癌旁非癌组织和胆汁反流性胃炎组织中无显著差异,提示cyclin D1可能参与了胆汁反流性胃炎发展为胃癌的过程。
综上所述,胆汁反流性胃炎作为临床上较常见的一种慢性胃炎,与肠上皮化生和异型增生等胃黏膜癌前病变密切相关。癌基因cyclin D1在胃癌和胆汁反流性胃炎组织中高表达,提示其可能参与了胆汁反流性胃炎发展为胃癌的过程,与胃癌的发生、发展存在一定关系,是重要的胃癌促发因素,可作为潜在的胃癌早期诊断的分子标志。
1 Dixon MF, Mapstone NP, Neville PM, et al. Bile reflux gastritis and intestinal metaplasia at the cardia[J]. Gut, 2002, 51 (3): 351-355.
2 林金坤,曾志荣,高修仁. 十二指肠胃反流与胃黏膜炎症关系探讨[J]. 中华消化杂志, 2004, 24 (2): 87-89.
3 Maddika S, Ande SR, Panigrahi S, et al. Cell survival, cell death and cell cycle pathways are interconnected: implications for cancer therapy[J]. Drug Resist Updat, 2007, 10 (1-2): 13-29.
4 王吉,顾玮,葛心怡,等. 胆汁反流性胃炎胃黏膜Th1/Th2平衡的研究[J]. 胃肠病学, 2012, 17 (6): 358-362.
5 中华医学会消化病学分会. 全国慢性胃炎研讨会共识意见[J]. 中华消化杂志, 2000, 20 (3): 199-201.
6 Dixon MF, Genta RM, Yardley JH, et al. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994[J]. Am J Surg Pathol, 1996, 20 (10): 1161-1181.
7 孙桂彬,杨景国,李永华,等. PTEN、p16和CyclinD1在胃癌及癌前病变中表达的研究[J]. 现代中西医结合杂志, 2012, 21 (15): 1614-1615.
8 Dresner SM, Griffin SM, Wayman J, et al. Human model of duodenogastro-esophageal reflux in the development of Barrett’s metaplasia[J]. Br J Surg, 2003, 90 (9): 1120-1128.
9 Jürgens S, Meyer F, Spechler SJ, et al. The role of bile acids in the neoplastic progression of Barrett’s esophagus - a short representative overview[J]. Z Gastroenterol, 2012, 50 (9): 1028-1034.
10 Kauer WK, Stein HJ. Emerging concepts of bile reflux in the constellation of gastroesophageal reflux disease[J]. J Gastrointest Surg, 2010, 14 Suppl 1: S9-S16.
11 Hong J, Behar J, Wands J, et al. Bile acid reflux contributes to development of esophageal adenocarcinoma via activation of phosphatidylinositol-specific phospholipase Cgamma2 and NADPH oxidase NOX5-S[J]. Cancer Res, 2010, 70 (3): 1247-1255.
12 Motokura T, Bloom T, Kim HG, et al. A novel cyclin encoded by a bcl1-linked candidate oncogene[J]. Nature, 1991, 350 (6318): 512-515.
13 Arici DS, Tuncer E, Ozer H, et al. Expression of retinoblastoma and cyclin D1 in gastric carcinoma[J]. Neoplasma, 2009, 56 (1): 63-67.

