5-HT转运体基因启动子区多态性与便秘型肠易激综合征易感性关系的meta分析*
张 伟 孙建华 沈 洪 裴丽霞 吴晓亮 陈 璐 焦黛妍
南京中医药大学第二临床医学院1(210046) 江苏省中医院针灸康复科2 消化内科3
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的功能性肠病,我国的发病率为4%~9%[1-3],欧美国家高达10%~20%[4-5]。随着社会节奏和生活方式的改变,便秘型IBS(constipation-predominant IBS, C-IBS)的发病率逐渐上升[6],但其病因和发病机制目前尚不明确,可能涉及胃肠动力障碍、内脏高敏感、社会心理因素、脑-肠轴功能异常以及遗传和环境因素等。5-羟色胺(5-HT)作为一种调节胃肠运动和分泌的重要神经递质和信号分子,在C-IBS的发病机制中具有重要意义[7]。
肠道5-HT生物活性的终止主要通过高亲和力的跨膜转运体即5-羟色胺转运体(SERT)完成,SERT在调节脑肠互动和胃肠功能性疾病中具有重要意义[8]。人SERT约由630个氨基酸残基组成,其编码基因(SLC6A4)位于17号染色体长臂11.1-12,由14个外显子组成。SERT蛋白表达受其基因多态性的影响,编码SERT蛋白的基因存在3个多态区域,目前研究较多的是5-HT转运体基因启动子区(serotonin transporter gene-linked polymorphic region, 5-HTTLPR)。5-HTTLPR由20~23个碱基对重复14和16次,分别形成长型(L)和短型(S)等位基因。目前,已有多项5-HTTLPR多态性与C-IBS关系的病例对照研究,但由于样本量小、地域和种族等差异,各研究结论不一。本研究通过对国内外公开发表的5-HTTLPR与C-IBS的研究行meta分析,旨在评价两者的关系,以期为将来的基础研究和临床治疗提供更多信息。
资料与方法
一、检索策略
计算机检索PubMed、Embase、Web of Science、中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)和万方学术期刊全文数据库等,检索时限均为建库至2013年9月,根据不同的数据库,采取主题词和自由词检索相结合的方式[Pubmed(MeSH)、Embase(EMTREE)、CBM(主题词)],并根据数据库进行调整,同时追索已纳入文献和相关综述的参考文献。中文检索词包括:肠易激综合征、5-羟色胺、5-HT、血清素、多态,英文检索词包括:Irritable bowel syndrome、polymorphism、mutat*、variat*、5-hydroxytryptamine、 serotonin、Serotonin Transporter、5-HTTLPR。以PubMed为例,英文检索策略如下:((((Irritable bowel syndrome) OR Irritable bowel syndrome[MeSH Terms])) AND (((polymorphism) OR mutat*) OR variat*)) AND ((((5-hydroxytryptamine) OR serotonin) OR Serotonin Transporter) OR 5-HTTLPR)。
二、纳入标准和排除标准
纳入标准:①关于5-HTTLPR多态性与C-IBS发病相关性的病例对照研究,文种限中文/英文;②病例组为C-IBS患者,患者性别、年龄、病程不限,对照组为与病例组患者无血缘关系的健康人群;③研究中含有等位基因或基因型数据,有或可计算出OR值和95% CI;④对照组基因型分布符合Hardy-Weinberg(H-W)遗传平衡规律。
排除标准:①前瞻性研究;②重复报告的文献;③会议摘要、评论、仅以文献形式报告且信息不全。
三、资料筛选与提取
由两名研究人员按照事先制定的纳入和排除标准同时单独纳入和排除文献,交叉核对,如遇分歧时通过讨论解决,必要时提交第三名研究者裁定。按预先设计的资料提取表,由一名研究者提取和录入资料,另一名研究者核对。资料提取内容包括研究作者、年份、病例收集地点、研究对象的基本资料、病例组和对照组来源、样本量、基因型数量等。
四、文献质量评价
两位评价者采用STREGA标准评价病例对照研究的质量:①样本量充分与否;②诊断标准清楚与否;③分组匹配情况如何;④对照组基因型分布是否符合H-W遗传平衡定律;⑤基因检测方法是否合理;⑥数据是否充分。每满足一项记1分,总分≥3分者,认为研究质量可靠。如遇分歧通过讨论解决。
五、统计学分析
采用Stata 12.0统计软件行meta分析,合并效应量选用OR值和95% CI,OR值的计算分别根据等位基因模型(Lvs. S)、共显性遗传模型(LLvs. SS、LLvs. LS)、隐性遗传模型(LLvs. LS+SS)、显性遗传模型(LL+LSvs. SS),采用χ2检验计算对照组的基因分布是否符合H-W遗传平衡。各研究结果间的异质性采用Q检验,检验水准为α=0.1,当各研究结果间具有同质性(P>0.1)时,采用固定效应模型;反之,则采用随机效应模型。发表偏倚的定量检测采用Egger直线回归法,P<0.05为存在发表偏倚。
结 果
一、文献检索结果
初步检出354篇文献,通过相关文献管理软件(EndNote X6)剔除重复文献166篇,阅读文题和摘要排除综述、动物研究、摘要等不符合纳入标准的文献164篇;进一步查阅全文,排除学位论文和公开发表论文重复文献7篇,1篇无法提取数据计算OR值和95%CI,2篇研究对照组基因分布不符合H-W遗传平衡定律,最终共纳入14篇文献,包含749例C-IBS患者和1 821名健康对照者,其中6项研究分析了高加索人群[9-14],8项研究的对象为亚洲人群[15-22]。纳入文献质量评分为5~6分,说明各研究质量可靠。纳入研究的基本特征见表1。
二、meta分析结果
对14项研究的合并分析显示5-HTTLPR多态性与C-IBS风险相关(Lvs. S: OR=1.21, 95% CI: 1.03~1.47; LLvs. SS: OR=1.57, 95% CI: 1.08~2.29; LLvs. LS: OR=1.68, 95% CI: 1.12~2.54; LLvs. LS+SS: OR=1.59, 95% CI: 1.14~2.23)(见表2),说明携带L等位基因和LL基因型的人群患C-IBS的风险高于携带S等位基因、SS基因型和LS基因型的人群。
三、亚组分析
根据人种行亚组分析,结果显示在高加索人群中5-HTTLPR多态性与C-IBS发病风险相关,其中Lvs. S、LLvs. SS和LLvs. LS+SS遗传模型与C-IBS发病风险存在相关性(Lvs. S: OR=1.27, 95% CI: 1.04~1.54; LLvs. SS: OR=1.58, 95% CI: 1.06~2.37; LLvs. LS+SS: OR=1.36, 95% CI: 1.01~1.82)(见图1),说明携带L等位基因和LL基因型的人群较其他基因型人群患C-IBS的风险增高;而在亚洲人群中, 5-HTTLPR多态性与C-IBS发病风险无明显相关性(见图2)
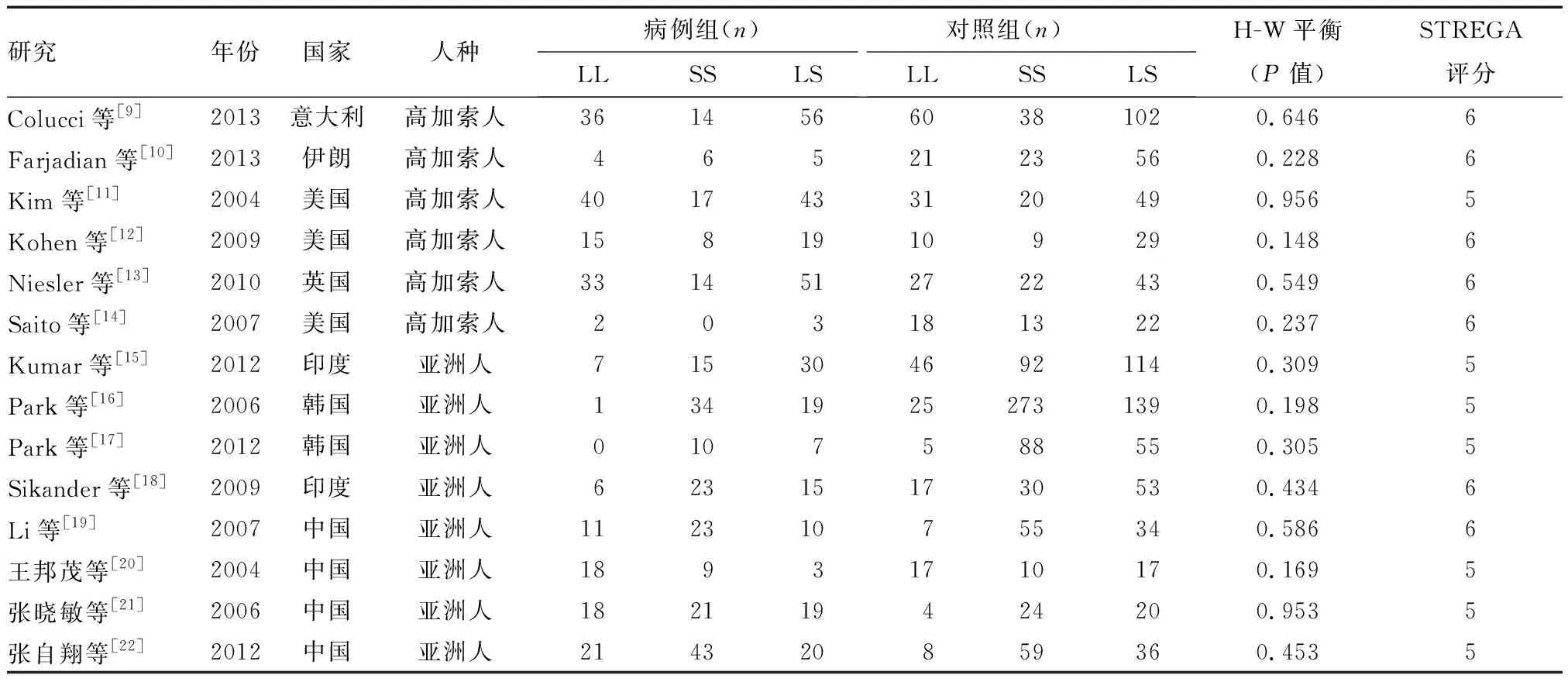
表1 纳入研究基本特征
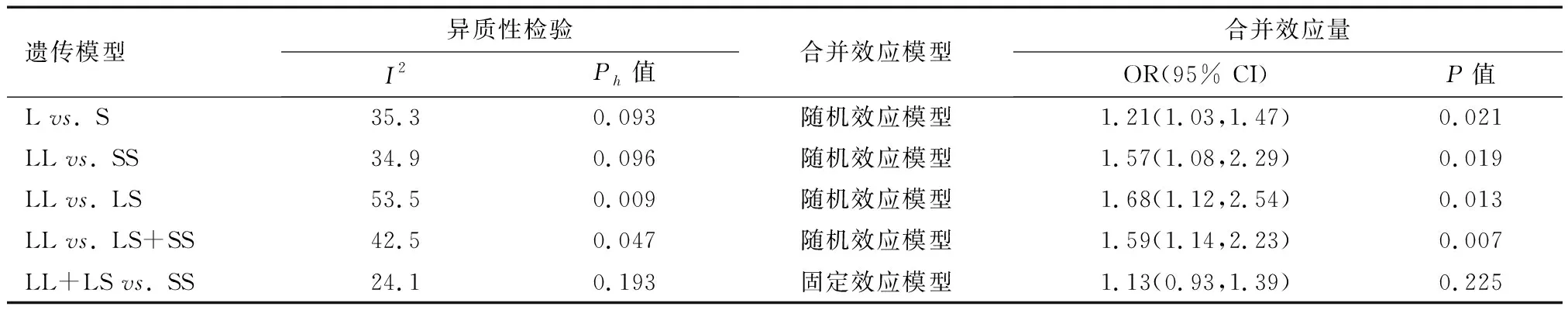
表2 5-HTTLPR多态性与C-IBS发病风险的meta分析结果
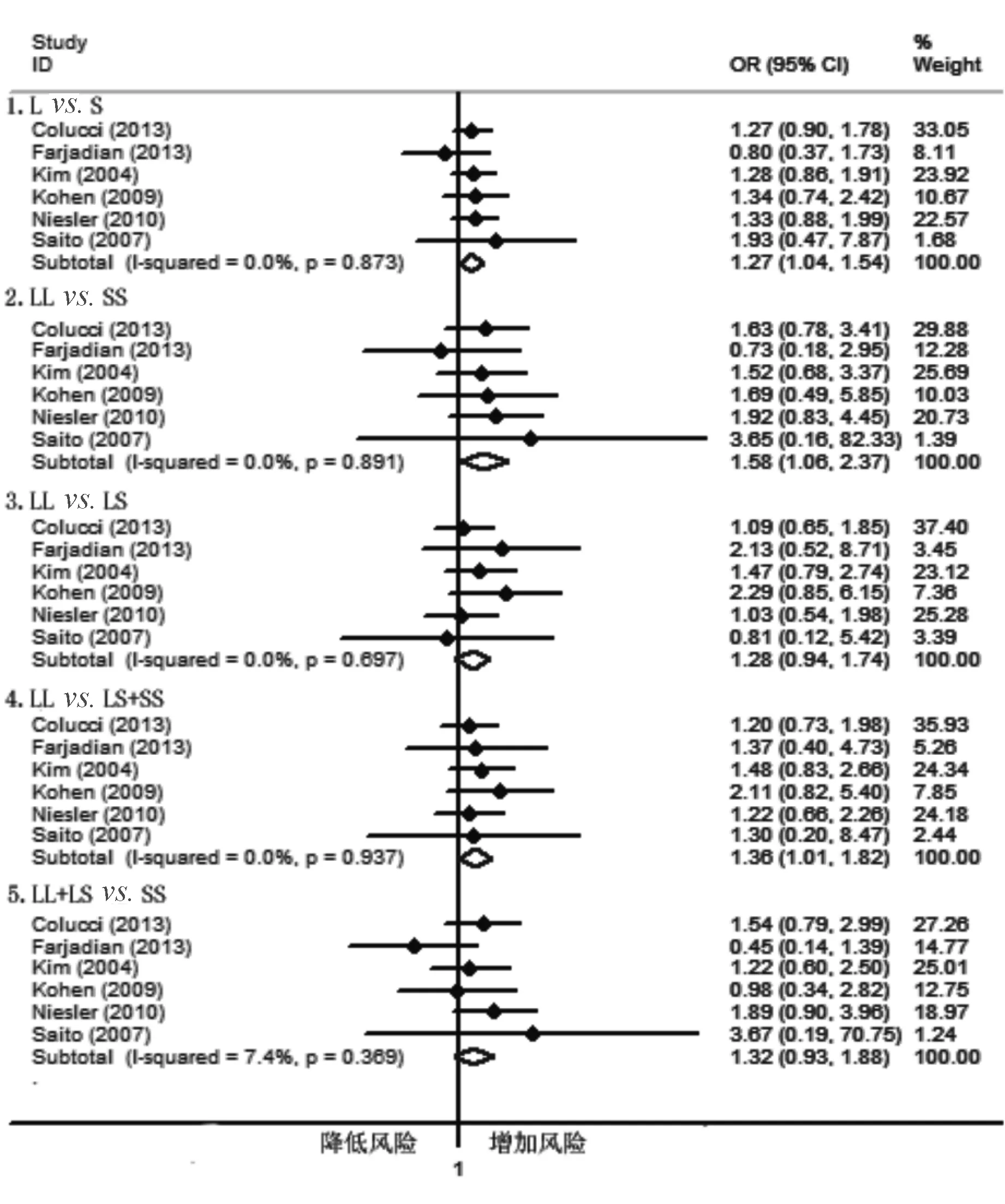
图1 高加索人群5-HTTLPR多态性与C-IBS发病相关性的meta分析
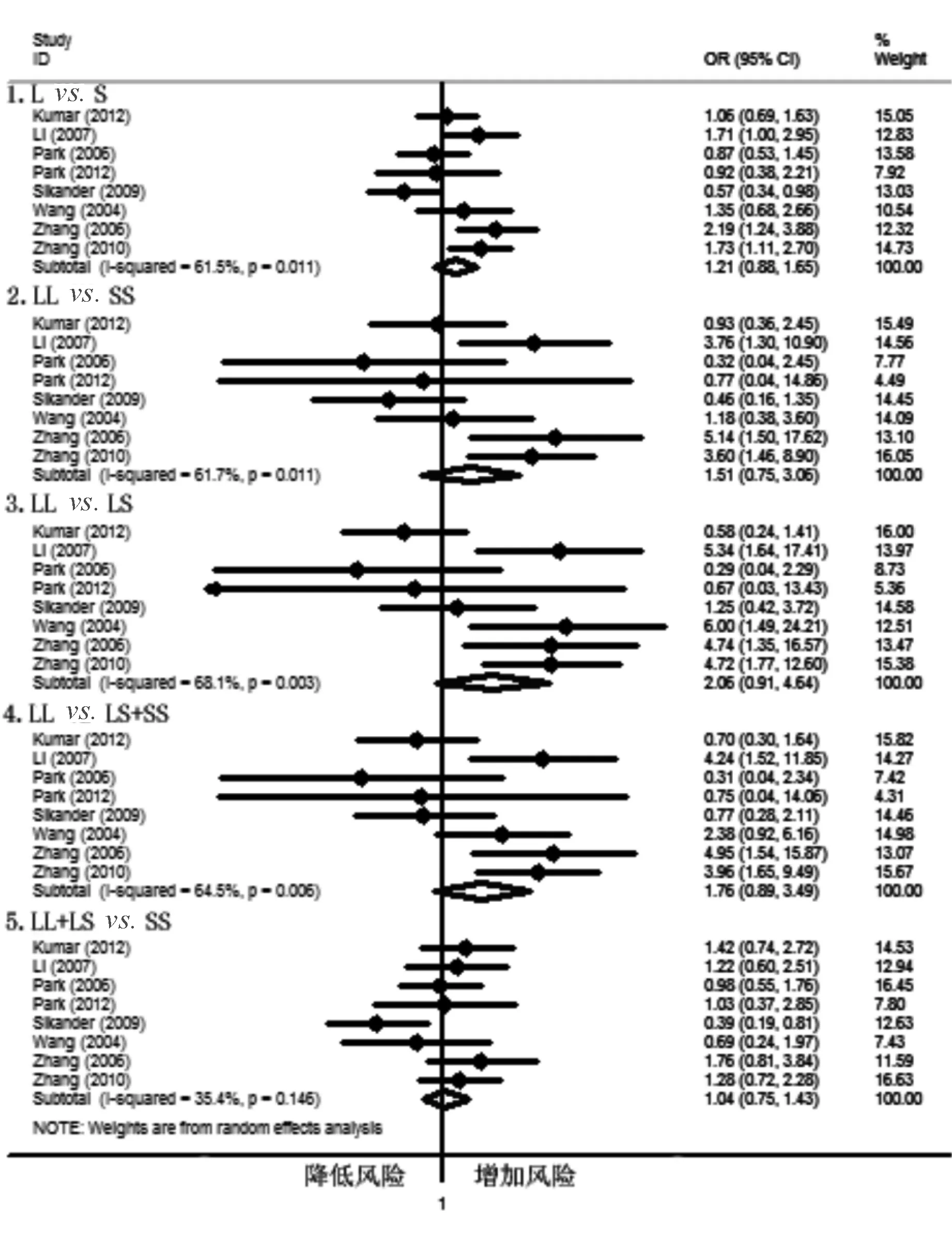
图2 亚洲人群5-HTTLPR多态性与C-IBS发病相关性的meta分析
四、发表偏倚
Egger显性回归结果显示5-HTTLPR多态性与C-IBS易感性关系的各项研究未见发表偏倚(P>0.05)。
讨 论
SERT是5-HT信号系统中必需的成员,可将效应部位的5-HT迅速降解和再摄取,精细调控5-HT在胃肠道中的含量。5-HTTLPR是编码SERT基因的重要多态性位点之一,其位于5’端转录起始点上游 1 000 bp的启动子区内,该区插入或缺失44个碱基对或其整倍数碱基对的核心序列可产生不同的基因型。目前对5-HTTLPR多态性与C-IBS发病风险的关系尚存在争议,Farjadian等[10]的研究认为5-HTTLPR多态性与C-IBS发病无关; Pata等[23]发现C-IBS组中SS基因型频率明显高于其他类型IBS,携带SS基因型人群更易患C-IBS,并推测5-HTTLPR的S等位基因SERT转录效率较L等位基因降低,突触间隙5-HT含量堆积,导致突触后5-HT受体脱敏,肠道动力降低。而有研究[19-21]认为C-IBS患者的LL基因型频率高于对照组或其他类型IBS,说明携带LL基因型人群更易患C-IBS。上述研究结果不一致的原因可能与种族差异、单项研究样本量小以及膳食结构等环境因素的干扰有关。本研究纳入的14项研究文献质量可靠,行meta分析显示,5-HTTLPR多态性与C-IBS总人群患病相关,但这种相关性存在人种差异。在高加索人种中,携带L等位基因和LL基因型者的C-IBS发病危险明显增加,而在亚洲人群中,5-HTTLPR多态性与C-IBS发病风险无关。
本meta分析存在一定局限性:①一般高加索人种中LL基因型频率明显高于SS基因型[24],而在亚洲人群中L等位基因频率较低,SS基因型占主导地位[16,22],且合并分析研究的样本量较小,可能影响研究结果的可靠性;②C-IBS的发病可能同时受多种因素影响,由于原始数据的缺乏而未能控制性别、年龄等混杂因素的影响。
综上所述,5-HTTLPR多态性与C-IBS发病风险存在种族差异,在高加索人群中,携带L等位基因和LL基因型人群与C-IBS患病风险具有相关性,但由于存在相关局限性,上述结论仍需进一步研究。
1 Zhao Y, Zou D, Wang R, et al. Dyspepsia and irritable bowel syndrome in China: a population-based endoscopy study of prevalence and impact[J]. Aliment Pharmacol Ther, 2010, 32 (4): 562-572.
2 Dong YY, Zuo XL, Li CQ, et al. Prevalence of irritable bowel syndrome in Chinese college and university students assessed using Rome Ⅲ criteria[J]. World J Gastroenterol, 2010, 16 (33): 4221-4226.
3 Lau EM, Chan FK, Ziea ET, et al. Epidemiology of irritable bowel syndrome in Chinese[J]. Dig Dis Sci, 2002, 47 (11): 2621-2624.
4 Krogsgaard LR, Engsbro AL, Bytzer P. The epidemiology of irritable bowel syndrome in Denmark. A population-based survey in adults ≤50 years of age[J]. Scand J Gastroenterol, 2013, 48 (5): 523-529.
5 Saito YA, Schoenfeld P, Locke GR 3rd. The epidemiology of irritable bowel syndrome in North America: a systematic review[J]. Am J Gastroenterol, 2002, 97 (8): 1910-1915.
6 Fortea J, Prior M. Irritable bowel syndrome with constipation: a European-focused systematic literature review of disease burden[J]. J Med Econ, 2013, 16 (3): 329-341.
7 Wang SH, Dong L, Luo JY, et al. Decreased expression of serotonin in the jejunum and increased numbers of mast cells in the terminal ileum in patients with irritable bowel syndrome[J]. World J Gastroenterol, 2007, 13 (45): 6041-6047.
8 Colucci R, Blandizzi C, Bellini M, et al. The genetics of the serotonin transporter and irritable bowel syndrome[J]. Trends Mol Med, 2008, 14 (7): 295-304.
9 Colucci R, Gambaccini D, Ghisu N, et al. Influence of the serotonin transporter 5HTTLPR polymorphism on symptom severity in irritable bowel syndrome[J]. PLoS One, 2013, 8 (2): e54831.
10 Farjadian S, Fakhraei B, Moeini M, et al. Serotonin transporter gene polymorphisms in Southwestern Iranian patients with irritable bowel syndrome[J]. Arab J Gastroenterol, 2013, 14 (2): 59-62.
11 Kim HJ, Camilleri M, Carlson PJ, et al. Association of distinct alpha(2) adrenoceptor and serotonin transporter polymorphisms with constipation and somatic symptoms in functional gastrointestinal disorders[J]. Gut, 2004, 53 (6): 829-837.
12 Kohen R, Jarrett ME, Cain KC, et al. The serotonin transporter polymorphism rs25531 is associated with irritable bowel syndrome[J]. Dig Dis Sci, 2009, 54 (12): 2663-2670.
13 Niesler B, Kapeller J, Fell C, et al. 5-HTTLPR and STin2 polymorphisms in the serotonin transporter gene and irritable bowel syndrome: effect of bowel habit and sex[J]. Eur J Gastroenterol Hepatol, 2010, 22 (7): 856-861.
14 Saito YA, Locke GR 3rd, Zimmerman JM, et al. A genetic association study of 5-HTT LPR and GNbeta3 C825T polymorphisms with irritable bowel syndrome[J]. Neurogastroenterol Motil, 2007, 19 (6): 465-470.
15 Kumar S, Ranjan P, Mittal B, et al. Serotonin transporter gene (SLC6A4) polymorphism in patients with irritable bowel syndrome and healthy controls[J]. J Gastrointestin Liver Dis, 2012, 21 (1): 31-38.
16 Park JM, Choi MG, Park JA, et al. Serotonin transporter gene polymorphism and irritable bowel syndrome[J]. Neurogastroenterol Motil, 2006, 18 (11): 995-1000.
17 Park CS, Uhm JH. Polymorphisms of the serotonin transporter gene and G-protein β3 subunit gene in Korean children with irritable bowel syndrome and functional dyspepsia[J]. Gut Liver, 2012, 6 (2): 223-228.
18 Sikander A, Rana SV, Sinha SK, et al. Serotonin transporter promoter variant: Analysis in Indian IBS patients and control population[J]. J Clin Gastroenterol, 2009, 43 (10): 957-961.
19 Li Y, Nie Y, Xie J, et al. The association of serotonin transporter genetic polymorphisms and irritable bowel syndrome and its influence on tegaserod treatment in Chinese patients[J]. Dig Dis Sci, 2007, 52 (11): 2942-2949.
20 王邦茂, 王玉明, 张维铭, 等. 肠易激综合征患者5-羟色胺转运体的基因多态性[J]. 中华内科杂志, 2004, 43 (6): 439-441.
21 张晓敏, 林志辉. 5-羟色胺转运体基因多态性与肠易激综合征的相关性[J]. 世界华人消化杂志, 2006, 14 (18): 1790-1794.
22 张自翔, 谢军, 黄才斌, 等. 便秘型肠易激综合征的SERT基因多态性及其与患者临床疗效的关系[J]. 山东医药, 2012, 52 (25): 16-18.
23 Pata C, Erdal ME, Derici E, et al. Serotonin transporter gene polymorphism in irritable bowel syndrome[J]. Am J Gastroenterol, 2002, 97 (7): 1780-1784.
24 Saito YA, Larson JJ, Atkinson EJ, et al. The role of 5-HTT LPR and GNβ3 825C>T polymorphisms and gene-environment interactions in irritable bowel syndrome (IBS) [J]. Dig Dis Sci, 2012, 57 (10): 2650-2657.

