血清miRNA作为胃癌早期诊断标记物的初步研究
国 芳 姚玮艳 戴 欣 王 成 周郁芬 张 帆 袁耀宗*
上海交通大学医学院附属瑞金医院消化内科1(200025) 南京大学生命科学学院2
胃癌是最常见的恶性肿瘤之一,其发病率仅次于肺癌、乳腺癌、结直肠癌位居第四位,且死亡率居高不下,位于恶性肿瘤第二位[1-2]。胃癌的五年生存率与胃癌分期显著相关,Ⅰ期可达90%左右,而Ⅳ期不足5%[3-4]。胃癌早期血清标记物可使肿瘤局限于黏膜下层时得到明确诊断并及时采取治疗,可大大改善预后。但目前缺乏胃癌早期敏感的血清指标[5],大多数患者诊断时已处于进展期甚至伴有远处转移,预后较差。
近年发现微小核糖核酸(miRNA)与肿瘤发生、发展密切相关,其不仅在肿瘤组织中异常表达,肿瘤患者血清中亦可见特征性、稳定的miRNA表达谱,对肿瘤的诊断、分类、治疗以及预后均具有重要价值[6-7]。目前已有多项研究[8-9]证实胃癌患者血清miRNA表达谱存在明显差异。Liu等[10]通过SOLEXA测序、qRT-PCR法证实五个miRNA(miR-1、miR-20a、miR-27a、miR-34a和miR-423-5p)可作为血清标记物诊断胃癌。本实验在此基础上,探讨这5个血清miRNA对胃癌早期诊断的价值。
对象与方法
一、研究对象
收集2011年7月~2012年2月上海交通大学医学院附属瑞金医院经胃镜或手术病理检查证实的胃癌患者180例。其中男120例,女60例;年龄24~89岁,平均(59.3±12.5)岁;进展期胃癌149例,早期胃癌31例。早期胃癌定义沿用1962年日本制定的标准,即术后病理示肿瘤局限于黏膜层和黏膜下层,伴或不伴有淋巴结转移;进展期胃癌指肿瘤已突破黏膜下层。同时排除其他肿瘤以及系统性疾病患者。收集同期癌前变化(包括癌前状态和癌前病变)患者49例,其中胃息肉15例,胃溃疡25例,癌前病变9例;男37例,女12例;年龄14~81岁,平均(57.0±14.3)岁;收集57名性别、年龄与胃癌患者基本匹配的健康人作为正常对照组,其中男37名,女20名;年龄22~79岁,平均(57.4±12.7)岁。本研究方案经上海交通大学附属瑞金医院伦理委员会批准,所有入选者均获知情同意书。
二、研究方法
1. 标本采集:采集病例组未经任何治疗(放疗、化疗、手术)的空腹肘部静脉血2 mL(其中12例进展期胃癌患者同时采集术后6~8 d血标本2 mL),并采集正常对照组空腹血样2 mL,1500 r/min离心10 min,收集血清,-20 ℃保存备检。
2. 血清miRNA提取:取100 μL样品加入300 μL DEPC水,酸性酚-氯仿法提取总RNA,所提取的RNA加入20 μL DEPC水溶解沉淀,-80 ℃保存备用。
3. 制备cDNA:所提取RNA与AMV酶(Takara公司)、RT-primer(ABI公司)等制备逆转录体系,合成cDNA。
4. 实时荧光定量PCR(qRT-PCR)法:参照Taqman miRNA(ABI公司)qRT-PCR说明书制备反应体系,于ABI Prism 7300荧光定量PCR仪中行扩增和荧光信号检测,反应条件:95 ℃预变性15 min;95 ℃变性15 s,60 ℃退火60 s,共40个循环。以let-7作为内参,采用2-ΔΔCT法计算各目标miRNA相对表达量,结果用倍数表示(fold change)。
三、统计学分析
结 果
一、血清miRNA检测结果
qRT-PCR结果显示,胃癌患者中miR-1、miR-20a、miR-34a、miR-423-5p的表达分别为正常对照组的2.40倍(P<0.000 1)、2.00倍(P<0.000 1)、1.36倍(P=0.001 0)、1.28倍(P=0.049 6),尤以前两者升高更为显著;miR-27a表达虽有所上升,但差异无统计学意义(P=0.059 9)。早期胃癌miR-1和miR-20a表达分别为正常对照组的1.80和1.45倍(P均<0.000 1),其余miRNA表达差异无统计学意义。进展期胃癌患者miR-1、miR-20a、miR-34a、miR-423-5p表达分别为正常对照组的2.53倍(P<0.000 1)、2.11倍(P<0.000 1)、1.38倍(P=0.000 5)、1.31倍(P=0.024 5),且均高于早期胃癌组,但仅miR-1表达差异有统计学意义(P=0.012 1),提示miR-1表达可能与胃癌分期相关。与正常对照组相比,癌前变化组miR-1、miR-20a、miR-34a表达分别升高1.21、1.15、1.16倍,但差异无统计学意义。miR-1、miR-20a、miR-34a表达在癌前变化-早期胃癌-进展期胃癌三个不同阶段中呈动态升高的趋势(见表1、图1)。
二、术前、术后miRNA表达比较
12例进展期胃癌患者术后五个miRNA表达均不同程度下降,其中miR-1表达差异有统计学意义(P=0.018 5)(见表2)。 提示miRNA可能可作为胃癌随访监测的指标。
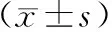
表1 各组五个血清miRNA检测结果
*与正常对照组比较,P<0.05;#与早期胃癌组比较,P<0.05
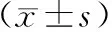
表2 进展期胃癌患者术前、术后miRNA表达比较
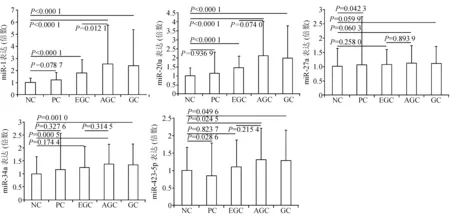
NC:正常对照组;PC:癌前变化组;EGC:早期胃癌组; AGC:进展期胃癌组;GC:胃癌组
三、胃癌组与早期胃癌组特异性血清miRNA的ROC曲线分析
选取胃癌患者表达显著升高的4种miRNA和早期胃癌患者表达显著升高的2种miRNA,绘制单独或联合ROC曲线。结果显示miR-1、miR-20a、miR-34a、miR-423-5p诊断胃癌的ROC曲线下面积(AUC)分别为0.894 9、0.814 8、0.644 8、0.589 7,四者联合的AUC为0.921 1。miR-1和miR-20a诊断早期胃癌的AUC分别为0.813 8、0.774 2,两者联合的AUC为0.865 3。
miR-1诊断胃癌的敏感性和特异性分别为87.3%和77.1%,miR-20a分别为87.6%和 64.1%,miR-34a分别为59.4%和67.8%,miR-423-5p分别为87.3%和31.6%,miR-1与miR-20a联合的敏感性和特异性分别为77.1%和81.4%,四者联合的敏感性和特异性分别为85.8%和83.3%。miR-1诊断早期胃癌的敏感性和特异性分别为79.0%和 70.9%,miR-20a分别为66.9%和87.0%,两者联合的诊断敏感性和特异性分别为80.5%和83.6%。
讨 论
目前我国早期胃癌诊断率仍远低于日本,寻找敏感的肿瘤标记物可能有助于提高早期胃癌诊断率。但目前应用较多的CA724、CA19-9、CEA等指标的敏感性与特异性在胃癌诊断中尚不尽如人意,在胃癌早期诊断中的应用更局限[5],如何找到胃癌高位预警、早期诊断与预后判断的生物标记物,始终是困扰临床工作者的一大难题。
miRNA为目前研究最为广泛的一类内源性非编码小分子RNA,可与蛋白结合形成RNA诱导沉默复合物(RISC)后与靶标mRNA以碱基互补方式结合,进而降解靶标分子或抑制蛋白的翻译过程。miRNA在转录后水平上调控超过1/3的蛋白编码基因[11],在细胞增殖、分化、发育、凋亡等多种生理病理过程中发挥重要作用。目前miRNA在多种肿瘤中的特异性表达及其诊断作用已被证实[12-14],其在胃癌诊断方面亦有重要作用。
有研究[15]认为miR-1和miR-27a可作为良好的标记物预测胃癌患者对化疗的反应,低表达miR-1和miR-27a者有较好的化疗敏感性。 Li等[16]发现miR-20a可通过调节EGR2信号通路发挥促进胃癌细胞生长、迁徙、浸润的作用;Cai等[17]采用qRT-PCR法检测90例胃癌患者和90名正常对照组多种血清miRNA的表达水平,结果显示胃癌患者中血清miR-20a表达较正常对照显著升高。Osawa等[18]对胃癌患者的石蜡包埋组织行miRNA检测发现,miR-34a在胃癌组织中过表达,多变量Cox比例风险模型结果显示miR-34a可作为胃癌独立的预后因素。有研究[19]发现miR-423-5p可通过抑制TFF1抑癌基因的表达促进胃癌细胞增殖。本研究发现,血清miR-1、miR-20a、miR-34a、miR-423-5p表达在胃癌患者中上升显著,且联合诊断胃癌的敏感性和特异性较高,优于He等[20]的研究中CA19-9、CEA等指标的诊断效能;Chen等[21]基于中国人群的meta分析显示,CA724+CA19-9+CEA联合诊断胃癌的敏感性为74%。
以往国内外miRNA与胃癌的报道多以胃癌组织为研究对象,临床上难以用于开展胃癌普查工作。目前逐渐开展血清miRNA在胃癌诊断中的研究,但胃癌早期诊断的报道不多见。本研究进一步统计发现miR-1、miR-20a表达在早期胃癌阶段即已发生显著改变。提示其可作为胃癌早期诊断的标记物。有研究[22]发现miR-199a-3p表达在胃癌早期即发生变化;Li等[23]的研究发现早期胃癌患者血清miR-223、miR-21表达显著上升。上述研究说明miRNA表达与胃癌关系密切,可在癌肿病变早期、局限时即发生变化,并可于血清中检出,miRNA有潜力作为候选肿瘤标记物诊断早期胃癌。
本研究中miR-1与miR-20a联合诊断早期胃癌的AUC为0.865 3,高于ITIH3(AUC=0.864)[24]和miR-199a-3p(AUC=0.818)[22]等的胃癌早期诊断效能。本研究中癌前变化组部分miRNA表达已有所增高,而进展期胃癌各个miRNA表达均较早期胃癌有一定程度的上升,其中miR-1的升高有统计学意义;提示miRNA表达可能在胃癌癌前病变状态就发生一定改变,而miRNA表达与胃癌分期密切相关,显示出其作为胃癌标记物用于早期诊断的优势。
本研究还发现进展期胃癌患者术后5个miRNA有不同程度下降,其中miR-1的下降差异有统计学意义。提示miRNA可能可作为预后随访监测的标记物。Huang等[15]的研究发现高表达miR-1患者肝脏转移的发生率更高,一定程度上提示其在预后中的作用。拟后续延长随访时间,进一步评估miRNA在胃癌随访监测中的价值。
综上所述,本研究所采用的5个血清miRNA分子诊断模型具备采集方便、敏感性高、可用于早期诊断、随访监测等特点,为胃癌早期诊断的研究提供了新的思路。但目前不同研究报道[10,17,25,26]的血清miRNA表达谱结果一致度不高,故如何建立一个良好、可重复性高的miRNA诊断模型等问题仍需进一步研究。
1 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90.
2 Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12): 2893-2917.
3 Nakamura K, Ueyama T, Yao T, et al. Pathology and prognosis of gastric carcinoma. Findings in 10,000 patients who underwent primary gastrectomy[J]. Cancer, 1992, 70 (5): 1030-1037.
4 Matsuda T, Ajiki W, Marugame T, et al; Research Group of Population-Based Cancer Registries of Japan. Population-based survival of cancer patients diagnosed between 1993 and 1999 in Japan: a chronological and international comparative study[J]. Jpn J Clin Oncol, 2011, 41 (1): 40-51.
5 Shimada H, Noie T, Ohashi M, et al. Clinical significance of serum tumor markers for gastric cancer: a systematic review of literature by the Task Force of the Japanese Gastric Cancer Association[J]. Gastric Cancer, 2014, 17 (1): 26-33.
6 Chen X, Ba Y, Ma L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18 (10): 997-1006.
7 Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci U S A, 2008, 105 (30): 10513-10518.
8 Zhou H, Guo JM, Lou YR, et al. Detection of circulating tumor cells in peripheral blood from patients with gastric cancer using microRNA as a marker[J]. J Mol Med (Berl), 2010, 88 (7): 709-717.
9 Tsujiura M, Ichikawa D, Komatsu S, et al. Circulating microRNAs in plasma of patients with gastric cancers[J]. Br J Cancer, 2010, 102 (7): 1174-1179.
10 Liu R, Zhang C, Hu Z, et al. A five-microRNA signature identified from genome-wide serum microRNA expression profiling serves as a fingerprint for gastric cancer diagnosis[J]. Eur J Cancer, 2011, 47 (5): 784-791.
11 Wiemer EA. The role of microRNAs in cancer: no small matter[J]. Eur J Cancer, 2007, 43 (10): 1529-1544.
12 Yu S, Liu Y, Wang J, et al. Circulating microRNA profiles as potential biomarkers for diagnosis of papillary thyroid carcinoma[J]. J Clin Endocrinol Metab, 2012, 97 (6): 2084-2092.
13 Wu Q, Wang C, Lu Z, et al. Analysis of serum genome-wide microRNAs for breast cancer detection[J]. Clin Chim Acta, 2012, 413 (13-14): 1058-1065.
14 Hennessey PT, Sanford T, Choudhary A, et al. Serum microRNA biomarkers for detection of non-small cell lung cancer[J]. PLoS One, 2012, 7 (2): e32307.
15 Huang D, Wang H, Liu R, et al. miRNA27a is a biomarker for predicting chemosensitivity and prognosis in metastatic or recurrent gastric cancer[J]. J Cell Biochem, 2014, 115 (3): 549-556.
16 Li X, Zhang Z, Yu M, et al. Involvement of miR-20a in promoting gastric cancer progression by targeting early growth response 2 (EGR2) [J]. Int J Mol Sci, 2013, 14 (8): 16226-16239.
17 Cai H, Yuan Y, Hao YF, et al. Plasma microRNAs serve as novel potential biomarkers for early detection of gastric cancer[J]. Med Oncol, 2013, 30 (1): 452.
18 Osawa S, Shimada Y, Sekine S, et al. MicroRNA profiling of gastric cancer patients from formalin-fixed paraffin-embedded samples[J]. Oncol Lett, 2011, 2 (4): 613-619.
19 Liu J, Wang X, Yang X, et al. miRNA423-5p regulates cell proliferation and invasion by targeting trefoil factor 1 in gastric cancer cells[J]. Cancer Lett, 2014, 347 (1): 98-104.
20 He CZ, Zhang KH, Li Q, et al. Combined use of AFP, CEA, CA125 and CA19-9 improves the sensitivity for the diagnosis of gastric cancer[J]. BMC Gastroenterol, 2013, 13: 87.
21 Chen XZ, Zhang WK, Yang K, et al. Correlation between serum CA724 and gastric cancer: multiple analyses based on Chinese population[J]. Mol Biol Rep, 2012, 39 (9): 9031-9039.
22 Li C, Li JF, Cai Q, et al. MiRNA-199a-3p: A potential circulating diagnostic biomarker for early gastric cancer[J]. J Surg Oncol, 2013, 108 (2): 89-92.
23 Li BS, Zhao YL, Guo G, et al. Plasma microRNAs, miR-223, miR-21 and miR-218, as novel potential biomarkers for gastric cancer detection[J]. PLoS One, 2012, 7 (7): e41629.
24 Chong PK, Lee H, Zhou J, et al. ITIH3 is a potential biomarker for early detection of gastric cancer[J]. J Proteome Res, 2010, 9 (7): 3671-3679.
25 Tsujiura M, Ichikawa D, Komatsu S, et al. Circulating microRNAs in plasma of patients with gastric cancers[J]. Br J Cancer, 2010, 102 (7): 1174-1179.
26 Song MY, Pan KF, Su HJ, et al. Identification of serum microRNAs as novel non-invasive biomarkers for early detection of gastric cancer[J]. PLoS One, 2012, 7 (3): e33608.

