食管神经内分泌癌:临床病例回顾性分析
袁柏思 金鑫鑫 刘 炯 路又可 杨妙芳 王少东 季洪赞 汪芳裕
南京军区南京总医院消化内科(210002)
原发性食管神经内分泌癌(neuroendocrine carcinoma, NEC)是一种罕见、高恶性程度的食管肿瘤,约占食管恶性肿瘤的0.05%~7.6%,最近WHO消化系统肿瘤分类将其分为小细胞、大细胞和混合性腺NEC三类[1]。食管NEC临床表现无特异性,对标准治疗方式亦尚未形成共识。本研究通过回顾性分析26例病理确诊食管NEC患者的临床资料,以期为该病的诊断和治疗提供参考。
对象与方法
一、研究对象
收集南京军区南京总医院2001年1月~2012年12月住院治疗食管NEC患者的病史资料,汇总分析各病例的临床、内镜、影像学、病理学表现以及治疗和随访情况。
二、诊断和分类标准
根据2010年第4版WHO消化系统肿瘤分类中的神经内分泌肿瘤命名和分类[1],对入组病例进行回顾性病理诊断,将肿瘤分为小细胞、大细胞和混合性NEC(见表1)。根据第7版UICC/AJCC食管癌TNM分期确定肿瘤病理分期。
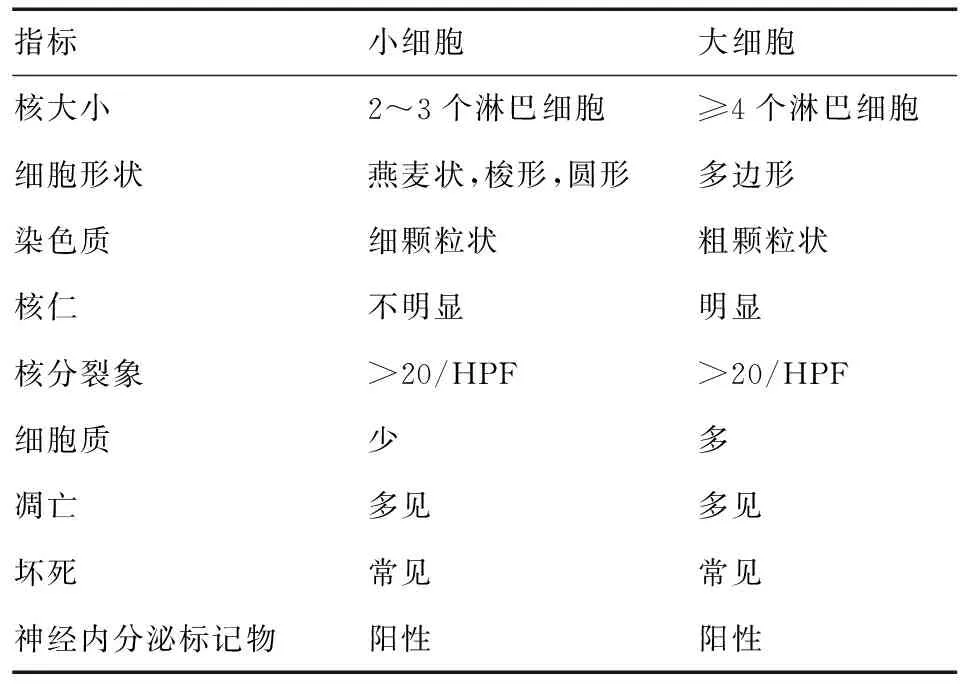
表1 食管NEC病理分类鉴别标准[2-3]
结 果
一、一般情况
共26例食管NEC患者纳入分析,其中男21例,女5例,男女比例为4.2∶1;发病年龄46~75岁,平均(60.1±8.8)岁。患者发病年龄段分布和个人史见表2。
二、临床表现
本组食管NEC患者的首发症状为胸骨后疼痛、进食梗阻感、吞咽困难、上腹痛等,以进食梗阻感/吞咽困难最为多见(见表2)。
三、内镜和影像学表现
本组食管NEC内镜下形态各异,包括溃疡型、隆起型、蕈伞型和息肉样(见图1、表2)。
食管NEC的胸部CT表现为食管壁环形或不规则增厚,或形成腔内肿块;食管周围脂肪层模糊、消失;周围器官受累和(或)淋巴结转移;增强扫描可见肿块轻度强化,可合并低密度坏死灶(见图2)。

表2 26例食管NEC患者临床特征分析
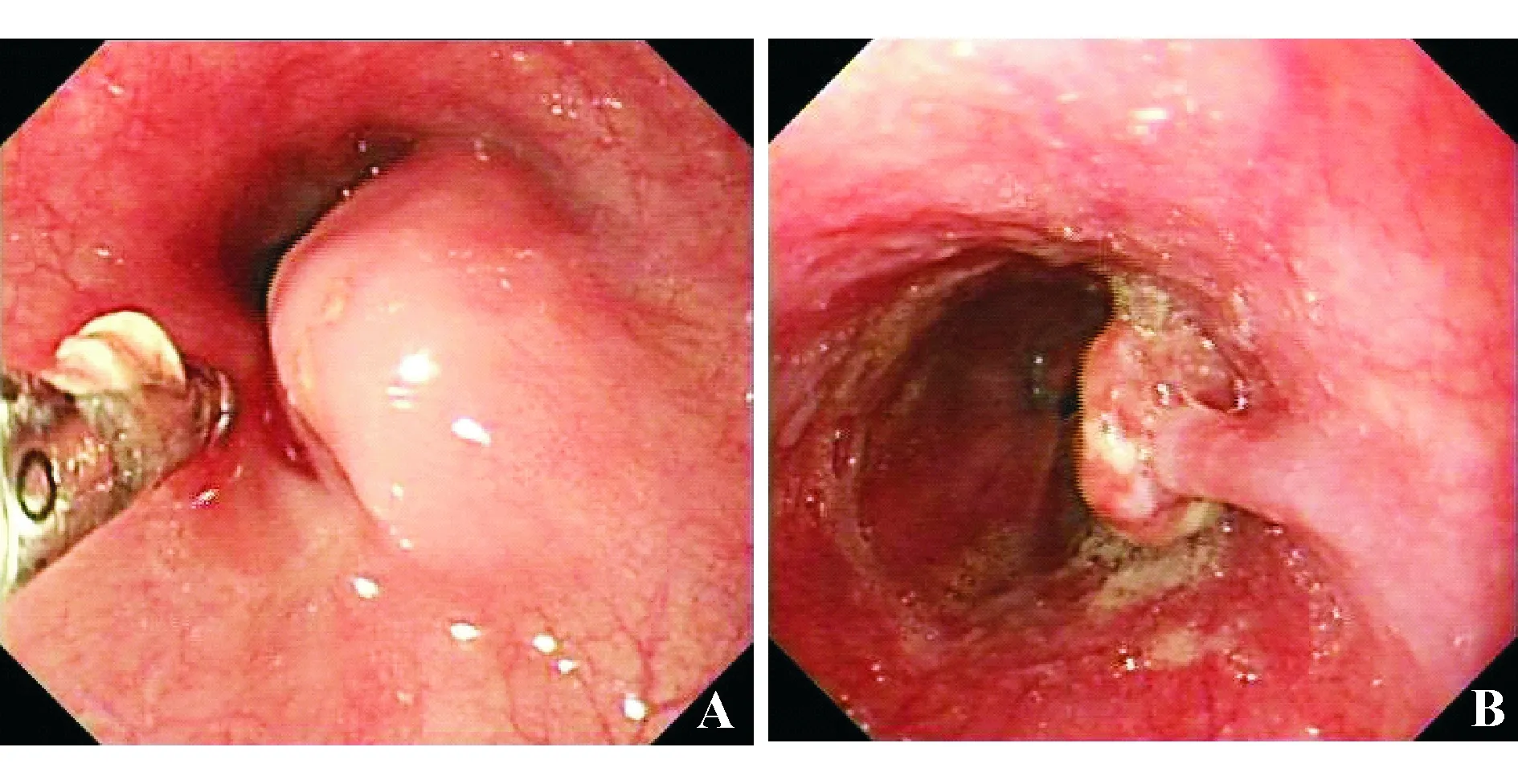
A:距门齿25~27 cm食管中段黏膜下隆起型病变,大小约3 cm×2 cm,病理诊断:小细胞NEC;B:距门齿36 cm食管下段长蒂息肉样病变,大小约1 cm×1.5 cm,病理诊断:小细胞NEC
不同类型的食管NEC食管钡餐检查表现各异,可表现为病变区食管黏膜皱襞增粗、紊乱、中断和扭曲;小凹陷或隆起性病变,管壁僵硬,扩张伸展受限;可有不同程度的梗阻,钡剂通过缓慢,近端不同程度扩张;可形成溃疡,呈地图状;可表现为纵形腔外龛影,周边可见环堤,病变与正常管壁分界清晰(见图3)。
四、病理学表现
本组食管NEC肿瘤中心部位以食管中段居多(见表2),病理类型包括小细胞NEC(69.2%)、大细胞NEC(3.8%)和合并鳞癌的混合性NEC(26.9%)(见图4、表3)。所有病例均结合免疫组化标记明确诊断, 常用免疫组化标记物突触素(Syn)、嗜铬粒蛋白A(CgA)、广谱细胞角蛋白(CKpan)、神经元特异性烯醇酶(NSE)、甲状腺转录因子-1(TTF-1)、p63、CD99、p53阳性率见表2。
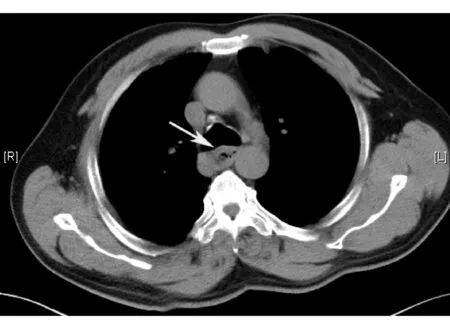
图2 1例食管NEC CT检查示食管中段管壁明显增厚,管腔狭窄,食管与周围结构分界不清(箭头所示为食管NEC)
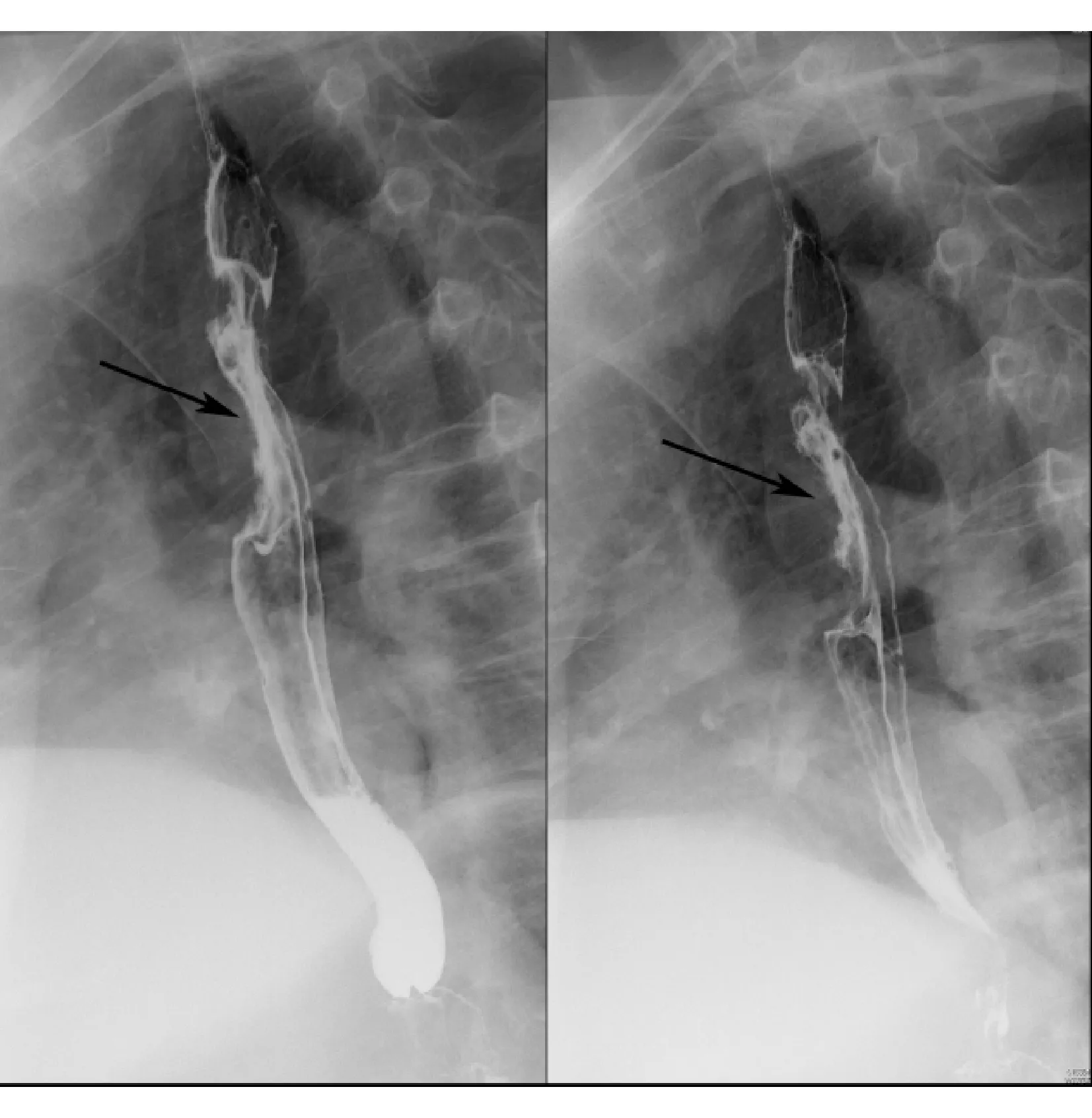
图3 1例食管NEC 钡餐检查示食管中段充盈缺损(箭头所示),管腔不规则狭窄,管壁僵硬,黏膜纠集破坏,与正常管壁分界清晰
本组食管NEC的TNM分期情况见表2,9例(34.6%)患者发生淋巴结转移,11例(42.3%)发生远处转移,其中5例转移至肝脏,其他远处转移部位包括骨和肺各2例,纵隔和心包各1例。

表3 26例食管NEC病理分类(n)
五、治疗和随访
本组食管NEC患者中23例(88.5%)行根治性手术,手术相关并发症包括肺部感染(2例)和乳糜性胸腔积液(1例),经治疗后均好转,无手术相关死亡病例。9例(34.6%)患者行全身性静脉化疗,化疗方案包括依托泊苷联合顺铂、紫杉醇联合顺铂、长春瑞滨联合顺铂等;3例对肝脏转移灶行经动脉化疗栓塞术(TACE);3例行肿瘤局部放疗。自确诊后开始随访,随访期间(1个月~7年)6例患者术后肿瘤复发、转移,其中5例死亡。
讨 论
自1952年英国病理学家Mckeown[4]首次报道2例食管小细胞癌以来,国内外报道食管NEC的文献逐渐增多,但因发病率较低,临床上对该病的认识及其治疗均存在一定局限性。近12年间于南京军区南京总医院住院治疗的食管恶性肿瘤患者共7711例,食管NEC仅占0.34%(26例), 证实该病相对罕见。本组食管NEC患者男性明显多于女性,男女比例为4.2∶1,可能与男性吸烟更为常见有关(食管NEC患者常有严重吸烟史[1]),患者发病年龄较大,均为45岁以上的中老年,平均发病年龄(60.1±8.8) 岁,与相关文献报道一致[2-3,5]。本组患者的首发症状如胸骨后疼痛、进食梗阻感、吞咽困难、上腹痛等与胃食管反流病、食管癌等的表现无明显差异,因而较易被误诊,因此对出现上述症状的患者需考虑该病的可能,应行胃镜和活检病理检查以明确诊断。

A:癌细胞呈巢状分布,纤维间质少,肿瘤细胞小,核深染,呈圆形、卵圆形或短梭形,核分裂象易见,胞质极少,细胞边界不清(HE染色,×200);B:免疫组化Syn染色阳性(×200);C:免疫组化CgA染色阳性(×200)
食管NEC的胸部CT和食管钡餐检查表现与其他食管恶性肿瘤无明显差异,多为溃疡性或隆起性病变等非特异性影像学表现,但这两项检查为非侵入性,较易为患者所接受,常可发现肿瘤并明确定位,对该病的诊断有一定价值。
胃镜检查是确诊食管NEC的重要手段,内镜下可见肿瘤为溃疡型、蕈伞型新生物,亦有病变表现为黏膜下隆起型或带蒂息肉样,后两种表现在食管鳞癌和腺癌中较少见,因此食管NEC还需与食管平滑肌瘤、食管息肉等良性病变鉴别。本组食管NEC肿瘤中心部位均为食管中下段(中段73.1%,下段26.9%),与相关文献报道相符[2-3,5]。
病理联合免疫组化标记是确诊食管NEC的主要依据,神经内分泌标记物Syn、CgA为必须检测项目。本组患者Syn阳性率较高(80.0%),CgA阳性率较低(21.4%),而相关回顾性研究中Syn和CgA阳性率均较高[2-3]。多种免疫组化标记物联合检测对食管NEC的诊断有较大帮助,但对小细胞和大细胞NEC无鉴别价值[2]。
本组食管NEC的病理类型以小细胞NEC居多(69.2%),混合性均为合并鳞癌,而相关文献中混合性除合并鳞癌外尚包括合并腺癌,可能与研究人群不同有关[2-3]。有研究[3]显示混合性NEC的预后优于单纯NEC,但亦有研究[2]报道混合性NEC患者的存活期与单纯NEC无明显差异。本组食管NEC的TNM分期相对较晚,24例为Ⅱ~Ⅳ期,76.9%(20/26)的患者发生转移,主要为纵隔淋巴结和肝转移,与该病侵袭性相对较高有关。因此,纵隔和肝脏是食管NEC患者的重点随访部位。
食管NEC的治疗方式包括化疗、放疗、手术治疗等,外科手术是目前有可能治愈该病的主要方法。本组23例患者行根治性手术,手术相关并发症发生率为13.0%(3/23),经治疗后均好转,无手术相关死亡病例,术后生存期最长者已超过7年。Casas等[6]指出,单纯采用局部治疗的食管小细胞癌患者中位生存期仅为5个月,而局部治疗联合化疗者中位生存期为20个月。Ding等[7]对病变局限的食管小细胞癌患者的研究显示,局部治疗联合化疗与单纯局部治疗者的5年生存率分别为27.2%和0%,中位生存期分别为22和11个月,Cox回归显示化疗为正向独立预后因素(HR=2.92, 95% CI: 1.25~6.80)。Lu等[5]和Zhu等[8]的研究均提示,无论是病变局限还是广泛的食管小细胞癌,局部治疗联合全身性治疗的生存获益均优于局部治疗。
综上所述,食管NEC是一种低发病率、侵袭性生长的恶性肿瘤,易发生转移,预后较差,诊断主要依赖胃镜活检病理检查,需与胃食管反流病、食管良性肿瘤、食管癌等进行鉴别;早期发现、早期诊断以及局部治疗与全身性治疗相结合是延长患者生存期的重要手段。该病的最佳治疗策略尚需开展前瞻性多中心随机对照临床试验加以证实。
1 Bosman FT, Carneiro F, Hruban RH, et al eds. WHO classification of tumours of the digestive system[M]. 4th ed. Lyon: IARC Press, 2010.
2 Huang Q, Wu H, Nie L, et al. Primary high-grade neuroendocrine carcinoma of the esophagus: a clinicopathologic and immunohistochemical study of 42 resection cases[J]. Am J Surg Pathol, 2013, 37 (4): 467-483.
3 Maru DM, Khurana H, Rashid A, et al. Retrospective study of clinicopathologic features and prognosis of high-grade neuroendocrine carcinoma of the esophagus[J]. Am J Surg Pathol, 2008, 32 (9): 1404-1411.
4 Mckeown F. Oat-cell carcinoma of the oesophagus[J]. J Pathol Bacteriol, 1952, 64 (4): 889-891.
5 Lu XJ, Luo JD, Ling Y, et al. Management of small cell carcinoma of esophagus in China[J]. J Gastrointest Surg, 2013, 17 (7): 1181-1187.
6 Casas F, Ferrer F, Farrús B, et al. Primary small cell carcinoma of the esophagus: a review of the literature with emphasis on therapy and prognosis[J]. Cancer, 1997, 80 (8): 1366-1372.
7 Ding J, Ji J, Zhu W, et al. A retrospective study of different treatments of limited-stage small-cell esophageal carcinoma and associated prognostic factor analysis[J]. Dis Esophagus, 2013, 26 (7): 696-702.
8 Zhu Y, Qiu B, Liu H, et al. Primary small cell carcinoma of the esophagus: review of 64 cases from a single institution[J]. Dis Esophagus, 2014, 27 (2): 152-158.

