黄鳝α-淀粉酶全长cDNA的克隆与序列分析
孟冉 阮国良 杨代勤
(长江大学动物科学学院,湖北 荆州 434025)(长江大学动物科学学院,湖北荆州434025;淡水水产健康养殖湖北省协同创新中心,湖北武汉430070;湿地生态与农业利用教育部工程研究中心,湖北荆州434025)(长江大学动物科学学院,湖北 荆州 434025)
α-淀粉酶(α-1,4-葡萄糖-4-葡聚糖水解酶)属于α-淀粉酶家族,普遍存在于动植物以及微生物中,其主要功能是水解淀粉中的α-1,4-糖苷键[1]。哺乳动物主要有唾液淀粉酶[2]和胰淀粉酶[3,4]2种α-淀粉酶,而鱼类只有(肝)胰腺产生α-淀粉酶。鱼类α-淀粉酶是重要的碳水化合物水解酶之一,它能够水解食物中的淀粉,其分泌功能的强弱直接影响到鱼类对食物的消化能力。已有研究表明[5],鱼类α-淀粉酶的活性与鱼类食性、生长、分布、季节变化及其发育阶段等因素有关。
黄鳝(Monopterusalbus)是我国重要的名特水产养殖鱼类,属于合鳃目合鳃科黄鳝属,是杂食性鱼类。目前对黄鳝消化酶的研究主要集中在理化坏境和营养素对其活性影响方面[6-9],对于黄鳝α-淀粉酶基因序列还未见报道。因此,克隆黄鳝α-淀粉酶基因可以为鱼类消化酶基因表达调控奠定基础。
1 材料与方法
1.1 试验材料
试验所需的黄鳝来自长江大学黄鳝研究所,健康无伤病。RNA提取试剂盒、pMD18-T载体试剂盒、PCR试剂及普通琼脂糖凝胶DNA回收试剂盒均购自Takara公司。反转录试剂盒由Fermentas公司生产。SMARTTMRACE cDNA Amplification Kit为Clontech公司产品。质粒提取试剂盒购自Omega公司。大肠杆菌(Escherichiacoli)DH5α购自北京鼎国昌盛生物技术有限公司。引物由北京鼎国昌盛生物技术有限公司合成。其他试剂均为国产分析纯。
1.3 RNA提取和cDNA的合成
按照RNA提取试剂盒操作说明提取黄鳝肝脏组织RNA,用琼脂糖凝胶电泳检测RNA质量,然后参照Fermentas公司的ReverAidTMFirst Strand cDNA Synthesis Kit方法以及SMARTTMRACE cDNA Amplification Kit说明书合成cDNA和5’、3’RACE cDNA,反转录产物置于-20℃保存。
1.4 引物的设计与合成
根据斜带石斑鱼(Epinepheluscoioides)(ACJ26844.1)、人(Homosapiens)(AAA35525.1)、小鼠(Musmusculus)(CAA24098.1)的α-淀粉酶基因设计兼并引物扩增黄鳝α-淀粉酶基因中间片段,扩增全长引物根据黄鳝α-淀粉酶基因中间片段设计。引物设计采用Primer5.0,引物见表1。
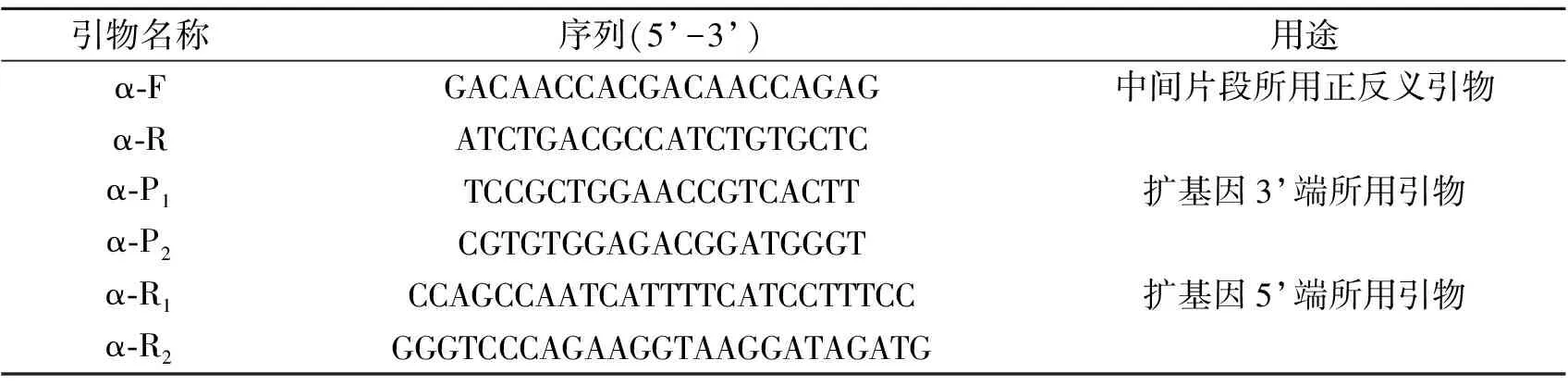
表1 黄鳝α-淀粉酶基因PCR引物
1.5 黄鳝α-淀粉酶基因的扩增
1.5.1 黄鳝α-淀粉酶中间片段的扩增
以黄鳝cDNA为模板,用α-F和α-R引物进行PCR扩增。PCR反应体系为:10×PCR Buffer(无Mg2+)2.5μl,25mmol/L Mgcl22μl,2.5mmol/L dNTPs 2μl,α-F(10μmol/L)1μl,α-R(10μmol/L)1μl,Taq酶0.5μl(1μl/U),模板cDNA 1μl,加ddH2O至25μl。反应条件:94℃预变性4min;94℃变性30s,52℃退火45s,72℃延伸1min,30个循环,然后72℃延伸10min。PCR产物经1%琼脂糖凝胶电泳检测纯化回收后连接到PMD18-T载体,连接产物转化至感受态细胞DH5α,用氨苄抗性筛选后送至武汉鼎国昌盛生物技术有限公司测序。
1.5.2 黄鳝α-淀粉酶基因5’、3’ cDNA扩增
分别以黄鳝3’RACE和5’RACE cDNA为模板,用3’特异性引物(α-P1,α-P2)和5’特异性引物(α-R1,α-R2)与SMARTTMRACE cDNA Amplification Kit试剂盒提供的通用引物(UPM)配对进行PCR扩增,PCR扩增按照SMARTTMRACE cDNA Amplification Kit试剂盒所推荐的反应体系和反应条件进行,然后对产物进行回收纯化、克隆与测序。
1.6 序列的生物信息学分析
运用ORF finder server(ORFs)(http://www.ncbi.nlm.nih.gov/gorf.html)寻找开放阅读框,利用在线软件ProtParam(http://www.expasy.ory)进行蛋白质分子量、等电点分析,用MEGA 4.1软件的邻接法(Neighbor-Joining,NJ)构建系统进化树,并用Bootstrap重复1000次计算各分支的置信值。氨基酸序列同源性分析使用DNAStar软件MegAlign功能进行。
2 结果与分析
2.1 黄鳝α-淀粉酶cDNA序列及推导氨基酸序列
黄鳝α-淀粉酶基因cDNA序列全长为1607bp,其中包括2bp的5’非编码区(UTR),54bp的3’非编码区(UTR),开放阅读框(ORF)长1551bp,编码516个氨基酸,含有20个氨基酸残基组成的信号肽(图1),推测其蛋白质分子量为58201.52,等电点约为7.23,分子式为C2588H3892N742O746S27,不稳定系数为30.57。
2.2 黄鳝α-淀粉酶蛋白序列比对及同源性分析
对黄鳝及斜带石斑鱼(Epinepheluscoioides)、胭脂鱼(Myxocyprinusasiaticus)、大西洋鲑(Salmosalar)、日本鳗鲡(Anguillajaponica)、斑马鱼(Daniorerio)、草鱼(Ctenopharyngodonidella)、人(Homosapiens)、小鼠(Musmusculus)的α-淀粉酶氨基酸序列进行多重比对,其相似性分别为84.2%、78.7%、77.8%、77.1%、77.1%、74.2%、69.9%、69.5%。比对结果显示黄鳝α-淀粉酶包含与哺乳动物α-淀粉酶二级结构相似的8个α螺旋和7个β折叠,没有第7个β折叠。在哺乳动物中保守的10个形成二硫键的的半胱氨酸(Cys)在黄鳝中同样保守[10](图2)。

注:起始密码子由方框圈示,终止密码子以*表示,灰色阴影显示加尾信号,预测的信号肽用下划线表示。图1 黄鳝α-淀粉酶基因cDNA序列和推导的氨基酸序列

2.3 黄鳝α-淀粉酶蛋白系统进化树的构建
利用NCBI上其他物种α-淀粉酶基因和黄鳝α-淀粉酶基因,采用MEGA4.1构建系统进化树,相关GenBank登录号分别为:斜带石斑鱼(Epinepheluscoioides)(ACJ26844.1)、人(Homosapiens)(AAA35525.1)、小鼠(Musmusculus)(CAA24098.1)、斑马鱼(Daniorerio)(NP_998176.2)、爪蟾(Xenopuslaevis)(AAH56841.1)、半滑舌鳎(Cynoglossussemilaevis)(AGT37610.1)、大西洋鲑(Salmosalar)(ABD13895.1)、尖吻鲈(Latescalcarifer)(AAL84163.1)、赤鲷(Pagruspagrus)(AAU93830.1)、泥塘幼鲻(Chelonlabrosus)(AIC81809.1)、草鱼(Ctenopharyngodonidella)(ACX35465.1)、重牙鲆(Diplodussargus)(ABX89620.1)、长鳍篮子鱼(Siganuscanaliculatus)(AHN13897.1)、猿鳚(Cebidichthysviolaceus)(ABK57091.1)、黑剑带鳚(Xiphisteratropurpureus)(ABJ97444.1)、日本鳗鲡(Anguillajaponica)(BAB85635.1)、胭脂鱼(Myxocyprinusasiaticus)(ABQ45553.1)、美洲黄盖鲽(Pseudopleuronectesamericanus)(AAF65827.1),结果如图3。分析显示鲤科鱼类草鱼和建鲤(Cyprinuscarpio‘jian’)聚为一支,两者与日本鳗鲡独聚为一支,最后又与黄鳝聚为一支。

注:黑体加粗字体显示为黄鳝。图3 α-淀粉酶cDNA编码的氨基酸序列构建的系统进化树
3 讨论
本研究克隆了黄鳝α-淀粉酶基因的cDNA全长。氨基酸相似性分析显示黄鳝α-淀粉酶基因与其他鱼类的α-淀粉酶基因相似性高于哺乳动物。进化树分析显示,鱼类α-淀粉酶基因聚为一支,哺乳类另聚一支。斑马鱼和胭脂鱼α-淀粉酶基因与一些海水鱼类α-淀粉酶基因构成一个分支,黄鳝和草鱼、建鲤、日本鳗鲡α-淀粉酶基因组成另一个小分支,而长鳍篮子鱼独成一支,这暗示鱼类α-淀粉酶基因在进化过程中存在一定的差异,鱼类α-淀粉酶基因可能存在不同的家族成员[11]。
哺乳动物胰淀粉酶有3个功能域:A、B、C[12],其中功能域A的(α/β)8桶装结构存在氯离子结合区域;功能域B存在钙离子结合部位,是维持α-淀粉酶结构稳定所必需的。有报道显示功能域A(α/β)8桶装结构是α-淀粉酶的催化功能域,其中β3、β4、β5和β7区域的一些氨基酸十分保守[13]。本研究结果显示黄鳝在β3、β4、β5区域的某些氨基酸十分保守,而β7区域却不保守,黄鳝β7保守性差异是否与其催化活性相关还有待于进一步研究。
[参考文献]
[1]Kuriki T,Imanaka T.The concept of the α-amylase family: structure similarity and common catalytic mechanism[J].J Biosci Bioengin,1999,87:557-565.
[2]Nishide T,Nakamura Y,Emi M,et al.Primary structure of human salivary α-amylase gene[J].Gene,1986,41:299-304.
[3]Yokouchi H,Horii A,Emi M,et al.Cloning and characterization of a third type of human α-amylase gene,AMY2B[J].Gene,1990,90: 281-286.
[4]Horii A,Emi M,Tomita N,et al.Primary structure of human pancreatic a-amylase gene: its comparison with human salivary α-amylase gene[J].Gene,1987,60: 57-64.
[5]陈春娜.鱼类淀粉酶的研究进展[J].中国饲料,2008,(5): 33-35.
[6]阮国良,刘家芳,杨代勤.间歇性禁食对黄鳝生长、消化酶活性及血液生化指标的影响[J].水产学报,2013,(7):1058-1065.
[7]陈芳,杨代勤,阮国良,等.温度对黄鳝消化酶活性的影响[J].湖北农业科学,2005,(5): 102-104.
[8]伍莉,蒋莉,陈鹏飞.温度对黄鳝肠道和肝胰脏主要消化酶活力的影响[J].四川畜牧兽医,2003,(10): 26-27.
[9]周晓林,伍莉,陈鹏飞.pH对黄鳝肠道和肝胰脏主要消化酶活力的影响[J].内陆水产,2002,(11): 37-48.
[10]Janacek S.Sequence similarities and evolutionary relationships of microbial,plant and animal α-amylases[J].Eur J Biochem,1994,224: 519-524.
[11]Krogdahl A,Hemre G-I,Mommsen T P.Carbohydrates in fish nutrition:digestion and absorption in postlarval stages[J].Aquaculture nutrition,2005,11:103-122.
[12]Rydberg E H,Sidhu G,Vo H C,et al.Cloning,mutagenesis,and structural analysis of human pancreatic alpha- amylase expressed inPichiapastoris[J].Protein science,1999,8: 635-643.
[13]Leemhuis H,Rozeboom H J,Dijkstra B W,et al.The fully conserved Asp residue in conserved sequence region I of the α-amylase family is crucial for the catalytic site architecture and activity[J].FEBS letters,2003,541:47-51.

