载三氧化二砷壳聚糖微球的制备、表征及释药性能
张亮 王靖 刘昌胜 黄晓春* 陈统一
(1.复旦大学附属中山医院骨科,*康复医学科,上海 200032;2.华东理工大学医用生物材料教育部工程研究中心,上海 200237)
三氧化二砷(arsenic trioxide,As2O3)的药用历史悠久,除作为早幼粒白血病的经典抗肿瘤药物外,它还可促进乳腺癌、前列腺癌、骨肉瘤和尤文肉瘤等多种实体肿瘤细胞的凋亡[1-2]。研究[3-4]表明1~2 μmol/L浓度的As2O3就能有效抑制骨肉瘤和尤文肉瘤细胞的增殖。
载As2O3磷酸钙骨水泥(calcium phosphate cement,CPC)在骨肿瘤手术中修复重建骨缺损的同时,可抑制局部肿瘤生长。但CPC直接载荷As2O3会延长骨水泥的固化时间并降低力学强度,其药物释放往往呈爆发性,难以缓慢持续地释药[5]。壳聚糖由甲壳素脱乙酰化形成,具有生物可降解性、生物相容性和分解产物无毒性等特点,因此优于工业生产的其他有机共聚物[6]。壳聚糖的三聚磷酸钠交联产物带正电荷,不易溶解、溶胀较小,性质较为稳定。以三聚磷酸钠为离子凝胶剂制备的壳聚糖微球的水溶性、载药性能及药物缓释效果均较好[7-8]。本研究将壳聚糖微球作为As2O3的载体,探讨载As2O3壳聚糖微球的制备工艺,并观察其表征和体外药物释放性能,为后期复合材料的研究奠定基础。
1 资料与方法
1.1 药品与试剂 壳聚糖(上海伟康有限公司),As2O3(北京双鹤药业),三聚磷酸钠、丙醇、磷酸氢二钠、磷酸二氢钠、硫脲、氢氧化钾和盐酸(上海凌峰化学试剂有限公司)。
1.2 仪器 S23-2恒温磁力搅拌器(上海司乐仪器有限公司),微胶囊成型装置(上海理工大学),透析袋15000(上海源聚生物科技有限公司),FD-3真空冷冻干燥机(北京博医康实验仪器有限公司),AFS-930双道原子荧光光度计(北京吉天仪器有限公司),AJ-5805注射泵(上海安吉电子设备有限公司),TE200-U倒置显微镜(日本尼康公司),Nicolet 5700傅立叶变换红外光谱(Fourier transform infrared,FT-IR)仪(美国Thermo公司),X-射线衍射仪(德国Bruker公司)。
1.3 载As2O3壳聚糖微球的制备 称取一定量的壳聚糖粉末至烧杯,加入离子水,边搅拌边加入冰醋酸;等溶液透明缓慢加入As2O3,过滤去除不溶物质后静止去泡,配制成2%壳聚糖溶液。用真空注射器吸取5 mL壳聚糖溶液加入到注射器,将注射器加载在微球成型装置上。注射泵以90 mm/h的注射速度加载,电压37~39 kV,将壳聚糖溶液滴加到50 mL三聚磷酸钠和丙酮的混合液中制成微球。微球迅速转移,并梯度淋洗至7 mL离心管冷冻过夜,冷冻干燥1 d。
1.4 载As2O3壳聚糖微球的包封率测定 微球成型操作前另取5 mL壳聚糖溶液,并于微球成型操作后收集含载药微球溶液的上清液,采用原子荧光法分别检测壳聚糖溶液和上清液中砷的含量。包封率=(壳聚糖溶液中总的砷含量-上清液中砷含量)/壳聚糖溶液中总的砷含量×100%。
1.5 载As2O3壳聚糖微球的表征观察 分别于光镜和电镜下观察载药微球的成球效果,并进行粒径分析、FT-IR分析和X-射线衍射分析。
1.6 药物体外释放 根据中国药典二部配制模拟体液,取30 mg含1% As2O3的壳聚糖微球置入50 mL模拟体液中,置入37 ℃恒温箱内。于0.5、1、1.5、2、4、8、12和24 h各取3 mL样本,采用原子荧光法检测砷的含量。每次取样后分别补充3 mL模拟体液。
2 结 果
2.1 包封率测定 载As2O3壳聚糖微球的包封率为(87.3±6.5)%。
2.2 成球效果 载As2O3壳聚糖微球在倒置显微镜和扫描电镜下成球效果较好,微球粒径较小,大小基本均一,分布较满意,冻干后微球表面稍有褶皱。见图1~2。
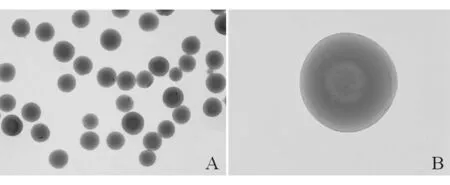
图1 倒置显微镜下载As2O3壳聚糖微球观察结果(A:×20;B:×100)

图2 扫描电镜下载As2O3壳聚糖微球的成球效果
2.3 粒径分析 载As2O3壳聚糖微球的粒径为10~500 μm,平均(239.5±11.2)μm。见图3。
2.4 FT-IR分析 载As2O3壳聚糖微球和壳聚糖的FT-IR有明显差异。与壳聚糖原料粉末的FT-IR比较,壳聚糖与三聚磷酸钠作用后,3447.7 cm-1羟基伸缩振动峰移到了3405.7 cm-1,1636.1 cm-1出现了尖峰,1596.5 cm-1的峰移到了1541.2 cm-1,1257 cm-1处羟基弯曲振动减小,说明与三聚磷酸钠交联后,壳聚糖微球的结构发生了变化,形成了较强的分子间和分子内氢键。见图4。

图3 载As2O3壳聚糖微球粒径分析
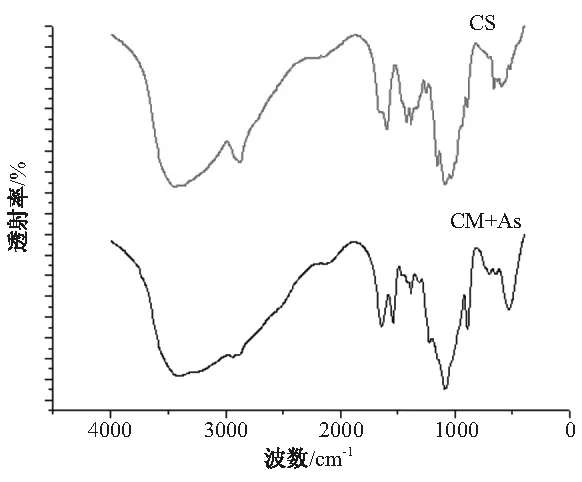
CS:壳聚糖,CM+As:载As2O3壳聚糖微球
2.5 X-射线衍射图谱分析 壳聚糖原料粉末的特征峰有2θ=10.1°和19.9°。在壳聚糖微球中未出现这种特征峰,取而代之的是微球结晶度明显降低所形成的馒头峰,表明三聚磷酸钠和壳聚糖之间发生了较强的相互作用。见图5。
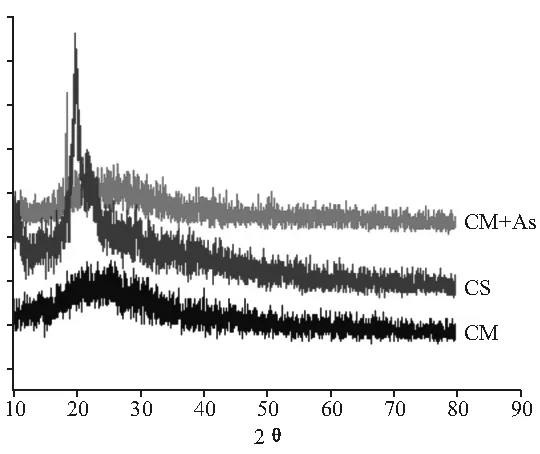
CM+As:载As2O3壳聚糖微球;CS:壳聚糖粉末;CM:空白壳聚糖微球
2.6 药物体外释放 载As2O3壳聚糖微球置入模拟体液中的4 h内,药物快速释放,之后药物释放量平缓上升。24 h内As2O3累积释放量为(30.8±0.5)%。同时,模拟体液中As2O3药物浓度维持在(2.3±0.1)~(4.7±0.1)μmmol/L。见图6。
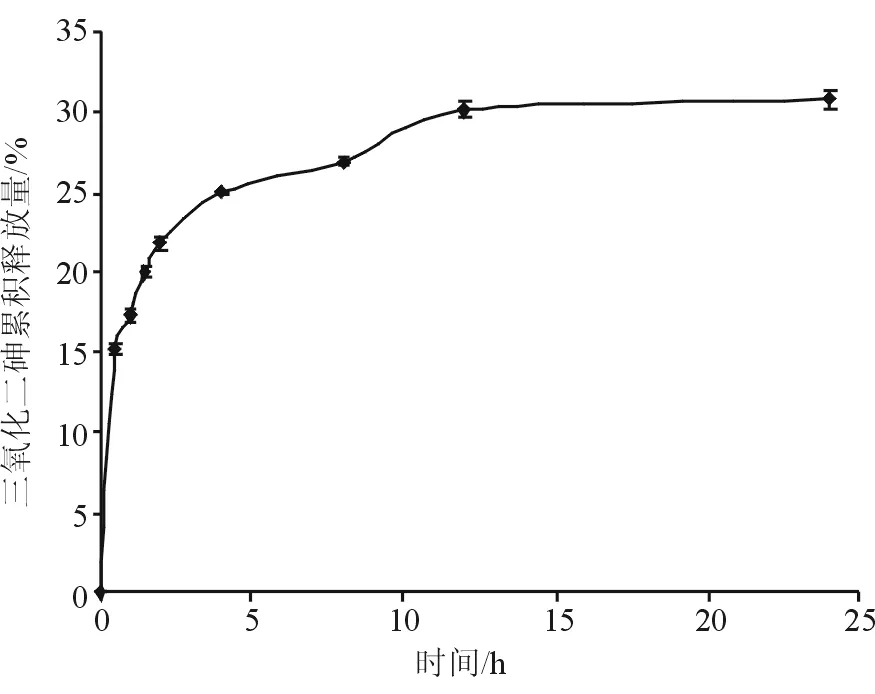
图6 载As2O3壳聚糖微球的药物释放曲线
3 讨 论
壳聚糖是一种天然聚阳离子碱性多糖,是甲壳素脱乙酰基衍生物,来源广泛,可从虾蟹壳中大量提取,且价格低廉。它具有多种生物活性,能与活体组织相容,不会引起过敏和排斥反应;其降解产物也能完全地被人体吸收,无不良反应,因此,壳聚糖适于作为缓控释药物的辅料[6]。壳聚糖包封药物后,可使药物释放减慢、疗效延长,不良反应减少。壳聚糖微球制备的方法有乳化分散法、油相干燥法、喷雾干燥法、交联聚合法和凝聚法等[6]。本研究采用静电液滴法制备壳聚糖微球,以含As2O3壳聚糖溶液为原料液,三聚磷酸钠和丙酮的混合液为凝胶浴,结果显示,该法制备的微球成球效果良好。研究[7]表明,高压静电发生技术制备载药壳聚糖微球具有工艺简便、制备条件温和、效率高、速率快、生物物质活性损失少等优点。
在高压静电场中,壳聚糖溶液克服黏滞力和表面张力,以液滴状落入凝胶浴,通过壳聚糖阳离子与三聚磷酸根阴离子之间的电荷作用,使壳聚糖微球从溶液中沉淀析出。冻干后的载药微球不粘连,再次分散性良好,这得益于其表面的正电荷;静电斥力的存在使得微球在较长时间内保持稳定,且壳聚糖微球与三聚磷酸钠交联后,形成了较强的分子间和分子内的氢键,也使得载药微球不易溶解,更加稳定[8-9]。
本研究中,FT-IR和X-射线衍射分析也表明,三聚磷酸钠和壳聚糖之间发生了较强的相互作用,壳聚糖结晶程度降低。微球成形速度较快时,壳聚糖分子链来不及进行充分的有序结晶排列;此外,交联后的壳聚糖结构较复杂,部分羟基参与反应,破坏了原来壳聚糖分子的规整性,使得交联后壳聚糖的晶相区减少。这些交联固化后的反应导致了壳聚糖结晶程度的降低,使壳聚糖接近于无定形,因而提高了壳聚糖分子链亲水性,使得载药壳聚糖微球的水溶性更强[10]。
壳聚糖内具有一定的活性基团,可以结合药物,使药物大量分布于交联结构内并缓慢释放。因此,包封在壳聚糖微球内的药物具有明显的缓释、控释或延时释药的特征[8,11]。Shavi等[12]在应用载阿那曲唑壳聚糖微球抗乳腺癌治疗的研究中发现,壳聚糖微球经三聚磷酸钠交联固化后,其药物释放在最初4 h内较为迅猛,之后则释放平缓,48 h内药物累积释放量为(73.04±1.6)%。本研究中,含1% As2O3的载药壳聚糖微球药物释放也于4 h内快速上升,随之缓慢增加;虽然24 h药物累积释放量仅为30%左右,但同时,模拟体液中As2O3的浓度维持于2~5 μmmol/L,已达到抑制骨肿瘤细胞增长所需药物浓度的要求[3-4]。
综上所述,采用静电液滴法制备载As2O3壳聚糖微球工艺简单可靠,所得载药微球水溶性较好,表征较为满意,包封率高,药物释放较为平缓,在载药微球复合型骨修复材料的研究及应用中具有潜在的优势。
[1]Kritharis A,Bradley TP,Budman DR.The evolving use of arsenic in pharmacotherapy of malignant disease[J].Ann Hematol,2013,92(6):719-730.
[2]Wang Y,Wei Y,Zhang H,et al.Arsenic trioxide induces apoptosis of p53 null osteosarcoma MG63 cells through the inhibition of catalase[J].Med Oncol,2012,29(2):1328-1334.
[3]Jung HS,Kim HS,Lee MJ,et al.Arsenic trioxide concentration determines the fate of Ewing's sarcoma family tumors and neuroblastoma cells in vitro[J].FEBS Lett,2006,580(20):4969-4975.
[4]黄晓春,李泽兵,陈增淦,等.活细胞实时成像技术研究抗坏血酸(AA)协同砷剂抗人骨肉瘤MG-63的体外疗效[J].复旦学报(医学版),2012,39(6):649-652.
[5]Bose S,Tarafder S.Calcium phosphate ceramic systems in growth factor and drug delivery for bone tissue engineering:a review[J].Acta Biomater,2012,8(4):1401-1421.
[6]Islam MA,Firdous J,Choi YJ,et al.Design and application of chitosan microspheres as oral and nasal vaccine carriers:an updated review[J].Int J Nanomedicine,2012,7: 6077-6093.
[7]Mi Y,Su R,Fan DD,et al.Preparation of N,O-carboxymethyl chitosan coated alginate microcapsules and their application to Bifidobacterium longum BIOMA 5920[J].Mater Sci Eng C Mater Biol Appl,2013,33(5):3047-3053.
[8]Martins AF,de Oliveira DM,Pereira AG,et al.Chitosan/TPP microparticles obtained by microemulsion method applied in controlled release of heparin[J].Int J Biol Macromol,2012,51(5):1127-1133.
[9]Zeng W,Huang J,Hu X,et al.Ionically cross-linked chitosan microspheres for controlled release of bioactive nerve growth factor[J].Int J Pharm,2011,421(2):283-290.
[10]Estevinho BM,Rocha FA,Santos LM,et al.Using water-soluble chitosan for flavour microencapsulation in food industry[J].J Microencapsul,2013,30(6):571-579.
[11]Park JM,Lee SY,Lee GH,et al.Design and characterisation of doxorubicin-releasing chitosan microspheres for anti-cancer chemoembolisation[J].J Microencapsul,2012,29(7):695-705.
[12]Shavi GV,Nayak UY,Reddy MS,et al.Sustained release optimized formulation of anastrozole-loaded chitosan microspheres:in vitro and in vivo evaluation[J].J Mater Sci Mater Med,2011,22(4):865-878.

