靶向CD151-整合素α6β1结合域的多克隆抗体的制备及初步应用
施国明 柯爱武 俞静娴 胡美玉 张鹏飞 蔡加彬 董兆如 张弛 邱双健 孙惠川 周俭 樊嘉
(复旦大学附属中山医院肝外科,上海 200032)
CD151基因定位于人类染色体11p15.5,其编码的蛋白质形成四次跨膜分子结构[1-8],广泛分布于人体各类细胞,参与细胞的多种重要生理功能[1, 7, 9]。CD151在肝细胞肝癌(肝癌)等多种恶性肿瘤中均过表达,其表达程度与患者的预后密切相关。CD151与整合素、生长因子结合或自身相互结合而形成的功能复合体,会影响肿瘤细胞迁移、病理血管形成和上皮间质样转化(epithelial-mesenchymal transition, EMT)等[1-7, 10-11]。我们的前期研究[10]发现,肝癌细胞中CD151表达水平的改变可显著影响肝癌细胞的侵袭和转移能力;CD151通过激活磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)/蛋白激酶B(Akt)/糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)/Snail信号通路而促进基质金属蛋白酶9(matrix metallopeptidase 9, MMP9)的分泌和表达,从而促进肝癌新生血管形成[11];CD151与整合素α6β1在肝癌细胞表面形成复合物,进而选择性扩大整合素α6β1-PI3K信号,导致核转录因子Snail的核聚集与激活,以此促进肝癌发生EMT[12];采用免疫共沉淀(co-immunoprecipitation, coIP)结合液相色谱串联质谱(liquid chromatography-mass spectrometry, LC-MS/MS)技术发现,人肝癌细胞株HCCLM3中CD151与整合素α6β1等分子结合,形成功能复合物[13]。因此,CD151与整合素α6β1等结合形成的功能复合物是抗肝癌复发/转移的潜在靶点[9]。本研究应用免疫工程技术制备靶向CD151-整合素α6β1结合域[14]的多克隆抗体并鉴定其免疫学特性。
1 资料与方法
1.1 多肽合成以及实验动物和细胞株 多肽复合物CGQRDHASNIYKVEG-KLH、CGQRDH ASNIYKVEG-BSA由上海强耀生物科技有限公司合成。6周龄的雄性BALB/c小鼠10只,购自上海斯莱克实验动物有限责任公司。肝癌细胞株HCCLM3系复旦大学肝癌研究所建株并保存。
1.2 主要试剂和材料 弗氏完全佐剂、弗氏不完全佐剂购自美国Sigma公司。细胞培养液DMEM高糖培养基、胎牛血清购自美国Gibco公司。小鼠抗人CD151单克隆抗体购自美国Serotec公司,辣根过氧化物酶(horse radish peroxidase, HRP)标记的羊抗鼠二抗、羊抗鼠异硫氰酸荧光素(fluorescein isothiocyanate, FITC)荧光二抗、4-甲基联苯胺(tetramethyl benzidine, TMB)购自上海碧云天生物技术有限公司。
1.3 靶向CD151-整合素α6β1结合域的多克隆抗体的制备 将100 μg小鼠多肽复合物CGQRDHASNIYKVEG-KLH与等量完全弗氏佐剂混合后腹腔注射BALB/c小鼠。于第3、5、7周将抗原与不完全弗氏佐剂混合并乳化后腹腔注射小鼠,抗原剂量同前。冲击免疫后3 d处死小鼠,处死前先从眼球取血。吸取血清,4℃离心10 min,将上层血清分装至玻璃瓶,-80℃保存。
1.4 抗体效价的检测 采用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测抗体的效价。取CD151-整合素α6β1-BSA(CGQRD HASNIYKVEG- BSA)连接的抗原5 μg/mL,以100 μL/孔包被96孔ELISA酶标板,4℃过夜。磷酸盐吐温缓冲液(PBST)洗涤3次,每次5 min;然后用5%脱脂奶粉封闭1 h,加入不同稀释度(1∶2000、1∶4000、1∶8000、1∶32000、1:64000、1∶128000)的免疫后血清,37℃孵育1 h。加入1∶5000 HRP标记的山羊抗鼠二抗,TMB显色,用酶联免疫检测仪测定OD值(450 nm)。实验设空白对照孔和阴性对照孔。将待测孔OD值≥对照孔OD值2倍者定为阳性,以阳性最高稀释倍数为最终效价。实验重复3次。
1.5 Western blotting、细胞免疫荧光染色、免疫组织化学染色
1.5.1 Western blotting 取对数生长期的HCCLM3细胞,裂解后提取蛋白质。Western blotting按常规进行,新合成多克隆抗体按1∶1000加入,HRP标记羊抗鼠二抗按1∶5000加入,以1∶200商业化的小鼠抗人CD151单克隆抗体作为阳性对照,实验重复3次。
1.5.2 细胞免疫荧光染色 以1×104/孔的密度将HCCLM3细胞接种于12孔培养板内预置的盖玻片上,常规培养后以4%多聚甲醛固定。按照常规方法进行细胞免疫荧光染色,加入1∶200新合成的多克隆抗体,4℃过夜;加入1∶200羊抗鼠FITC荧光二抗,DAB显色;荧光显微镜下观察、摄影。
1.5.3 免疫组织化学染色 在复旦大学肝癌研究所组织库随机抽取20例肝癌患者手术切除的肝癌组织,进行石蜡固定后切片、烤片、脱蜡和水化、抗原热修复、去内源性酶、封闭,加1∶100新合成的多克隆抗体,4℃过夜,加入1∶2000 HRP标记的羊抗鼠二抗,封片,显微镜下观察、摄影。CD151阳性染色的判断标准参照文献[10]。
2 结 果
2.1 多克隆抗体的效价测定 免疫后的小鼠血清与抗原多肽复合物CGQRDHASNIYKVEG-KLH呈强阳性反应;随着血清稀释倍数降低,相应的OD值随之降低;以免疫前血清为阴性对照,经计算多克隆抗体的效价为1∶64000。
2.2 Western blotting结果 用新合成的小鼠抗人多克隆抗体行Western blotting,检测HCCLM3中CD151蛋白表达,以商业化的小鼠抗人CD151单克隆抗体作为对照。结果显示, 用新合成的小鼠抗人多克隆抗体反应时,膜上28 kDa处有条带显示,与商业化小鼠抗人CD151单克隆抗体的条带一致,见图1。
2.3 细胞免疫荧光染色 采用细胞免疫荧光染色法,用新合成多克隆抗体检测肝癌细胞HCCLM3中CD151蛋白定位。结果显示,肝癌细胞HCCLM3中CD151定位于肝癌细胞膜和细胞浆,见图2。
2.4 免疫组织化学染色 用新合成多克隆抗体通过免疫组织化学染色法检测肝癌组织中CD151蛋白的定位、表达。结果显示,CD151阳性表达于肝癌细胞的细胞膜和胞浆,CD151在癌组织中的表达明显高于癌旁组织,见图3。
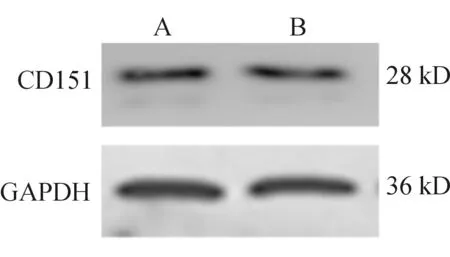
A:新合成多克隆抗体;B:商业化的小鼠抗人CD151单克隆抗体
图1用新合成多克隆抗体行Westernblotting,检测肝癌细胞HCCLM3中CD151蛋白表达

A 肝癌细胞膜和细胞浆呈CD151阳性表达;B 细胞核DAPI染色;C 图片A和B融合后

A 癌旁组织中CD151的表达(×400);B 癌与癌旁组织交界处CD151的表达(×100);C 癌组织中CD151的表达 (×400)
3 讨 论
目前已知,许多基因参与了肝癌的发生、发展,且一些基因在肝癌的侵袭和转移中起重要作用。CD151是四跨膜蛋白家族中最重要的成员之一,它在人体细胞中分布广泛,包括上皮细胞、内皮细胞和血小板等,参与细胞的多种重要生理功能,如信号转导、细胞黏附、细胞移动与形态改变等[1, 7, 9]。我们的前期研究发现,CD151可通过多种途径促进肝癌的侵袭和转移,包括(1)影响肝癌细胞的侵袭性[10];(2)通过激活PI3K/Akt/GSK-3β/Snail信号通路促进MMP9的分泌和表达,促进肝癌新生血管形成[11];(3)与整合素α6β1在肝癌细胞表面形成复合物,选择性扩大整合素α6β1/PI3K信号,促进肝癌发生EMT[12]等。因此,CD151是影响肝癌转移复发的关键蛋白,与整合素α6β1等结合所形成的功能复合体是抗肿瘤复发/转移的潜在靶点[9]。
已有抗人CD151抗体用于肿瘤治疗的实验研究报道[15]。但这些研究在制备抗体时未考虑到CD151在肿瘤侵袭中所发挥的作用需依赖四跨膜蛋白功能复合体(四跨膜蛋白网络),故这些研究制得的单克隆抗体在抑制肿瘤侵袭的同时也严重影响了CD151的其他重要功能。本研究合成的多克隆抗体与肝癌细胞和肝癌组织都能较好地结合,且仅针对CD151-整合素α6β1复合体的结合域,故不影响CD151对机体的其他功能。今后,有必要进一步评估本研究合成的多克隆抗体在肝癌侵袭和转移中的功能。
[1]Zijlstra A, Lewis J, Degryse B, et al. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151 [J]. Cancer Cell, 2008, 13(3): 221-234.
[2]Takeda Y, Kazarov AR, Butterfield CE, et al. Deletion of tetraspanin Cd151 results in decreased pathologic angiogenesis in vivo and in vitro [J]. Blood, 2007, 109(4):1524-1532.
[3]Yang XH, Richardson AL, Torres-Arzayus MI, et al. CD151 accelerates breast cancer by regulating alpha 6 integrin function, signaling, and molecular organization [J]. Cancer Res, 2008, 68(9):3204-3213.
[4]Lau LM, Wee JL, Wright MD, et al. The tetraspanin superfamily member CD151 regulates outside-in integrin alphaIIbbeta3 signaling and platelet function [J]. Blood, 2004, 104(8):2368-2375.
[5]Liu L, He B, Liu WM, et al. Tetraspanin CD151 promotes cell migration by regulating integrin trafficking [J]. J Biol Chem, 2007, 282(43):31631-31642.
[6]Nishiuchi R, Sanzen N, Nada S, et al. Potentiation of the ligand-binding activity of integrin alpha3beta1 via association with tetraspanin CD151 [J]. Proc Natl Acad Sci USA, 2005, 102(6):1939-1944.
[7]Hemler ME. Tetraspanin functions and associated microdomains [J]. Nat Rev Mol Cell Biol, 2005, 6(10):801-811.
[8]Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008 [J]. J Hepatol, 2008, 48 (Suppl 1):S20-37.
[9]Hemler ME. Targeting of tetraspanin proteins-potential benefits and strategies [J]. Nat Rev Drug Discov, 2008, 7(9):747-758.
[10]Ke AW, Shi GM, Zhou J, et al. Role of overexpression of CD151 and/or c-Met in predicting prognosis of hepatocellular carcinoma [J]. Hepatology, 2009, 49(2):491-503.
[11]Shi GM, Ke AW, Zhou J, et al. CD151 modulates expression of matrix metalloproteinase 9 and promotes neoangiogenesis and progression of hepatocellular carcinoma [J]. Hepatology, 2010, 52(1):183-196.
[12]Ke AW, Shi GM, Zhou J, et al. CD151 amplifies signaling by integrin alpha6beta1 to PI3K and induces the epithelial-mesenchymal transition in HCC cells [J]. Gastroenterology, 2011, 140(5):1629-1641 e1615.
[13]Devbhandari RP, Shi GM, Ke AW, et al. Profiling of the tetraspanin CD151 web and conspiracy of CD151/integrin β1 complex in the progression of hepatocellular carcinoma [J]. PLoS One, 2011,6:e24901.
[14]Kazarov AR, Yang X, Stipp CS, et al. An extracellular site on tetraspanin CD151 determines alpha 3 and alpha 6 integrin-dependent cellular morphology [J]. J Cell Biol, 2002,158(7):1299-1309.
[15]Haeuw JF, Goetsch L, Bailly C, et al. Tetraspanin CD151 as a target for antibody-based cancer immunotherapy [J]. Biochem Soc Trans, 2011, 39(2):553-558.

