基于普鲁士蓝/双胺氧化酶修饰的生物胺传感器
肖艳华,史 妮,汪俊丽,楚 汨,马 铭,谢青季,谭月明,苏孝礼
(湖南师范大学化学化工学院,化学生物学及中药分析教育部重点实验室,中国 长沙 410081)
基于普鲁士蓝/双胺氧化酶修饰的生物胺传感器
肖艳华,史 妮,汪俊丽,楚 汨,马 铭,谢青季,谭月明*,苏孝礼*
(湖南师范大学化学化工学院,化学生物学及中药分析教育部重点实验室,中国 长沙 410081)
通过壳聚糖及戊二醛将双胺氧化酶固定在普鲁士蓝修饰的玻碳电极表面,制备了生物胺传感器.考察了该传感器的电化学特性并优化了实验条件.结果表明,在优化条件下所制备的传感器的电流响应与组胺浓度在0.33μmol/L~3.3mmol/L(3.7×10-2~3.7×102mg/L)范围内相关;检测限(S/N=3)为0.05μmol/L(6μg/L).该传感器具有响应范围宽、灵敏度高、选择性强、简便快速的特点.
生物胺;双胺氧化酶;普鲁士蓝;安培型传感器
生物胺是一类具有生物活性的低分子量有机含氮化合物的总称,主要通过氨基酸的脱羧作用生成[1-2].根据结构可将其分为3类[3]:脂肪族(腐胺、尸胺、精胺、亚精胺等);芳香族(酪胺、苯乙胺等);杂环族(组胺、色胺等).适量的生物胺有助于人体的正常生理功能,过量则会引起不良的生理反应,如出现头痛、心悸、腹泻、休克等中毒症状[4].生物胺广泛存在于肉类、水产品、乳制品、酒类和饮料等食品中,在食品中的含量与食品的质量有一定的相关性[5-6].美国FDA规定水产品中组胺含量不超过50 mg/kg,酪胺不超过100 mg/kg,总胺不超过1 000 mg/kg;欧盟规定鲭科鱼类中组胺含量不超过100 mg/kg,总胺不超过300 mg/kg[7].
检测食品中的生物胺有助于监控食品的质量及安全性.现有的生物胺检测方法主要有高效液相色谱法、气相色谱法、薄层色谱法、毛细管电泳法等,这些方法存在费时、仪器昂贵、操作繁琐等缺点.本文工作旨在研究开发灵敏、简便、快速的电化学生物胺传感器检测方法.已有的这类传感器大多直接检测胺氧化酶与生物胺反应生成的H2O2的氧化电流[8],或利用固定化辣根过氧化物酶和游离的电子媒介物检测酶反应生成的H2O2[9-10].前者工作电位较高,干扰较多;后者构造相对复杂(涉及双酶体系)且操作不便(需在测试液中加入一定量的电子媒介物).
普鲁士蓝(Prussia blue,PB)是一种多核过渡金属氰化物,制备的PB修饰电极具有独特的电化学可逆性、高度的稳定性、易制备等特点,在电催化方面有很大的应用潜力.PB对过氧化氢的高灵敏催化作用在生物电化学领域的应用尤其备受关注,被称为“人工过氧化物酶”[11-12].壳聚糖是自然界中广泛存在的壳质经过脱乙酰作用得到的产物,具有丰富的氨基和羟基.它无味、无臭、无毒,且不易溶于水、成膜性好、粘附能力强、机械强度高、生物相容性好、对酶有较好的亲和力,并能有效地防止酶和电子媒介物的泄漏.因此在制备酶电极的过程中,壳聚糖是一种非常有用的固定材料[13-14].戊二醛含有丰富的醛基,可用于蛋白质固定,是传感器构建中常用的交联剂.
基于以上分析,本实验先在电极表面电沉积普鲁士蓝,然后利用壳聚糖和戊二醛将双胺氧化酶固定在电极表面,制备了一种安培型生物胺酶传感器.
1 实验部分
1.1 仪器与试剂
CHI660C电化学工作站(上海辰华仪器公司),玻碳电极作为工作电极(天津艾达恒晟科技发展有限公司),AgCl/Ag参比电极(上海雷磁仪器厂),213型铂为对电极(上海雷磁仪器厂).双胺氧化酶(Diamine oxidase, DAO, EC 1.4.3.6, ≥0.05 units/mg, Sigma-Aldrich),组胺(国药集团化学试剂有限公司),酪胺(上海晶纯试剂有限公司),腐胺(成都西亚试剂有限公司),精胺(Johnson Matthey Company),亚精胺(上海晶纯试剂有限公司),尸胺(上海梯希爱化成工业发展有限公司),胍丁胺(Tokyo Chemical Industry Company),二硫基乙胺(Adamas Reagent Company),壳聚糖(上海国药集团,脱乙酰度≥90.0%),30%过氧化氢(长沙市分路口塑料化工厂),50%戊二醛(天津市大茂化学试剂厂).所用试剂均为分析纯.除酪胺溶于无水乙醇外,其他试剂均由磷酸缓冲溶液(PBS, pH 7.0, 0.1 mol/L KH2PO4/Na2HPO4,含0.1 mol/L KCl)配制.
1%壳聚糖的制备:称取0.1 g 壳聚糖加入到10 mL 2% (V/V)的醋酸溶液中,室温下磁力搅拌3 h至完全溶解.然后用1.0 mol/L NaOH溶液调节溶液pH至4.6.
1.2 PB膜修饰电极的制备
玻碳电极(直径3 mm)依次用6#金相砂纸、0.3 μm、0.05 μm氧化铝抛光粉抛光打磨.然后在1.0 mol/L NaOH、无水乙醇及二次蒸馏水中分别超声洗涤5 min,在室温下晾干.将清洗干净的玻碳电极插入新配制的含2.5 mmol/L K3Fe(CN)6、2.5 mmol/L FeCl3、0.1 mol/L KCl和0.1 mol/L HCl的溶液中,在恒电位0.4 V工作电位下电沉积300 s,制得PB膜修饰电极.然后将制得的电极置于含0.1 mol/L KCl + 0.1 mol/L HCl的溶液中,以0.05 V/s扫速在-0.05~0.35 V间扫描20圈至稳定.电极在100 ℃下烘干1 h备用.
1.3 生物胺传感器的制备
首先取5 μL 120 mg/mL DAO滴于沉积有PB的玻碳电极表面.待晾干后,取5 μL 1% 壳聚糖溶液滴于电极表面晾干.最后滴加5 μL 0.25% 戊二醛滴于电极表面,晾干,制得生物胺传感器.将修饰好的传感器置于4 ℃冰箱中保存.使用时用PBS(pH 7.0)清洗电极,以除去未固定上的酶液.
1.4 生物胺传感器的测试
将制得的传感器置于含3 mL PBS的电解池中作为工作电极,以铂片为对电极,AgCl/Ag电极为参比电极,采用三电极体系,在室温、恒电位下,磁力搅拌.待背景电流稳定后注入一定体积的H2O2或生物胺样品溶液,记录传感器对H2O2或生物胺的响应电流.背景电流与响应电流的差值为加入样品的响应电流.
2 结果与讨论
2.1 传感器的电化学响应及响应机理
图1为生物胺传感器在有无H2O2存在时的循环伏安图.加入H2O2溶液后,氧化电流明显减小,还原电流明显增大,表明电沉积的PB能很好地电催化还原H2O2.当测定生物胺时,溶液中的生物胺向电极表面扩散,在DAO的催化下与O2反应发生产生相应醛类、NH3和H2O2[15],见图2及反应式(1)和(2).通过检测H2O2在电极表面的还原电流,即可测定生物胺.
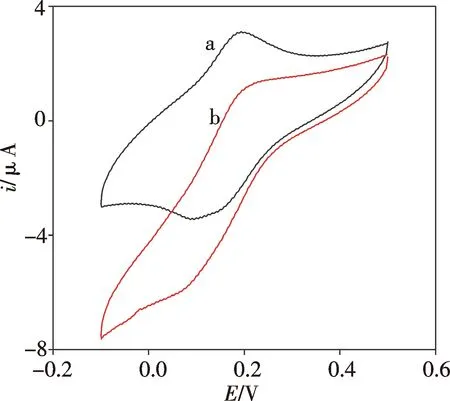
图1 生物胺传感器在未知(a)以及加入(b)H2O2时的循环伏安图,扫速:50 mV/sFig.1 Cyclic voltammograms of the biosensor in PBS containing 0 (a) or 3.3 mmol/L (b) H2O2, scan rate: 50 mV/s
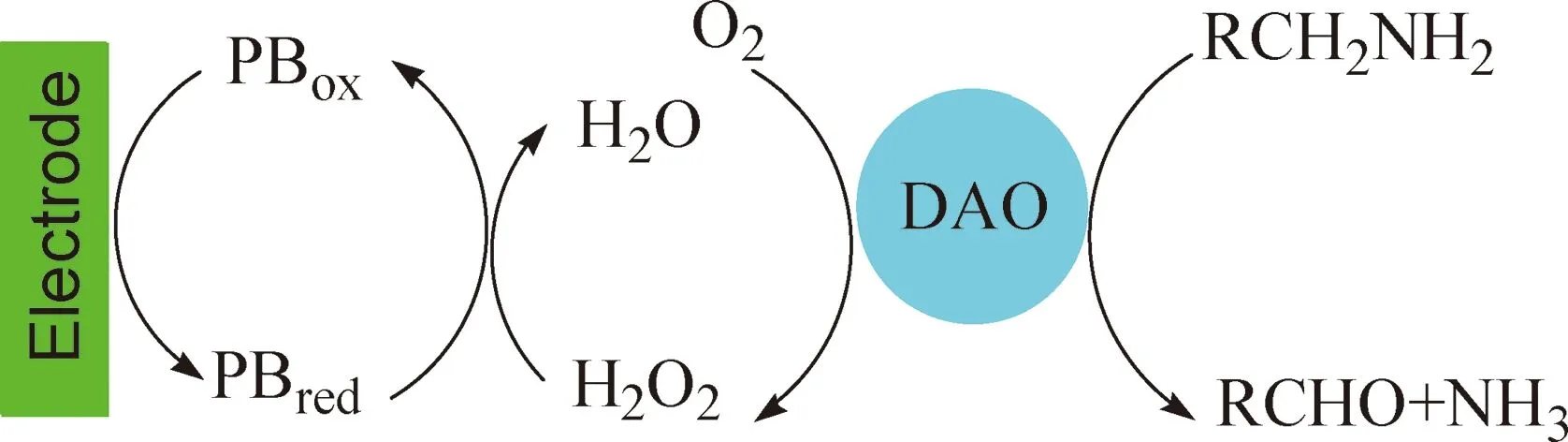
RCH2NH2+H2O+O2RCHO+H2O2+NH3 (1)K2Fe2+Fe2+(CN)6(PW)KFe3+Fe2+(CN)6(PB)+K+ (2)
2.2 传感器工作条件的优化
为提高传感器的选择性和灵敏度,对工作电位进行了优化.如图3所示,-0.15 V下的电流响应明显高于其他电位,因此,作者选择工作电位为-0.15 V.而-0.2 V时响应较-0.15 V时的低,是因为背景电流的影响所致.
考察了缓冲溶液的pH值对传感器响应电流的影响(见图4).在pH 6.0~7.0范围内,响应灵敏,但其响应值相差不大.虽然PB在酸性溶液中的响应较高一些,但为避免壳聚糖在酸性溶液中溶出而影响传感器的稳定性,作者选择pH 7.0的缓冲溶液为电解质.
工作电位:a.-0.05 V; b.-0.1 V; c.-0.15 V; d.-0.2 V

图4 pH值对传感器电流响应的影响(组胺浓度为3.3 mmol/L)Fig.4 Effect of pH on the amperometric response of the biosensor of the biosensor
PB膜的电沉积时间会影响传感器的性能.电沉积的时间过短,传感器的响应电流小,线性范围较窄.电沉积的时间过长,PB膜厚度过大,会阻碍电子的传递,也会影响传感器响应的各项性能.图5显示了不同沉积时间对传感器响应的影响.当沉积时间从100 s增加到400 s时,响应信号先增加后降低;当沉积时间为300 s时,响应达到最大.因此,作者选择沉积时间为300 s.
戊二醛作为交联剂,可以使壳聚糖分子之间相互交联形成网状结构,有利于将酶液固定在电极表面.当戊二醛浓度太低时,固定在电极表面的酶层在经过几次测试后逐渐流失;当戊二醛浓度太高时,会导致酶的活力降低.如图6所示,当使用的戊二醛的质量分数为0.25%时,传感器的的响应最大.因此,在后续的实验中选择戊二醛质量分数为0.25%.此外,实验发现,当不修饰戊二醛时,传感器虽有响应,但是随着测试的进行,修饰层有脱落现象,不利于构建稳定性好的传感器.
沉积时间:a.100 s; b.200 s; c. 300 s; d.400 s
戊二醛质量分数:a.0.25%;b.0.5%;c.1.0%
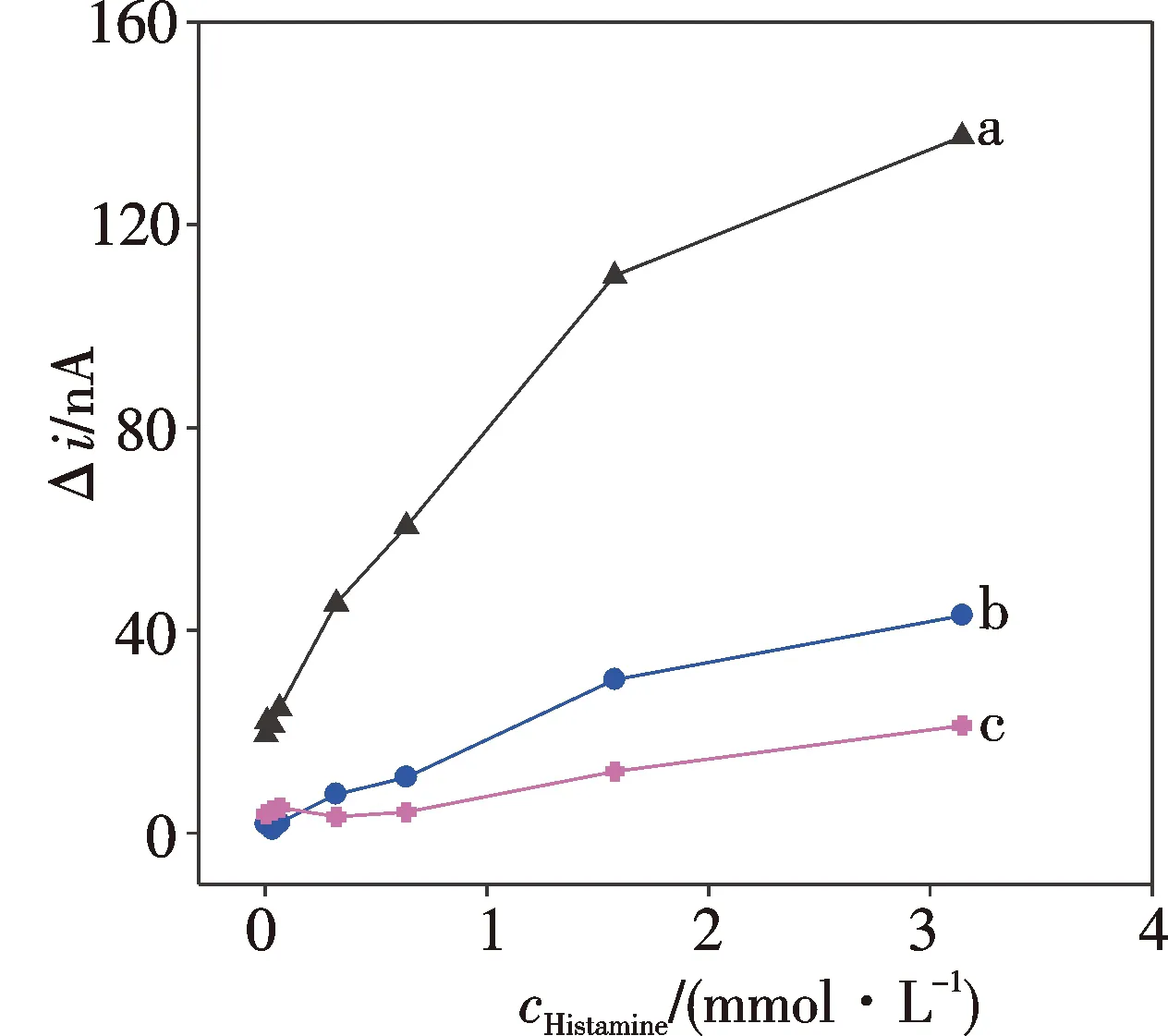
壳聚糖的浓度对传感器响应有一定的影响(见图7).当壳聚糖质量分数为1%时,酶液流失较少,传感器的响应最大;当壳聚糖质量分数较低时,固定的酶液相对较少,导致响应较低.因此选择采用质量分数为1%的壳聚糖固定酶.
2.3 传感器的响应性能
从图7中曲线a可以看出,在最优化条件下,传感器对0.33 μmol/L~3.3 mmol/L(3.7×10-2~3.7×102mg/L)浓度范围内的组胺具有较灵敏的响应;随着组胺浓度的不断增加,电流响应明显增大.其中传感器在0.33~1.3 μmol/L低浓度区间的电流-时间响应曲线和电流响应-浓度关系曲线见图8.结果显示在该区间,传感器的电流响应与组胺浓度呈良好的线性关系:Δi(nA)=17.2c(μmol/L)+0.80 (r=0.989 6).背景电流的噪声水平(N)为0.29 nA,0.33 μmol/L组胺浓度对应的信噪比(S/N)高达22,计算的最低检测限(S/N=3)为0.05 μmol/L(6 μg/L).该灵敏度优于已报道的其他电化学生物胺传感器(检测限一般在μmol/L级)[9-10].
该传感器在μmol/L级浓度区间每50 s可以完成对一个样品的测试(见图8),在高浓度区间的响应时间约为15 s.用同一支电极对3.3 mmol/L的组胺连续测试7次,响应电流的相对标准偏差为13%.在3.3 mmol/L组胺溶液中测试稳定性,结果表明经过15 d后传感器的灵敏度保持了90%.

壳聚糖质量分数:a.1.0%; b.0.5%; c.0.25%
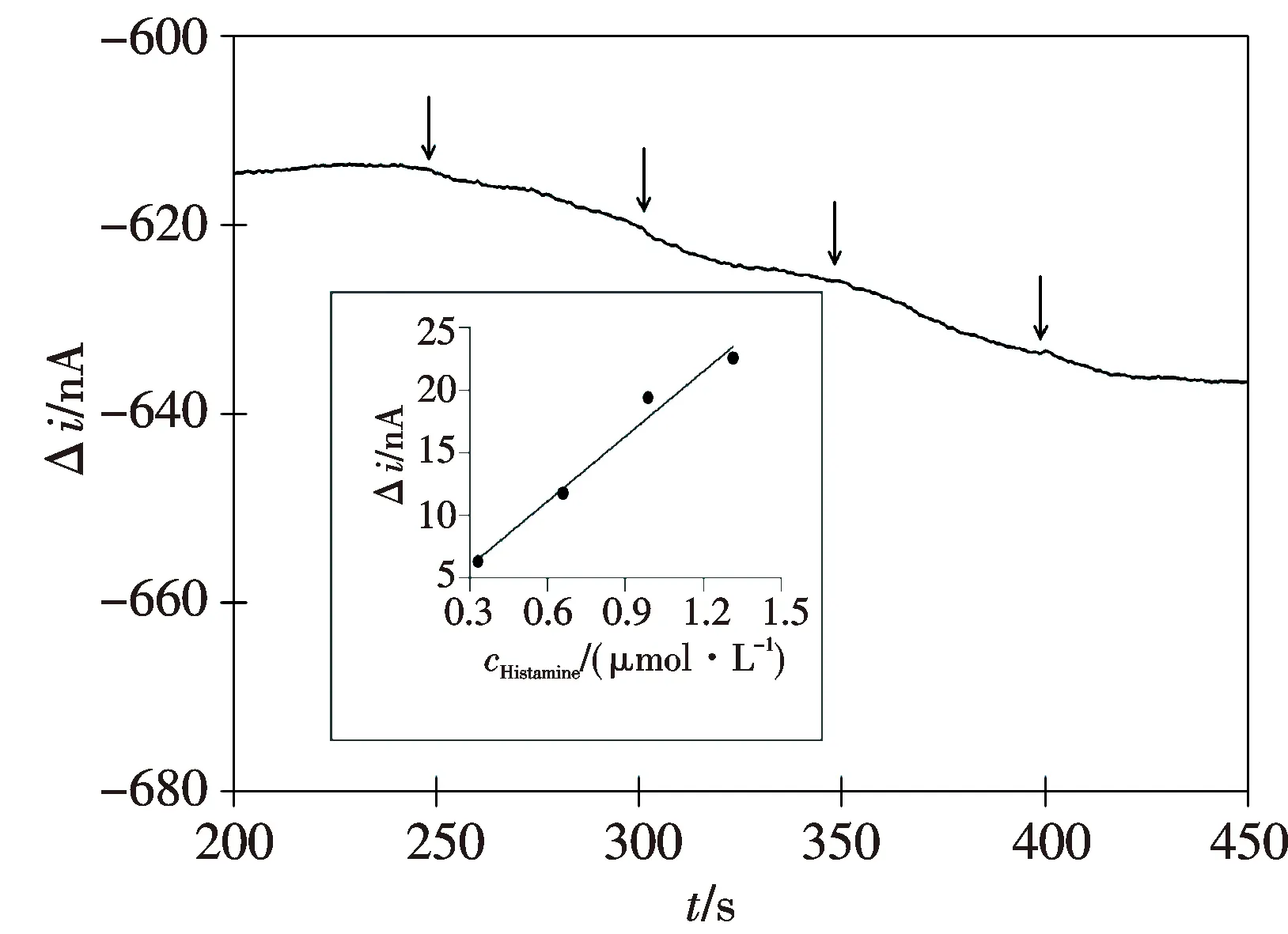
箭头代表在含3 mL PBS电解池中依次加入10 μL 0.1 mmol/L组胺溶液
2.4 传感器的选择性
在优化的实验条件下,考察传感器对8种不同生物胺的检测.当样品浓度均为3.3 mmol/L时,除对尸胺响应不明显外,传感器对其余7种生物胺均有明显的响应(见图9).以对组胺的响应值为参比,相对响应值按从大到小顺序排列分别为:二硫基乙胺(1.92)、精胺(1.84)、腐胺(1.28)、组胺(1)、亚精胺(0.68)、酪胺(0.39)、胍丁胺(0.18).1 mmol/L抗坏血酸和其他物质如葡萄糖、尿素、L-天冬氨酸、L-半胱氨酸等均无干扰.
3 结论
采用壳聚糖和戊二醛固定化双胺氧化酶,并利用普鲁士蓝对过氧化氢的高效电催化,制备了基于普鲁士蓝/双胺氧化酶修饰电极的生物胺传感器.该传感器具有检测范围宽、检测限低、选择性好等优点.有望为食品中生物胺的检测提供一种简便快速的方法.
[1] KIM B, BYUN B Y, MAH J H. Biogenic amine formation and bacterial contribution in Natto products [J]. Food Chem, 2012,135(3):2005-2011.
[2] DI FUSCO M, FEDERICO R, BOFFI A,etal. Characterization and application of a diamine oxidase from Lathyrus sativus as component of an electrochemical biosensor for the determination of biogenic amines in wine and beer [J]. Anal Bioanal Chem, 2011,401(2):707-716.
[3] PAPAVERGOU E J, SAVVAIDIS I N, AMBROSIADIS I A. Levels of biogenic amines in retail market fermented meat products [J]. Food Chem, 2012,135(4):2750-2755.
[4] KUNG H F, LEE Y C, HUANG Y R,etal. Biogenic amines content, histamine-forming bacteria, and adulteration of pork and poultry in tuna dumpling products [J]. Food Control, 2010,21(7):977-982.
[5] ZHONG J J, YE X Q, FANG Z X,etal. Determination of biogenic amines in semi-dry and semi-sweet Chinese rice wines from the Shaoxing region [J]. Food Control, 2012,28(1):151-156.
[7] HU Y, HUANG Z Y, LI J,etal. Concentrations of biogenic amines in fish, squid and octopus and their changes during storage [J]. Food Chem, 2012,135(4):2604-2611.
[8] CARELLI D, CENTONZE D, PALERMO C,etal. An interference free amperometric biosensor for the detection of biogenic amines in food products [J]. Biosens Bioelectron, 2007,23(5):640-647.
[9] NICULESCU M, NISTOR C, FRÉBORT I,etal. Redox hydrogel-based amperometric bienzyme electrodes for fish freshness monitoring [J]. Anal Chem, 2000,72(7):1591-1597.
[10] TELSNIG D, TERZIC A, KRENN T,etal. Development of a voltammetric amine oxidase-modified biosensor for the determination of biogenic amines in food [J]. Int J Electrochem Sci, 2012,7(8):6893-6903.
[11] PING J F, WU J, FAN K,etal. An amperometric sensor based on Prussian blue and poly (o-phenylenediamine) modified glassy carbon electrode for the determination of hydrogen peroxide in beverages [J]. Food Chem, 2011,126(4):2005-2009.
[12] CHEN X J, CHEN Z X, TIAN R,etal. Glucose biosensor based on three dimensional ordered macroporous self-doped polyaniline/Prussian blue bicomponent film [J]. Anal Chim Acta, 2012,723:94-100.
[13] SHAN C S, YANG H F, HAN D X,etal. Graphene/AuNPs/chitosan nanocomposites film for glucose biosensing [J]. Biosens Bioelectron, 2010,25(5):1070-1074.
[14] ZHANG M G, GORSKI W. Amperometric ethanol biosensors based on chitosan-NAD+-alcohol dehydrogenase films [J]. Electroanalysis, 2011,23(8):1856-1862.
[15] ALONSO-LOMILLO M A, DOM NGUEZ-RENEDO O, MATOS P,etal. Disposable biosensors for determination of biogenic amines [J]. Anal Chim Acta, 2010,665(1):26-31.
(编辑 杨春明)
An Amperometric Biosensor for Biogenic Amines Based on Prussian Blue/Diamine Oxidase Modified Glassy Carbon Electrode
XIAOYan-hua,SHINi,WANGJun-li,CHUMi,MAMing,XIEQing-ji,TANYue-ming*,SUXiao-li*
(Key Laboratory of Chemical Biology and Traditional Chinese Medicine Research (Ministry of Education), College of Chemistry and Chemical Engineering, Hunan Normal University, Changsha 410081, China)
An amperometric biosensor was fabricated by immobilizing diamino oxidase on the surface of Prussian blue-modified glassy carbon electrode with chitosan and glutaraldehyde. The electrochemical properties of the biosensor and experimental conditions were investigated. At optimized experimental conditions, the amperometric response of the biosensor was correlated to the histamine concentration in the range of 0.33 μmol/L to 3.3 mmol/L (3.7×10-2~3.7×102mg/L) with a detection limit (S/N=3) of 0.05 μmol/L (6 μg/L). The biosensor was characterized by its wide response range, high sensitivity, good selectivity, simplicity, and rapid speed.
biogenic amines; diamine oxidase; Prussian blue; amperometric biosensor
2013-06-06
国家自然科学基金资助项目(20975038;21275052)
*
,E-mailtanyueming0813@126.com;xsu@hunnu.edu.cn
O641.2
A
1000-2537(2014)01-0037-05

