DR5上调在5-烯丙基-7-二氟甲氧基白杨素增强TRAIL诱导人肺癌A549细胞凋亡中的作用
谢朝晖,全梅芳,曹建国,张坚松
(湖南师范大学医学院,中国 长沙 410013)
DR5上调在5-烯丙基-7-二氟甲氧基白杨素增强TRAIL诱导人肺癌A549细胞凋亡中的作用
谢朝晖,全梅芳,曹建国,张坚松*
(湖南师范大学医学院,中国 长沙 410013)
目的:观察5-烯丙基-7-二氟甲氧基白杨素(AFMC) )是否协同肿瘤坏死因子相关凋亡诱导配体(TRAIL)诱导人肺腺癌A549细胞凋亡.并探讨其机制是否涉及死亡受体5(DR5)的上调.方法体外培养人肺腺癌A549细胞和人胚肺WI-38细胞.碘化丙啶(PI)染色流式细胞术(FCM)定量分析细胞凋亡率;DNA琼脂糖凝胶电泳观察细胞DNA梯形条带;WesternBlotting检测DR5蛋白表达.结果单独用亚毒性浓度的AFMC(1.0μmol/L) 或TRAIL(30μg/L)处理A549细胞,细胞凋亡率不超过5%.AFMC(1.0μmol/L)联合TRAIL(30μg/L)的A549细胞凋亡率增高(37.80%,P<0.01);而WI-38细胞仅有极少量的细胞凋亡(P>0.05).DNA琼脂糖凝胶电泳显示:两者合用A549细胞呈现典型的DNA梯形条带图谱,而WI-38细胞未出现DNA梯形条带;WesternBlotting分析发现:AFMC呈浓度和时间依赖性上调A549细胞DR5的表达,DR5特异性抑制剂DR5/Fc嵌合蛋白能有效降低两者合用诱导的A549 细胞凋亡率(P<0.05).然而,AFMC对WI-38细胞DR5表达无明显影响.结论亚毒性浓度的AFMC选择性增强TRAIL诱导人肺癌A549细胞凋亡.其机制可能与其上调DR5表达有关.
肺癌;5-烯丙基-7-二氟甲氧基白杨素;肿瘤坏死因子相关凋亡诱导配体;死亡受体5;细胞凋亡
肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL) 及其受体(“死亡”受体:DR4和DR5)属于肿瘤坏死因子(TNF)超家族成员,它具有选择性诱导多种肿瘤细胞及转化细胞凋亡,而对正常细胞没有明显细胞毒性的生物学特点,成为了一种极具发展潜力和应用前景的肿瘤靶向治疗因子.但有研究证实,超过50%的肿瘤细胞对TRAIL不敏感[1].庆幸的是,越来越多的实验结果表明TRAIL 与化疗或放疗药物联合治疗能克服大多数肿瘤细胞对TRAIL 的耐受并获得协同杀伤效应[2].
白杨素(5,7-二羟基黄酮,ChR)是从多种植物、蜂胶和蜂蜜中提取的一种具有广泛生物活性的天然食源性黄酮.有研究报道指出:白杨素对非小细胞肺癌、恶性胶质瘤、子宫颈癌、白血病、食道鳞癌等多种肿瘤细胞具有良好的抗增殖活性和凋亡诱导作用,而对正常细胞未见明显毒性[3].但由于其肠道吸收甚少且5,7位羟基易被迅速糖基化代谢,导致该化合物的生物利用度降低,体内活性较低,因此,其应用受到限制[4].为此,作者以ChR为先导化合物,通过化学修饰得到ChR类似物5-烯丙基-7-二氟甲氧基白杨素(5-allyl-7-gen-difluoromethoxy chrysin,AFMC).在前期研究中,作者证明AFMC具有较ChR更强的诱导人肝癌HepG2细胞[5]、人卵巢癌CoC1细胞[6]、人肺癌A549细胞[7]凋亡作用.
Ding等[8]证实白杨素能通过下调c-FLIP,上调TRAIL-R2(DR5)增强TRAIL介导的白血病ATL、乳腺癌MDA-MB-231、结肠癌HT-29、肝细胞癌HepG2、黑色素瘤细胞SK-MEL-37、胰腺癌Capan-1等多种恶性肿瘤细胞凋亡.Jin等[9]报道白杨素类似物柚皮素通过上调DR5增强非小细胞肺癌A549细胞TRAIL耐药株对TRAIL的敏感性.本文研究亚细胞毒浓度的AFMC是否通过上调DR5表达,增强TRAIL诱导的A549细胞凋亡.
1 材料和方法
1.1 试剂
5-烯丙基-7-二氟甲氧基白杨素(AFMC)按照文献[10]方法合成,分子式:C19O4H14F2;相对分子质量:344,性状:淡黄色晶体;纯度:99.0%.白杨素(ChR)和碘化丙啶(PI)为Sigma公司产品;重组人可溶性肿瘤坏死因子相关凋亡诱导配体(TRAIL)由PeproTech公司生产;DNA Ladder检测试剂盒购于北京博大泰克公司;重组人DR5/Fc嵌合蛋白购自R&D Systems (Minneapolis,MN).
1.2 细胞培养
人肺癌A549细胞购自武汉大学中国典型培养物保藏中心(中国武汉);人胚肺WI-38细胞购自中国科学院细胞库(中国上海).在37 ℃、5% CO2(体积分数,下同)及饱合湿度条件下,用含10%小牛血清,1.667 mkat/L(即105U/L)青霉素及1.667 mkat/L链霉素的RPMI-1640完全培养基传代培养,选取对数生长期细胞用于各项实验.
1.3 流式细胞术分析
取对数生长期细胞用含10%小牛血清的培养基处理24 h进行细胞周期同步化后,分别加入含AFMC (1.0 μmol/L)、TRAIL(30 μg/L)以及两者合用的完全培养基孵育24 h;0.2% DMSO作为溶媒对照.收集细胞,加入PBS制备单细胞悬浮液, 再用冷却的PBS冲洗2次, 用70%酒精4 ℃ 固定24 h, PI染色后用流式细胞仪(American BD Company, FACS420)检测细胞凋亡.
1.4 DNA琼脂糖凝胶电泳
收集各组细胞,PBS洗涤2次,按照DNA Ladder Detection Kit说明书操作,提取细胞DNA, 1.5%琼脂糖凝胶电泳检测DNA片段.
1.5 Western Blotting分析
收集不同处理组细胞,PBS洗涤3次,用细胞裂解液(0.1 mol/L NaCl, 0.01 mol/L Tris-cl(pH 7.6), 0.001 mol/L EDTA(pH 8.0), 1 mg/L Aprotinin, 100 mg/L PMSF)裂解细胞后提取细胞总蛋白.每组取25 μg蛋白样品进行10% SDS-PAGE电泳(100 mA, 3 h),转移至PVDF膜上,用含5%脱脂牛奶的TBST室温下封闭2 h,然后分别加入1∶1 000稀释的DR5(p48)和β-actin一抗,37 ℃孵育2 h;TBST缓冲液洗膜10 min×3次,加入相应的二抗室温孵育1 h后,TBST洗膜3次,每次15 min.ECL化学发光,显影,定影.实验中以β-actin作为内参照蛋白.
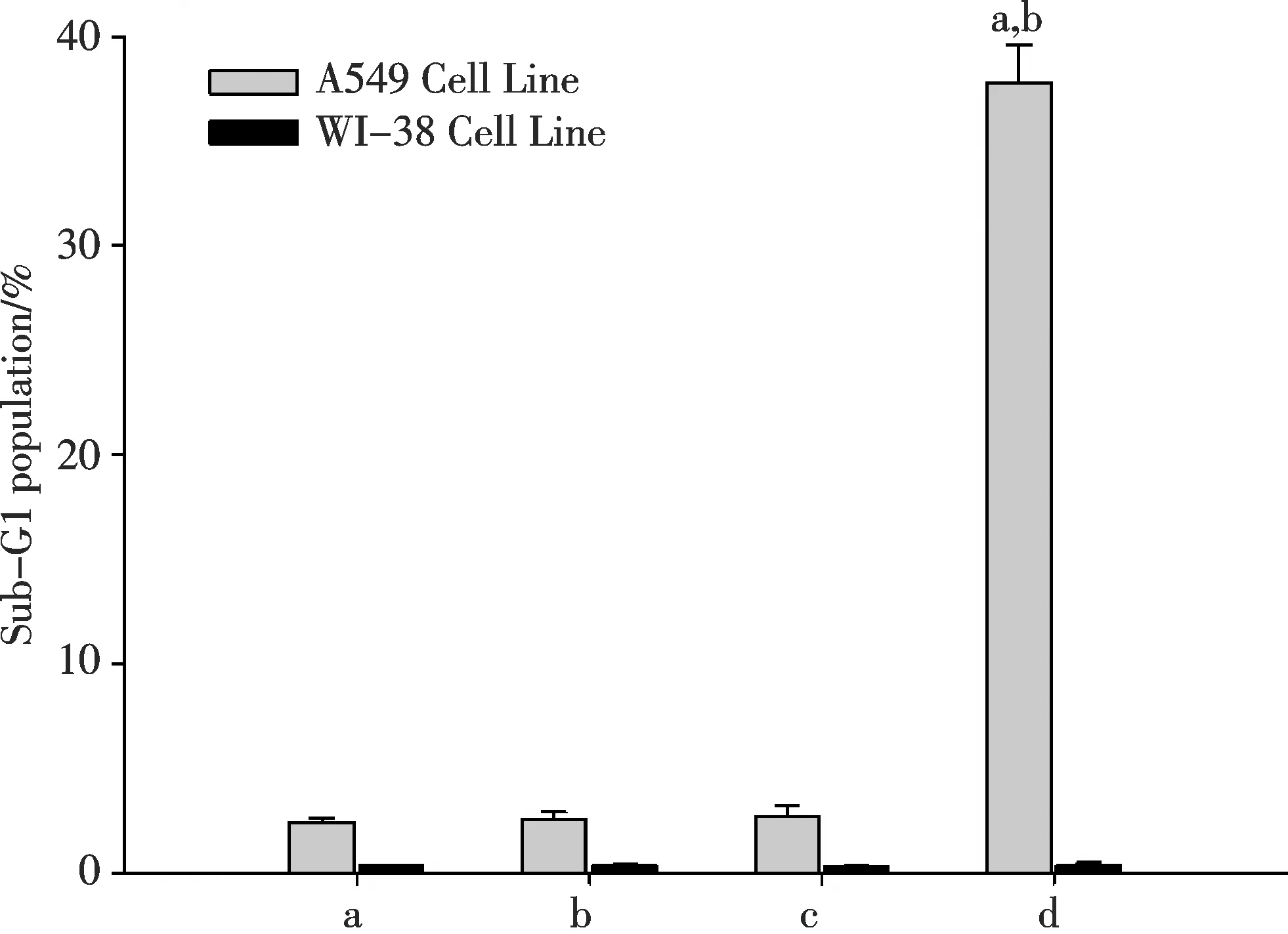
图1 AFMC与TRAIL及两者合用对A549细胞与WI-38细胞凋亡率的影响(a. 0.2%DMSO;b. 1.0 μmol/L AFMC;c. 30 μg/L TRAIL;d. AFMC+TRAIL) 与溶媒组比较,aP<0.01;与单用相同浓度的AFMC或TRAIL处理组比较, bP<0.01.Fig.1 Effects of AFMC and TRAIL or in combination on the apoptotic rate in A549 cells and WI-38 cells (a. 0.2%DMSO;b. 1.0 μmol/L AFMC;c. 30 μg/L TRAIL;d. AFMC+TRAIL)aP<0.05 vs vehicle group; bP<0.01 vs the group with AFMC or TRAIL
1.6 统计学分析
2 结果
2.1 亚毒性浓度的AFMC、TRAIL及两者合用对人肺癌A549细胞凋亡的影响
PI染色FCM分析显示:1.0 μmol/L AFMC、30 μg/L TRAIL单用以及两者合用的A549细胞凋亡率(Sub-G1细胞百分率)分别为2.53%±0.35%,2.69%±0.52%,37.80%±1.78%.两者合用的细胞凋亡率是各自单用时细胞凋亡率之和的7.2倍(P<0.05,图1).A549细胞凋亡率在两者合用12 h后开始增加,24 h达高峰(图2).提示亚毒性浓度的AFMC能增敏TRAIL诱导人肺癌A549细胞凋亡.

图2 AFMC和TRAIL合用不同时间对A549细胞凋亡率的影响(FCM分析)Fig.2 Effect of AFMC in combination with TRAIL on the apoptotic rate in A549 cells at different time points (FCM results)
2.2 亚毒性浓度的AFMC、TRAIL及两者合用对人肺癌A549细胞DNA断裂的影响
DNA琼脂糖凝胶电泳显示: 1.0 μmol/L AFMC或30 μg/L TRAIL分别作用于人肺癌A549细胞24 h,未见凋亡特异性的DNA梯形条带,而1.0 μmol/L AFMC预孵育30 min后,再加入30 μg/L TRAIL处理24 h,展现典型DNA梯形条带图谱(图3A).进一步证实:亚毒性浓度的AFMC具有增强TRAIL诱导人肺癌A549细胞凋亡作用.
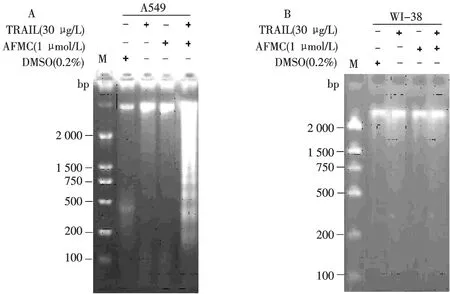
图3 AFMC与TRAIL及两者合用对人肺癌A549细胞和人胚肺WI-38细胞DNA断裂的影响Fig.3 Effects of AFMC and TRAIL or in combination on DNA fragmentation in A549 cells and WI-38 cells
2.3 AFMC对人肺癌A549细胞DR5蛋白表达的影响
Western Blotting分析表明:AFMC以浓度和时间依赖方式上调A549细胞DR5蛋白表达,DR5表达在AFMC作用6 h后开始增加,先于AFMC和TRAIL两者合用12 h后引起的细胞凋亡率增加(图4A,图5).
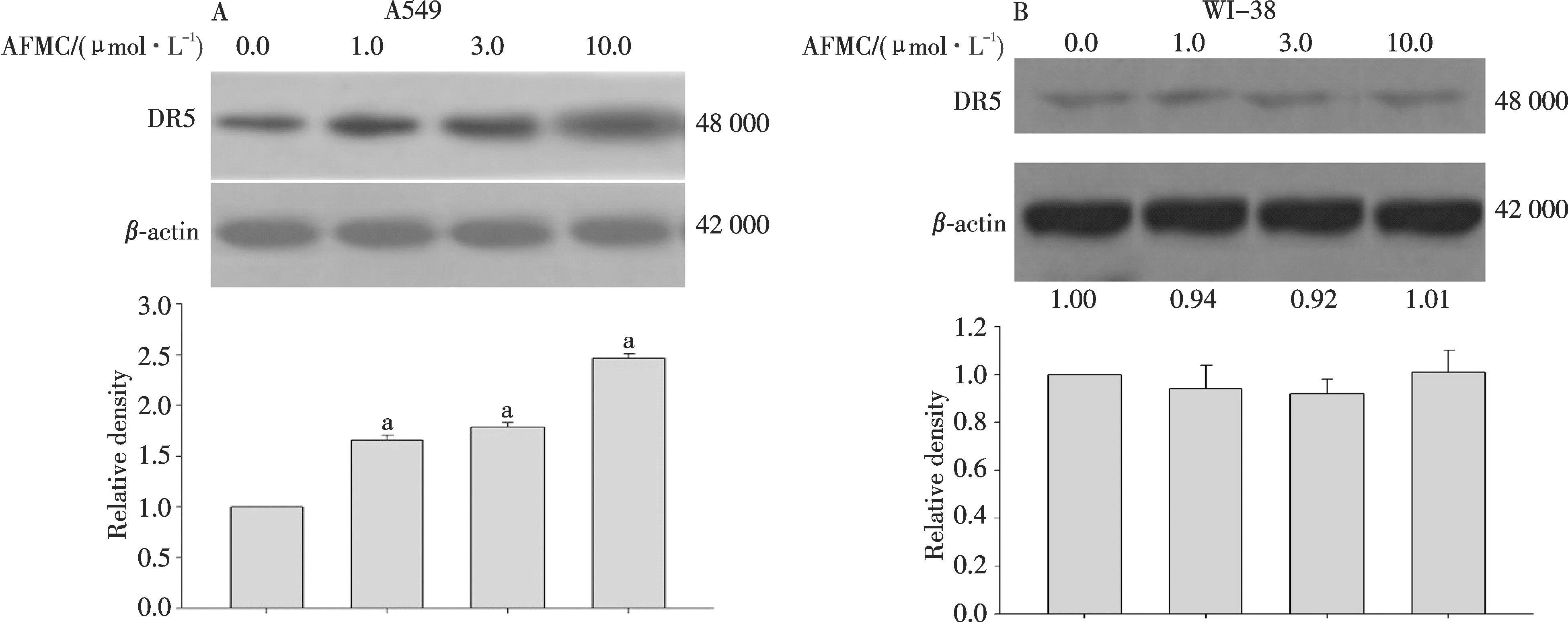
图4 不同浓度AFMC对A549细胞和WI-38细胞DR5蛋白表达的影响(n=3)与溶媒组比较, aP<0.05.Fig.4 Effects of AFMC of different concentrations on the DR5 expression in A549 cells and WI-38 cells(n=3)aP<0.05 vs vehicle group.
2.4 DR5拮抗性抗体对AFMC增强TRAIL诱导人肺癌A549细胞凋亡作用影响
DR5拮抗性抗体DR5/Fc嵌合蛋白能使亚毒性浓度AFMC和TRAIL合用的A549细胞凋亡率从37.80%±1.78%下降至7.61%± 0.32%(P<0.05,图6),表明AFMC上调DR5表达是其增敏作用的机制之一.
2.5 AFMC、TRAIL及两者合用对人胚肺WI-38细胞的影响
1.0 μmol/L AFMC、30 μg/L TRAIL分别单用或两者联合处理人胚肺WI-38细胞,其细胞凋亡率与溶媒组比较,差异均无统计学意义(P>0.05,图1).AFMC、TRAIL无论单用或合用于WI-38细胞24 h,均未呈现凋亡特异性的DNA梯形条带(图3B).AFMC对WI-38细胞DR5表达无明显影响(图4B).说明:亚毒性浓度的AFMC 对TRAIL诱导凋亡的增敏作用具有肺癌细胞选择性,与其选择性上调肺癌细胞DR5 表达有关.
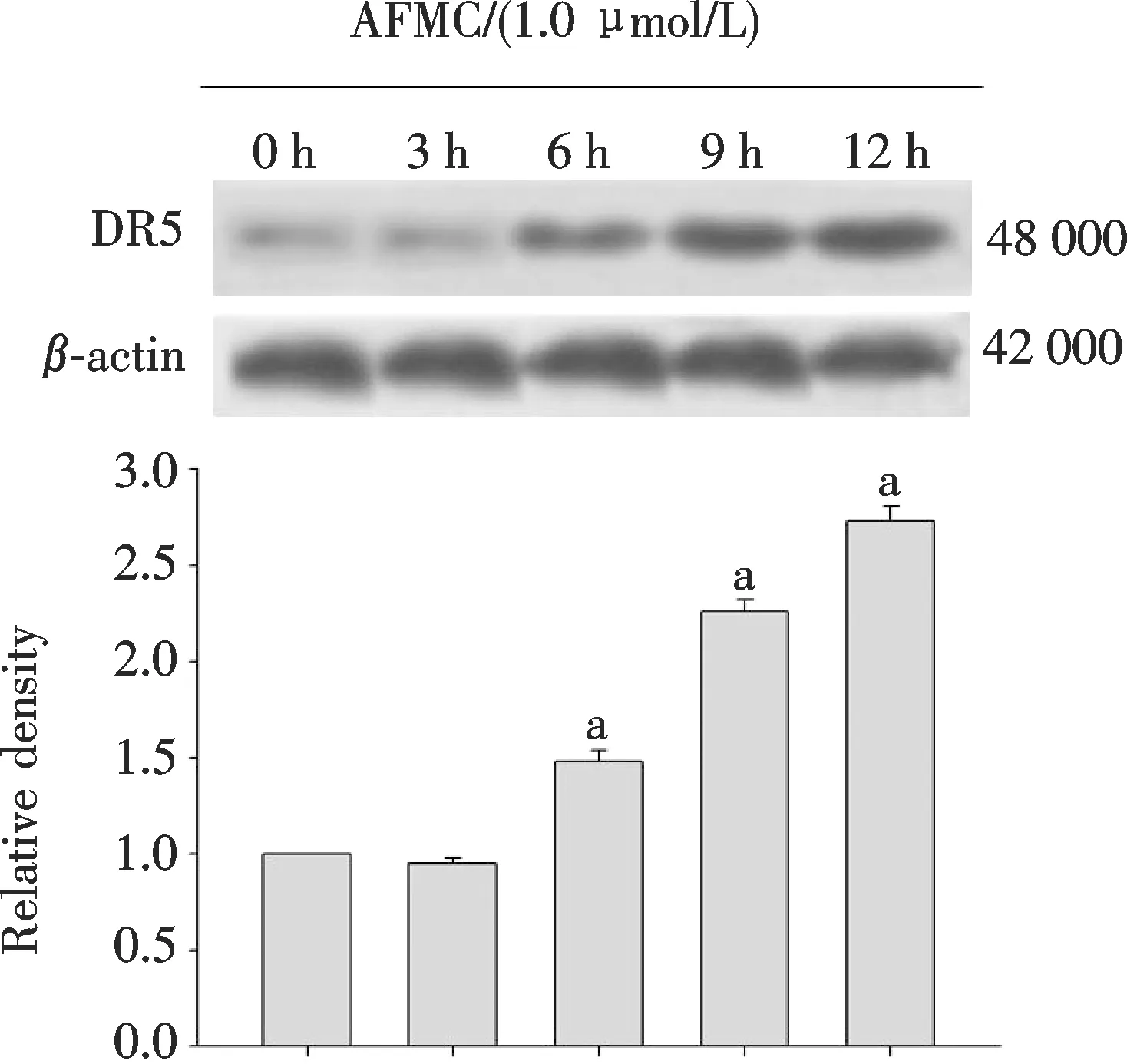
图5 AFMC作用不同时间对A549细胞DR5蛋白表达的影响(n=3) 与0 h组比较 aP<0.05.Fig.5 Effects of AFMC on the DR5 expression in A549 cells at different time points(n=3)aP<0.05 vs vehicle group.
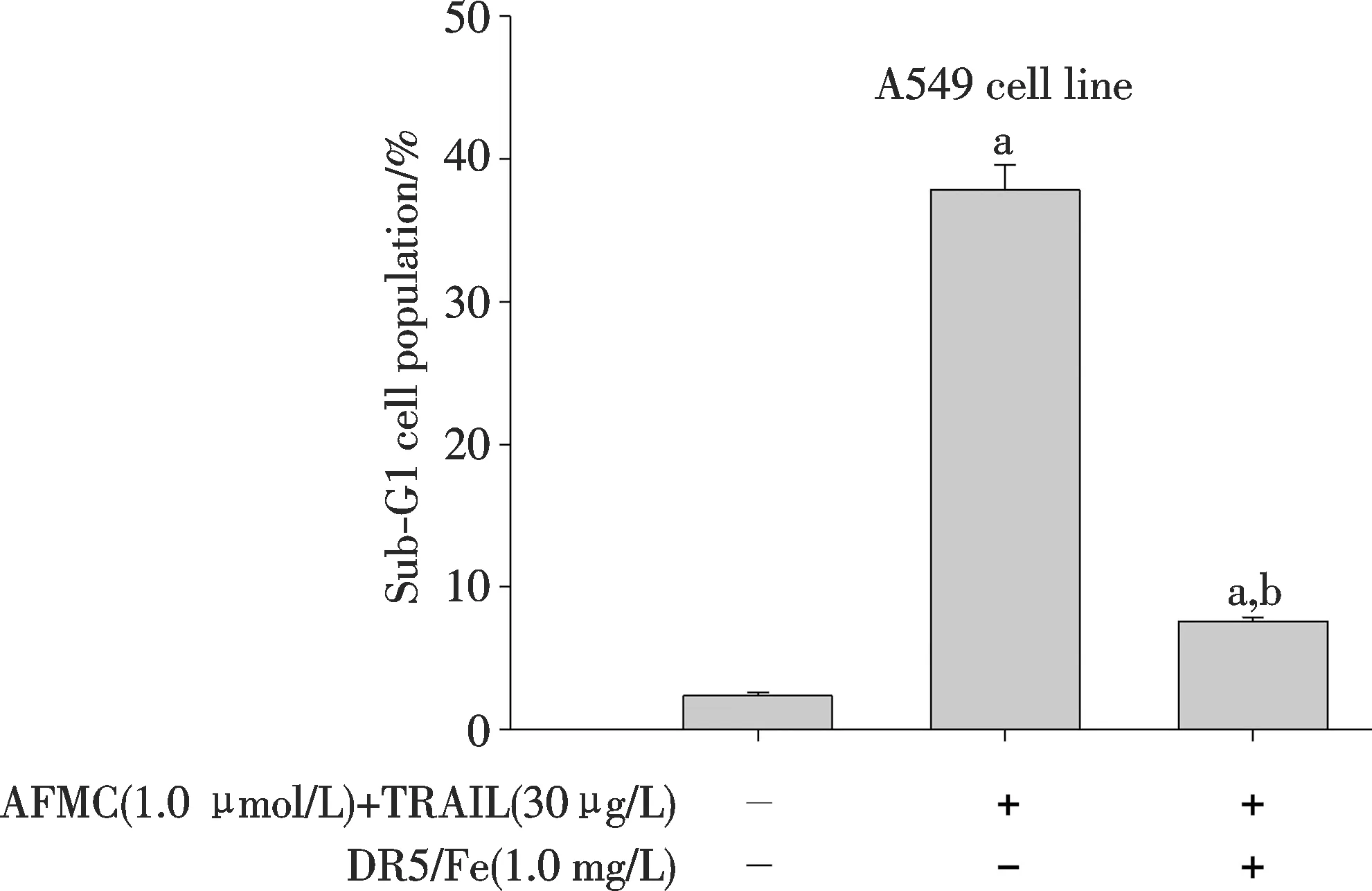
图6 DR5/Fc嵌合蛋白对AFMC和TRAIL合用诱导A549细胞凋亡作用的影响与溶媒组比较, aP<0.05;与AFMC、TRAIL合用组比较, bP<0.05.Fig.6 Effects of DR5/Fc on the apoptosis induction of AFMC in combination with TRAIL in A549 cellsaP<0.05 vs vehicle group; bP<0.05 vs the combined group.
3 讨论
肺癌系全世界最常见的恶性肿瘤之一,全世界每年约有100~130万患者死于肺癌.我国卫生部2008年4月29日公布的第三次全国居民死亡原因调查显示,过去30年间我国肺癌死亡率上升了465%,肺癌已位居我国恶性肿瘤死亡率之首.其中约80%的肺癌患者为非小细胞肺癌(NSCLC),NSCLC发病隐匿,早期不易诊断,确诊时多为中、晚期,已丧失手术良机.目前治疗NSCLC的药物因其非选择性杀伤作用和较强的毒副反应,临床应用受限.临床仍采取以化疗为主的综合治疗,但5年生存率仍低于15%,并且极易复发、转移[11].寻求高效、低毒的新型抗肺癌药物是当前肿瘤防治研究的热点.
TRAIL是1995年发现的与FasL和TNF-α有较高同源性的TNF超家族成员.它们都能与靶细胞膜上特异性DR4和DR5受体结合,通过多种死亡信号转导途径诱导靶细胞凋亡.与TNF、FASL不同,TRAIL能选择性诱导肿瘤细胞、转化细胞、病毒感染细胞凋亡,而对肝细胞、骨髓细胞等正常细胞几乎无毒性.大量临床前实验证实TRAIL能有效地诱导多种肿瘤细胞系凋亡[12].然而随着研究的深入,越来越多的肿瘤细胞尤其是一些恶性肿瘤对TRAIL存在先天性或获得性耐受[2].如何有效逆转肿瘤细胞对TRAIL的凋亡抵抗是当前亟待解决的问题.研究表明,细胞表面DR4和DR5的表达水平是决定肿瘤细胞对TRAIL敏感性的关键,而且在正常37 ℃的生理条件下, TRAIL与其受体结合,DR5的亲和力最强,从而在TRAIL诱导的凋亡通路中发挥最大作用[13].如何上调DR尤其是DR5的表达,增强肿瘤细胞的TRAIL敏感性,充分发挥TRAIL的选择性杀伤效应成为近年研究的热点.
作者前期研究通过细胞毒实验确定了AFMC和TRAIL的亚毒性(细胞毒性<15%)浓度,证实人肺癌A549细胞对TRAIL耐药且AFMC能选择性增强TRAIL对A549细胞毒作用[14].那么,这种细胞毒增敏效应是否通过诱导细胞凋亡实现?本文通过FCM分析和琼脂糖凝胶电泳证明,亚毒性浓度的AFMC与TRAIL联用能协同诱导A549细胞凋亡.文献报道[8],白杨素能通过上调DR5表达增强TRAIL对多种恶性肿瘤的凋亡诱导作用.前期研究中,作者发现不同浓度AFMC对A549细胞DR4的表达未见明显影响.Western Blotting检测AFMC呈浓度和时间依赖方式上调DR5表达.DR5拮抗性抗体DR5/Fc嵌合蛋白能使AFMC和TRAIL合用的A549细胞凋亡率显著下降.提示DR5的表达上调是AFMC增敏TRAIL诱导A549细胞凋亡的机制之一.前期研究表明AFMC和TRAIL合用对永生化二倍体人胚肺WI-38细胞无明显细胞毒性,本文同样证实了两者合用对WI-38细胞无明显凋亡诱导作用,且AFMC对WI-38细胞DR5表达无影响.综合以上结果作者推测:AFMC选择性增敏TRAIL 诱导人肺癌A549细胞凋亡,与其上调DR5 表达有关.关于AFMC如何上调DR5的具体机制仍有待深入研究和探讨.本文结果可为将天然食源性黄酮化学改造,开发基于TRAIL抗肿瘤治疗提供新途径.
[1] GANTEN T M, HAAS T L, SYKORA J,etal. Enhanced caspase-8 recruitment to and activation at the DISC is critical for sensitisation of human hepatocellular carcinoma cells to TRAIL-induced apoptosis by chemotherapeutic drugs[J]. Cell Death Differ, 2004,11 (Suppl 1):86-96.
[2] SINGH T R, SHANKAR S, CHEN X,etal. Synergistic interactions of chemotherapeutic drugs and tumor necrosis factor-related apoptosis-inducing ligand on apoptosis and on regression of breast carcinoma in vivo[J].Cancer Res, 2003,63(17):5390-5400.
[3] KHOO B Y, CHUA S L, BALARAM P. Apoptotic effects of chrysin in human cancer cell lines[J]. Int J Mol Sci, 2010,11(5):2188-2199.
[4] HADJERI M, BARBIER M, RONOT X,etal. Modulation of P-glycopretein mediated multidrug resistance by flavonoid derivatives and analogues[J]. Med Chem, 2003,46(11):2125-2131.
[5] TAN X W, XIA H, XU J H,etal. Induction of apoptosis in human liver carcinoma HepG2 cell line by 5-allyl-7-gen-difluoromethylenechrysin[J].World J Gastroenterol, 2009,15(18):2234-2239.
[6] LI J L, XIE W Y, CAO J G. The effect of 5-allyl-7-gen-difluoromethylenechrysin on proliferation and apoptosis in ovarian cancer cell cultured in vitro[J]. Am J Chin Clin Med, 2005,7:323-326.
[7] 许金华,谭翔文,曹建国.ADFMChR对人肺癌A549细胞增殖活性的影响[J]. 南华大学学报:医学版, 2009,37(6):673-676.
[8] DING J, POLIER G, KÖHLER R,etal. Wogonin and related natural flavones overcome tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) protein resistance of tumors by down-regulation of c-FLIP protein and up-regulation of TRAIL receptor 2 expression[J].J Biol Chem, 2012,287(1):641-649.
[9] JIN C Y, PARK C, HWANG H J,etal. Naringenin up-regulates the expression of death receptor 5 and enhances TRAIL-induced apoptosis in human lung cancer A549 cells[J].Mol Nutr Food Res, 2011,55(2):300-309.
[10] ZHENG X, CAO J G, LIAO D F,etal. Systhesis and anticancer effect of gem-difluoromethylenated chrysin derivatives[J].Chin Chem Lett, 2006,17(11):1439-1442.
[11] WALKER S. Updates in non-small cell lung cancer[J].Clin J Oncol Nurs, 2008,12(4):587-596.
[12] ZHANG T, WU M, CHEN Q,etal. Investigation into the regulation mechanisms of TRAIL apoptosis pathway by mathematical modeling [J].Acta Biochim Biophys Sin, 2010,42(2):98-108.
[13] TRUNEH A, SHARMA S, SILVEMAN C,etal.Temperature-sensitive differential affinity of TRAIL for its receptors DR5 is the highest affinity receptor[J].J Biol Chem, 2000,275(30):23319-23325.
[14] 谢朝晖,刘 飞,曹建国,等. AFMC选择性增强TRAIL对肺癌A549细胞毒性[J].湖南师范大学学报:医学版, 2011,8(1):20-23.
(编辑 王 健)
Role of DR5 Upregulation on 5-Allyl-7-Gen-Difluoromethoxy-Chrysin Sensitizing TRAIL-Induced Apoptosis in Human Lung Cancer A549 Cells
XIEZhao-hui,QUANMei-fang,CAOJian-guo,ZhangJian-song*
(Medical College, Hunan Normal University, Changsha 410013, China)
Aim: To investigate the synergistic action of 5-allyl-7-gen-difluoromethoxychrysin(AFMC) combined with Tumor necrosis factor-related apoptosis-inducing ligand(TRAIL) in apoptosis of human lung cancer A549 cell line and explore whether the potential internal mechanism is refered to the up-regulation of DR5 protein.MethodsHuman lung cancer A549 cells and human immortalized embryonic lung WI-38 cells were cultured in vitro. Cell apoptotic rate was determined by flow cytometry ( FCM ) using PI staining. DNA ladder bands were observed by DNA agarose gel electrophoresis. The expression of DR5 protein was analyzed using Western blotting.ResultsFlow cytometry (FCM) analysis indicated that the apoptosis rate of A549 cells by 1.0 μmol/L AFMC(at suboptimal concentrations) or 30 μg/L TRAIL alone were less than 5%. Combined treatment of A549 cells with AFMC and TRAIL, the apoptosis rate significantly increased(37.80%,P<0.01). But the same treatment to WI-38 cells had no apparent effect(P>0.05). The typical ladder bands could be shown in DNA agarose gel electrophoresis in A549 cells but not in WI-38 cells by the combined use of AFMC and TRAIL .Western blotting analysis indicated that AFMC markedly induced the expression of death receptor 5 (DR5) in A549 cells, in a time-and concentration-dependent manner. DR5/Fc chimera protein, a specific inhibitor for DR5, could dramatically reduce the apoptotic rate of A549 cells by the combination of AFMC and TRAIL(P<0.05). On the other hand, AFMC-mediated induction of DR5 expression is not observed in WI-38 cells.ConclusionAFMC at subtoxic concentration selectively enhances susceptibility to TRAIL-induced apoptosis in human lung cancer A549 cells through up-regulating DR5 expression.
lung cancer; 5-allyl-7-gen-difluoromethoxy-chrysin; TNF-related apoptosis-inducing ligand; DR5; apoptosis
2013-03-02
湖南省卫生厅科研基金资助项目(B2010-104); 湖南省教育厅重点资助项目(11A073);湖南省科技厅科研基金资助项目(2010SK3008)
*
,E-mailjwc_zjs@126.com
R966
A
1000-2537(2014)01-0022-06

