贝伐单抗联合脂质体多柔比星和卡铂治疗复发性卵巢上皮性癌的临床研究
顾 扬, 贾青青
(江苏省苏北人民医院, 1. 妇产科; 2. 肿瘤科, 江苏 扬州, 225001)
卵巢癌是一种严重威胁妇女生命的常见妇科恶性肿瘤,在女性生殖系统恶性肿瘤中病死率最高。近年来以肿瘤细胞减灭术为基础,辅以铂类/紫杉醇联合化疗,使大部分患者获得临床缓解.但最终70%的患者有复发,部分患者产生耐药,给予二线方案化疗,治疗效果很不理想[1]。贝伐单抗(BV)是一种重组人源化抗血管内皮生长因子(VEGF)的单克隆抗体,可与肿瘤细胞上的血管内皮生长因子特异性结合,通过抑制血管生成而抑制肿瘤生长,现已证实单药或联合化疗对多种实体瘤包括卵巢癌有效[2-5]。作者应用贝伐单抗联合脂质体多柔比星和卡铂治疗复发性卵巢上皮性癌取得较好疗效,现报告如下。
1 资料与方法
1.1 临床资料
选择2010年4月—2012年10月年本院妇产科及肿瘤科收治的复发性卵巢癌患者50例。年龄在39~63岁;50例复发患者的初次治疗均为肿瘤细胞减灭术并接受了全身化疗,均采用以铂类为基础的联合化疗方案,如紫杉醇+卡铂(或顺铂)方案等。其中10例患者二线采用吉西他滨+卡铂方案化疗。手术病理分期[按国际妇产科联盟(FIGO, 1988年)的标准]: Ⅱ期4例(8%), Ⅲ期30例(60%), Ⅳ16例(32%); 病理类型:浆液性腺癌35例,黏液性腺癌7例,透明细胞癌4例,子宫内膜样癌4例,病理分化程度:全部为中低分化。治疗前至少具有1个双径可测量的病灶,无腹水等并发症,预计生存期≥3个月;符合化疗的指征和基本要求,包括外周血象基本正常,心、肝、肾功能无明显异常,心电图基本正常,无严重高血压(<150/100 mmHg)及出血性疾病,机体无未愈合的创伤,既往未采用贝伐单抗治疗。随访截至2012年12月,随访时间为2~26个月,平均随访时间16个月。随诊时采用临床检查,胸部、盆腹腔的影像学检查,血清CAl25水平检测。将50例患者随机分成研究组28例,对照组22例,二组在治疗前年龄及全身情况等方面具有可比性。
1.2 治疗方法
观察组患者采用脂质体多柔比星和卡铂联合贝伐单抗治疗,脂质体多柔比星(35 mg/m2)+卡铂(血浆浓度时间曲线下面积=5)方案化疗,每4周为一个疗程,每个化疗周期第1、15天同步给予贝伐单抗5 mg/kg。对照组采用同样剂量脂质体多柔比星和卡铂治疗。所有患者均于治疗前后检查CA125水平、全胸片、全腹部CT扫描。每个治疗周期前对患者进行体格检查、血常规、肝肾功能及血清CA125水平检查,按照WHO的化疗药物毒性反应分级标准对每个周期的副反应进行记录。每2个周期后评估化疗疗效,如果病情稳定或有效则继续用药。至少持续治疗4个周期。
1.3 疗效评价
近期疗效按照实体瘤近期客观疗效评价标准(RECIST 1.0), 分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)。客观有效率(RR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。无进展生存时间(PFS)是指患者治疗开始至任何有记录的病变进展之日或任何原因引起的死亡之日的时间。自判定疗效为CR、PR或SD之日开始,每2个月定期随访1次,以观察有效或SD患者的PFS。因本研究随访时间短,故未评价总生存期。
1.4 不良反应
按照美国国家癌症研究院(NCI)的常见毒性标准3.0版评价BEV联合化疗的相关毒性,患者接受1个周期BEV治疗后即开始评价其毒性。心血管毒性用血压计和心电监测仪及心电图检查判断,泌尿系统的毒性经尿常规和肾功能检查评判。毒性分为0~4级。
1.5 统计学处理
采用SPSS 15.0软件进行统计,率比较采用χ2检验,当理论频数小于5时,采用Fisher′s确切概率法计算P值。P<0.05表示差异有统计学意义。
2 结 果
2.1 客观疗效
研究组中位疾病无进展生存时间为9.1个月,对照组中位疾病无进展生存时间为7.4个月。研究组近期疗效总有效率(CR+PR)为71.4%(20/28), 而总临床获益率达89.2%, 其中CR 25%(7/28), PR 46.4%(13/28), SD 17.9%(5/28), PD仅为10.8%(3/28)。对照组近期总有效率59.1%(13/22), 总临床获益率72.7%, CR 13.6%(3/22), PR 45.5%(10/22), SD 13.6%(3/22), PD 27.3%(6/22)。有效患者中CA125均有不同程度的下降。两组患者近期疗效统计研究组PFS、总有效率明显高于对照组,具有显著性差异(P<0.05)。具体结果见表1。
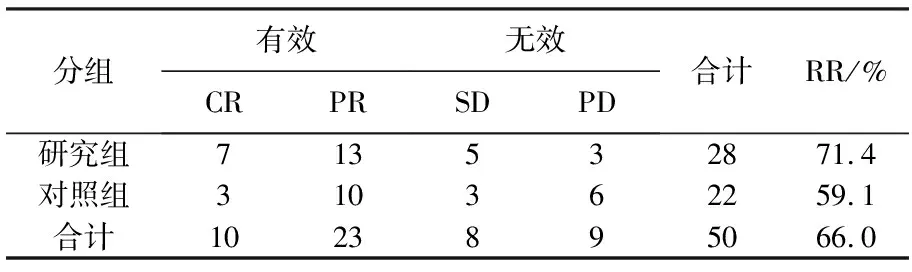
表1 2组近期疗效比较
2.2 两组患者毒副反应
研究组中出现白细胞减少57.1%(16/28),恶心、呕吐53.4%(15/28),手足综合征7.4%(2/28),高血压7.4%(2/28),蛋白尿3.6%(1/28),出血10.6%(3/28)(2例为鼻出血, 1例为阴道出血)。对照组中出现白细胞减少54.5%(12/22),恶心、呕吐54.5%(12/22),手足综合征9%(2/22),无高血压、蛋白尿及出血的发生。研究组出现高血压、蛋白尿及出血,均为Ⅰ~Ⅱ级。余毒副反应2组无显著性差异。
3 讨 论
晚期卵巢癌患者5年生存率低于30%, 主要原因是复发和耐药[6-7]。目前铂类敏感型复发性卵巢癌的标准治疗,仍采用铂类药物化疗,而铂类耐药型复发性卵巢癌尚没有标准化疗方案[8]。多柔比星属蒽环类抗生素,是一种活性强的广谱抗肿瘤药物,广泛用于乳腺癌、卵巢癌、结肠癌、肝癌、白血病等的治疗。其疗效毒性与血药浓度有关,其心肌损害常使肿瘤患者产生顾虑[9], 其包封于PEG化脂质体,有利于降低毒性,提高疗效[10], 并且明显增加在多柔比星肿瘤内的蓄积,成为靶向制剂[11]。脂质体多柔比星对铂类敏感型及耐药型复发性卵巢癌均有一定的疗效。一项包括104名首次化疗结束6月后复发的卵巢癌患者,其联合卡铂化疗反应率为63%, PFS为9.4个月,中位OS为32月[12]。研究发现新生血管的形成是卵巢癌细胞生长的基础,同时又是肿瘤转移的重要途径,它直接影响肿瘤的治疗和预后。而血管内皮生长因子(VEGF)是目前已知的作用最强、特异性最高的促血管生成因子,贝伐单抗通过与VEGF结合,抑制内皮细胞增殖及新血管生成,从而发挥抗癌作用,在各种肿瘤模型包括卵巢癌模型的研究中有抑制VEGF活性,减缓肿瘤生长及转移的作用[13]。2005年Monk等[14]首先报道1 例卵巢癌患者在11次化疗和放疗失败后应用BEV获得5个月的有效反应。次年报道对多重化疗失败后的卵巢癌患者应用BEV 15 mg/kg,静脉注射(iv), 每3周1次,反应率为16%。Chura等[15]通过自身对照的回顾性研究表明,贝伐单抗与口服环磷酰胺联合化疗疗效显著,反应率达53%, 无显著毒性。Hurt等[16]对55例复发性卵巢癌应用紫杉醇60~70 mg/m2, 静脉注射, 1次/周, BEV 10~15 mg/kg, 静脉注射, 1次/2周。结果显示:中位无进展生存期7个月,中位总生存期12个月,总反应率60%(完全缓解25%, 部分缓解35%)。完全缓解和部分缓解的中位无进展生存期分别为14个月和5个月。Cannistra等[17]对铂类耐药的卵巢癌及原发性腹膜癌44例患者继续Ⅱ期临床试验。其中有接受阿霉素、拓扑替康及此二药联合化疗,尚有患者接受三种治疗方法。有15.9%患者平均无进展生存期4.4个月,平均生存期10.7个月。张莉等[18]统计贝伐单抗不良反应结论为以高血压发生率最高,尚有心肌酶、心动过缓、鼻出血、脑出血、蛋白尿、肠梗阻、口腔黏膜炎、指甲毒性、伤口疼痛、皮肤皲裂。患者发生ADR后,可调整用药以及对症处理。本研究中贝伐单抗联合化疗时,有高血压、蛋白尿及出血的发生,但均为Ⅰ~Ⅱ级,给予降压药及止血药后,血压恢复正常,出血停止,蛋白尿在停止用药后恢复。其余副反应与单独化疗组相似。本研究中研究组有效率及无进展生存时间均高于对照组(P<0.05), 未增加骨髓抑制及胃肠道反应等毒副反应。贝伐单抗联合脂质体多柔比星和卡铂化疗对复发性卵巢上皮性癌有较高的疾病控制率,安全性较好,临床获益率高,耐受性好。
[1] AlbertsD S, I-IanniganE V, Liu P Y, et al. Randomizedtrial of adjuvant intraperitoneal alpha-interferon in stageⅢovarian cancer patients who have no evidence 0f disease after primarysurgery and chemotherapy: an intergroup study[J]. Gynecol Oncol, 2006, 100(1): 133.
[2] 谢守珍, 宋成文, 王晶, 等. 卵巢癌术后化疗联合醋酸甲羟孕酮抑制盆腔病理血管生成的研究[J]. 华南国防医学杂志, 2008, 22(5): 33.
[3] 李昌军, 王小芳, 冯声蓉. 经阴道彩色多普勒超声检查对卵巢良、恶性肿瘤的鉴别诊断价值[J]. 海南医学院学报, 2011, 17(12): 1713.
[4] 段振玲, 彭芝兰, 王赞宏. 自噬基因Beclin1对上皮性卵巢癌细胞SKOV3生长的抑制作用[J]. 南方医科大学学报, 2010, 30(4): 672.
[5] 仲召阳, 卿毅, 李梦侠, 等. Bayes法建立卵巢癌多肿瘤标志物判别函数及临床意义[J]. 华南国防医学杂志, 2009, 23(1): 24.
[6] 张瑞涛, 史惠蓉, 黄好亮, 等. MACC1、HGF和C-met蛋白在卵巢上皮性癌中的表达及其意义[J]. 南方医科大学学报, 2011, 31(9): 1551.
[7] 刘忠梅, 胡春霞, 黎明鸾, 等. 血清HE4在卵巢癌中的表达及其诊断价值[J]. 海南医学院学报, 2011, 17(3): 31.
[8] 刘丽娟, 赵东阳, 王建. 钙离子在纳秒级陡脉冲诱导卵巢癌细胞SKOV3凋亡通路中的作用[J]. 南方医科大学学报, 2011, 31(5): 772.
[9] 陆婉琴. 阿霉素的药物动力学与临床观察[J]. 新药与临床, 1991, 10: 51.
[10] Sakae U, Kazuo M, Osamu I, et al. Enhanced tumor targeting and improved antitumor activity of doxorubicin by longcirculating liposomes containing amphipathic poly(ethyleneglycol) [J]. Int J Pharm, 1995, 126(1): 41.
[11] 文旭等. 脂质体多柔比星药物动力学研究进展[J]. 中国新药与临床杂志, 2001, 20(3): 216.
[12] Ferrero J M, Weber B, Geay J F, et al. Second-line chemotherapy with pogylated liposomal doxoruhicin and carboplatin is highly effective in patients with advanced ovarian cancer in late relapse: a GINECO phase Ⅱ trial[J]. Ann Oncol, 2007, 18(2): 263.
[13] Gerber H P, Ferrara N. Phamacology and phamacodynamics of bevacizumab as monotherapy or in combination with cytotoxic therapy in preclinical studie[J]. Cancer Res, 2005, 65: 671.
[14] Monk B J, Choi D C, Pugmire G, et al. Activity of bevacizumab (rhuMAB VEGF) in advanced refractory epithelial ovarian cancer[J]. Gynecol Oncol, 2005, 96(3): 902.
[15] Chura J C, Van Iseghem K, Downs LS Jr, et al. Bevaci- zumab plus cyclophosphamide in heavily pretreated patients with recurrent ovarian cancer[J].Gynecol 0ncol, 2001, 107: 326.
[16] Hurt J D, Richardson D L, Seamon L G, et al. Sustained progressionfree survival with weekly paclitaxel and bevacizumab in recurrent ovarian cancer[J]. Gynecol Oncol, 2009, 115(3): 396.
[17] Cannistra S A, Matulonis U A, Penson R T, et al. Phase II study of bevacizumab in patients with platinum-resistant ovarian cancer or periponeal serous cancer[J]. J Clin Oncol,2007, 25(33): 5180.
[18] 张莉. 贝伐单抗致不良反应统计分析[J]. 临床医学工程, 2012, 19(1): 129.

