静脉皮瓣研究进展
汪志群 张桂生 赵晓亮
·综述与讲座·
静脉皮瓣研究进展
汪志群 张桂生 赵晓亮
创伤与修复;皮瓣;静脉皮瓣
随着显微外科的发展,游离皮瓣越来越受到人们的亲睐。传统的游离穿支皮瓣(生理皮瓣)需要固定的动脉及静脉,术中需要深层的解剖、术后产生供区美观方面相对较差及受区需多次手术治疗(皮瓣修薄、功能重建等),进而人们提出了静脉皮瓣,其一不需要深度解剖、随意性强、不牺牲主要动脉、供区相对广泛,其二皮瓣较薄、同时也可能修复受区部位肌腱神经血管等。许多实验性研究及临床应用都已证实静脉皮瓣的优势。然而它的安全性能却相对较差,容易缺血坏死及静脉充血,仍不能被临床上广泛应用。因为静脉皮瓣的诸多优势,仍受到国内外进一步临床及实验研究。本文对静脉皮瓣近些年国内外研究进展进行综述,旨在为今后的研究提供参考。
1 静脉皮瓣概述
由于各种原因包括外伤、感染、肿瘤等因素引起皮肤软组织缺损是很常见的。早期覆盖闭合创面有利于避免感染和患者开始早期康复锻炼[1]。而对于一些皮肤软组织缺损的创面来说,进行合理设计及注意围手术期处理,静脉皮瓣还是可以选择的,因为其供区广泛、术中不必深入解剖就可获取相应大小的皮瓣、同时可修复受区部位肌腱、神经、血管等、术后受区及供区相对美观[2,3]。随着对静脉皮瓣研究进一步成熟,它陆续被广泛用于修复上、下肢皮肤软组织缺损[4,5]甚至口内面部及颈部的皮肤软组织缺损[6]。对于静脉皮瓣供区选择,前臂因皮肤较薄、血管口径一致并且可同时移植掌长肌腱修复已被人们认为比较合适的静脉皮瓣供皮区[7]。
静脉皮瓣(非生理性循环皮瓣)分为动脉化静脉皮瓣和单纯静脉皮瓣。动脉化静脉皮瓣是一种静脉皮瓣动脉化,即游离一块含皮下静脉的皮肤组织,其中一端与受区动脉连接,另一端与受区静脉或动脉连接;单纯静脉皮瓣是静脉皮瓣中双侧与受区静脉连接。该种静脉皮瓣中血运是依靠非生理性通道,即通过静脉逆行到达皮瓣外围组织来营养皮瓣。然而对于静脉皮瓣成活率的研究,Wolff等[8]在大鼠上腹部动脉及其伴行静脉的模型上创建一个A-V或V-V型静脉皮瓣,据他们报道:A-V型皮瓣成功率是92.7%,高于V-V皮瓣(68.6%)。
在一些临床外科修复与重建领域中,因为静脉皮瓣容易充血及缺血坏死,进而被人们视为一种不为可靠的皮瓣[9]。据一些文献中报道该皮瓣成活率甚至低于57.7%,皮瓣呈现出不同程度坏死[3]。通过对51例动脉化静脉皮瓣患者研究,小面积的静脉皮瓣成活率较高,分析显示:椭圆型动脉化静脉皮瓣面积小于767.3 mm2相对于超过767.3 mm2的皮瓣较为安全;同样在他们的研究中还发现损伤部位中可吻合的静脉及动脉数量与皮瓣成活有关,但皮瓣供区部位与皮瓣成活没有显著性差异;并且对年龄因素来说也没有显著性差异;研究表明20岁及以下患者仍有较高失败率(57%)[10]。
在临床工作中,通常会遇到一些大面积皮肤软组织缺损的创面,该类静脉皮瓣是否能胜任。人们通过对皮瓣的类型设计,即改变皮瓣中传入传出的血管类型,来提高皮瓣的成活率[9-11]。依据此种情况许多大面积的静脉皮瓣成活均已被报道。
2 静脉皮瓣成活机制
对于大部分组织来说,他们都需要一个含氧量较高的血液供应,同样能够灌注整个组织,包括它的外围[12]。因皮肤软组织对缺氧耐受力较强,较少的营养能量代谢也能维持皮肤软组织的成活。Wolff等[13]对静脉皮瓣研究中,在静脉皮瓣皮肤毛细血管中测得其血红蛋白含氧量为51%~74%,单纯静脉皮瓣中依靠静脉血营养皮瓣含氧量更低,低至10%。
2.1 微循环建立过程 血液与组织细胞进行物质交换是在微循环内进行的,动脉血或静脉血能否逆行通过静脉系统进入微循环,是静脉皮瓣成活的首要环节。国内外学者用血管造影、荧光素染色、墨渍灌注以及显微镜下活体观察等不同方法进行较深入的研究,其证实了静脉皮瓣内确实存在营养血流,并呈现出血流进入微循环有多种方式:(1)大部分是通过微静脉直接进入毛细血管;(2)部分通过动静脉短路进入微动脉后,再流入正常的生理微循环中;(3)通过灌注、环流、再灌注、再环流等形式在早期呈一种迷宫式循环进行物质交换。1987年Guenter等[14]通过对皮瓣供血及回流血管内的血液分别进行PaO2、PaCO2、pH值及乳酸浓度的测定与比较,已证明血液在皮瓣组织内进行了物质交换,且皮瓣组织存在着代谢活动。
2.2 适当压力梯度 在静脉皮瓣成活机制中,传入传出血管的压力梯度因素也起着至关重要的作用。研究数据显示64.2%~100%充血栓塞率都归因于缺乏一定传入传出的压力梯度[9],其可影响血液的灌注和排出,使得静脉皮瓣充血、坏死。之所以在静脉皮瓣中不仅需要含有丰富的小静脉,而且还需要一个适当压力梯度才能确保血液的灌注[15,16]。存在这种压力梯度才能通过毛细血管促使血液循环。
2.3 生理性改变 Xiu等[17]通过对兔子的研究表明:对于仅含有静脉、没有动脉的静脉皮瓣中,早期仍然依靠静脉中血液供给,而静脉周围结缔组织也有保护滋养血管作用,它们是相辅相成的;他们证实了在丰富的静脉网络中,早期长入的新生毛细血管使静脉皮瓣发生生理性改变,这对静脉皮瓣起着至关重要的作用。Hussmannn[18]对成活的动脉化静脉皮瓣进行了组织学观察,发现各层组织及其附属结构均无异常改变,但动脉化后的静脉在术后早期明显扩张,内膜受损,晚期静脉管壁增厚,内皮细胞增生,中膜胶原纤维增粗,但未发现肌纤维的增多或内弹力膜的形成。肌纤维和弹力膜属动脉血管组织结构特征,静脉网动脉化属于生理学或血液动力学上的概念,静脉在组织学上不会发生向动脉结构转变的现象,而内膜增厚可以使管腔狭窄,影响血流,最终通过新生毛细血管维持静脉皮瓣的成活。许多研究均表明低灌注可促进静脉皮瓣的毛细血管长入[3]。
2.4 其他因素 静脉皮瓣移植后,皮瓣及受区通过一些基因表达及特殊物质产生来提高皮瓣的成活率。张等[19]研究发现皮瓣移植后12~24 h内血管内皮生长因子的表达基因迅速增加,后还发现血管内皮生长因子可刺激动静脉括约肌的开放引起血管的舒张,从而既能增加静脉皮瓣的成活率又能提高其成活面积。研究人员还发现皮瓣本身及受区组织中存在一种等离子氧对皮瓣的灌注[15]。
3 受植床对静脉皮瓣的影响
受植床的血运对静脉皮瓣的成活也起着重要作用,同时也影响皮瓣的成活。大量动物实验及临床实践证明,正常皮肤真皮下及筋膜深浅面都有丰富血管网,这些血管网可吸取深部组织的渗出液。Kaufman等[20]证明皮瓣与受植床的密切接触可增加带蒂皮瓣远端的成活面积,并发现皮瓣远端成活主要依赖于床面渗出液的滋养。由此可以推想:(1)带有筋膜层的静脉皮瓣可通过血管网将吸取的渗出液弥散到皮瓣全层为皮瓣提供营养;(2)良好的受植床血运可促进新生毛细血管长入静脉皮瓣维持静脉皮瓣成活。
4 静脉皮瓣成活类型
首次静脉皮瓣的研究是1981年在一个老鼠模型由Nakayama等[21]描述,并且在1987年由Yoshimura 等人在手指重建方面做了临床系列的研究[22]。虽然这个概念引入了近三十年,因为静脉皮瓣容易发生周围缺血及充血坏死等,从而在临床上限制其使用,但人们还是对它不断进行研究,试图通过改变皮瓣成活类型来提高皮瓣的成活率。
4.1 皮瓣倒置逆行移植 皮瓣移植后,血液必须克服静脉瓣膜阻力,逆静脉的生理血流方向进入皮瓣,由于静脉瓣膜广泛地分布在各浅静脉管腔,其对静脉内逆流的影响自然会引起研究者的关注[23],静脉瓣膜不仅能阻挡血的逆流,而且还能引起血液在瓣膜周围瘀积,形成血栓,闭合静脉管腔,引起皮瓣充血坏死。故人们将皮瓣倒置逆行移植克服瓣膜阻力。通过Moshammer等[24]在尸体上行血管造影显示,通过此种方式在很大程度上增强了皮瓣周围灌注面积。同一组临床系列报道对13例逆行静脉皮瓣研究中,其都具有良好的效果,但充血问题仍然存在,最后其中4例发生表皮局部坏死、1例7% 及1例15%全层坏死[2]。
4.2 增加皮瓣排出途径 对于逆行移植来说,较大压力血流进入微静脉系统,使静脉内膜受损,内皮下组织裸露,极易发生血流瘀滞及微小血栓形成,使皮瓣组织缺血坏死。因此人们在静脉皮瓣中吻合多个排出静脉血管[25]和以一个较细的静脉作为传入静脉、较粗的静脉作为传出静脉来控制充血问题[26]。Chen等[27]依据此种理论进行分类研究,根据传入和传出血管网状中央静脉分为Ⅰ到Ⅳ型。在Ⅰ型和Ⅱ型静脉皮瓣中,传入及传出吻合的都是静脉,不同的是Ⅱ型皮瓣中传入或传出一侧与供区静脉连接,该两中类型的静脉皮瓣失败率为30%~80%[11],面对如此失败率,从而只限于小皮瓣的使用。Ⅲ型和Ⅳ型静脉皮瓣被称为动脉化静脉皮瓣,Ⅲ型传入为动脉、传出为静脉,Ⅳ型中传入传出皆含为动脉。他们均容易引起静脉充血致部分或全层坏死。数据显示在较大的静脉皮瓣中坏死率可达42.3%[3]。
上述静脉皮瓣类型中充血、坏死仍然是件重要的问题。因其存在一定返流的静脉压力,如大于流入皮瓣的静脉压力,一样容易发生血液瘀滞。事实上,在最大已发表的系列静脉皮瓣(154例)报道中,Woo等[28]经常用两个或两个以上的传出静脉,依然经常遇到大量充血和水肿问题,7%的皮瓣数量均发生不同程度的坏死。
4.3 应用“模拟伐” 为避免静脉皮瓣中一些不确定性的逆行血流引起皮瓣充血、坏死,将通过一个“模拟伐”来实现对静脉皮瓣中血液起分流及限制作用,这个概念已被铃木等[29]提出。他们利用兔子耳朵中血管来模拟一个动脉化的静脉皮瓣,利用结扎的中央静脉来模拟一个阀,这样传入与传出通道分离使得动脉压力仅限于传入静脉迫使血液进入外围,而传出静脉中的静脉压力保持一致进而允许血液疏散。人们获知此种方式能提高静脉皮瓣的成活率。因此人们通过利用“模拟伐”来设计各种皮瓣类型,利用其对静脉皮瓣中血流分流和限制作用,来提高对皮瓣外围的灌注,减少静脉皮瓣的充血作用。Lin等[9]通过设计图1动脉化静脉皮瓣的类型来修复临床上一些皮肤缺损,其设计皮瓣的平均大小2.3×4.5 mm2,最大的为3.5×7.5 mm2,结果显示:Ⅱ型皮瓣发生充血栓塞概率最低,I型发生率最高。
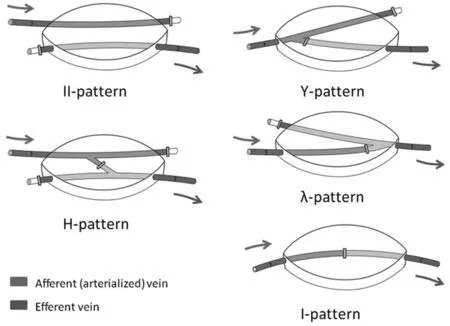
图1 根据上述皮瓣类型修复创面,箭头为血流方向,红色代表传入静脉(含动脉血),蓝色为传出静脉
Lam等[30]利用兔子腹部的血管来设计上述动脉化静脉皮瓣的类型,观察其血流的变化;为了减少静脉皮瓣充血,Ⅰ型皮瓣阀门位置更趋向于近端1/3处,而不是血管中段,这样一个长段静脉可供静脉引流;最后通过对22例患者的静脉皮瓣(平均为2.3 cm×4.5 cm,最大为3.5 cm×7.5 cm)研究中4例为Ⅱ型、5例为H型、7例为Y/λ型、6个为I型,其中6例发生不同程度充血。结合实验研究对所有充血情况下分析,充血只发生在传入端皮瓣(I型瓣发生概率更高),术后第2天或第3天开始逐渐消退直至术后7~14 d;Ⅱ型及H型静脉皮瓣中未发现明显皮瓣充血[30]。此种设计方案,流入的血液通过旁路进入外围组织起到营养皮瓣作用,最后汇入流出静脉,达到一个相对生理性的环境。因此,建议对静脉皮瓣类型选择:首先选择Ⅱ型或H型,其次是Y/λ型,最后是Ⅰ型。通过临床及实验研究表明并联限制的动脉化静脉皮瓣能增强对皮瓣外围的灌注和减少其充血坏死并发症的发生,使其以后在皮肤软组织缺损修复中能成为一种相对安全可靠的皮瓣,并对以后静脉皮瓣的研究也能起一定的作用。
5 静脉皮瓣术前干预
Mutaf等[31]利用大鼠对皮肤扩张进行研究,在皮下安装扩张器,1周后可见静脉明显扩张。Shin等[32]通过兔子实验研究表明扩张后的皮瓣成活区域是未扩张的3倍多,扩张后既能增加静脉皮瓣移植的面积、减少皮瓣厚度,又能对供区产生一定的美观作用。
对预先设计好的静脉皮瓣实行动脉化干扰,使得静脉皮瓣中血液动力学及形态学发生改变来增加静脉皮瓣的成活率。
随着研究的深入,结合两者来提高静脉皮瓣成活率。刘春利等[33]采用前臂Ⅰ期静脉动脉化加皮肤扩张器预制皮瓣,Ⅱ期行皮瓣转移的方法,作鼻再造及瘢痕创面修复21 例,获得了满意的疗效。分析认为静脉动脉化后通过高压、高氧动脉化血流对静脉内皮细胞会造成严重损伤。Ⅰ期预制皮瓣使损伤的静脉内皮细胞得到修复,静脉系统适应了高压、高氧的动脉血流后再行皮瓣转移,则提高了皮瓣的成活率及成活质量。
通过上述手术对静脉皮瓣结构的干扰,称为延迟程序;14 d的延迟程序,显著增加了静脉皮瓣的成活面积[34]。随后,也有学者证明,结合手术和化学延迟程序比任何单延迟程序更为有效,增加皮瓣生存同时又可以缩短延迟时间[3]。虽然据报道上述几种早期干预措施均能提高静脉皮瓣的成活率,但他们一样没有完全消除静脉皮瓣充血及坏死并发症的发生,并且需要两阶段的手术过程从而限制了其广泛使用。
6 皮瓣充血并发症的处理
关于缺氧血液及有毒代谢产物地转移,静脉危象比动脉危象更为值得关注。特别是8 h内的静脉危象,早期干预可避免或减少皮瓣的坏死[35]。(1)使用血管活性药物抑制血栓形成保持血管通畅,并促进侧支循环建立,可作为术后常规使用,但应密切监测患者的APTT等指标,防止出血风险;(2)使用水蛭是一种常规方法治疗静脉充血[36];(3)切割远端部分皮瓣注射肝素获得出血;(4)取远端皮瓣中厚皮片暴露创面并应用含肝素纱布浸泡获得出血;(5)使用静脉导管插入与皮瓣中静脉吻合间断放血治疗静脉充血等。
诸多实验及临床研究都是为了能获得一个理想而安全的静脉皮瓣。以最少的损失来获取最大的收获。通过本文对静脉皮瓣研究进展阐述显示动脉化的静脉皮瓣成活率相对较高,可优先选择,并呈现一个相对有前途的II型或H型静脉皮瓣类型,也可对需要移植的静脉皮瓣行干预措施提高成活率。基于静脉皮瓣的诸多不足,伴着显微外科的发展及创新思维的拓展,希望该类皮瓣能为修复与重建工程带来新的篇章。
1 Browne EZ,Pederson WC.Skin grafts and skin flaps,in Green DP,Hotchkiss RN,Pederson WC,et al (eds): Operative Hand Surgery,Vol2.Philadelphia,PA,Elsevier Churchill Livingstone,2005,34:1629-1704.
2 Koch H,Scharnagl E,Schwarzl FX,et al.Clinical application of the retrograde arterialized venous flap.Microsurgery,2004,24:118-124.
3 Yan H,Brooks D,Ladner R,et al.Arterialized venous flaps: A review of the literature.Microsurgery,2010,30:472-478.
4 Yan H,Zhang F,Akdemir O,et al.Clinical applications of venous flaps in the reconstruction of hands and fingers.Arch Orthop Trauma Surg,2011,131:65-74.
5 Galumbeck MA,Freeman BG.Arterialized venous flaps for reconstructing soft-tissue defects of the extremities.Plast Reconstr Surg,1994,94:997-1002.
6 Safak T,Akyurek M.Cephalic vein-pedicled arterialized anteromedial arm venous flap for head and neck reconstruction.Ann Plast Surg,2001,47:446-449.
7 Lin CH,Wei FC,Lin YT,et al.Composite palmaris longus-venous flap for simultaneous reconstruction of extensor tendon and dorsal surface defects of the hand—long-term functional result.J Trauma,2004,56:1118-1122.
8 Wolff KD,Telzrow T,Rudolph KH,et al.Isotope perfusion and infrared thermography of arterialized,venous flow-through and pedicle venous flaps.Brit J Plast Surg,1995,48:61-70.
9 Lin YT,Henry SL,Lin CH,et al.The shuntrestricted arterialized venous flap for hand/digit reconstruction: Enhanced perfusion,decreased congestion,and improved reliability.J Trauma,2010,69:399-404.
10 Ryosuke K,Ryosuke I,Manabu N,et al.Nakamura factor affecting the success of arterialised venous fiaps in the hand.Care Injured,2008,39:S18-S24.
11 Rozen WM,Ting JW,Gilmour RF,et al.The arterialised saphenous venous flow-through flap with dual venous drainage: A new technique to improve survival.Microsurgery,2006,42:149-154.
12 Romi G,Warren M,Jeannette W,et al.The nomenclature of venous flow-through flaps: Updated classification and review of the literature.Microsurgery,2012,32:497-501.
13 Wolff KD,Dollinger P.Hemoglobin oxygenation of venous-perfused forearm flaps.Ann Plast Surg,1998,41:646-653.
14 Guenter K,Eridsion E,Rssell RC.Effect of arteriovenous flow reversal on blood flow and metabolism in a skin flap.Plast Reconstr Surg,1987,79:375.
15 Krishnan KG,Stutzle H,Stock W.The venous flap.Eur J Plast Surg,2000,23:64-71.
16 Woo SH,Seul JH.Pre-expanded arterialised venous free flaps for burn contracture of the cervicofacial region.Br J Plast Surg,2001,54:390-395.
17 Xiu ZF,Chen ZJ.The microcirculation and survival of experimental flow-through venous flaps.Br J Plast Surg,1996,49:41-45.
18 Hussmann J.Arterialization of epigastric skin flap in rabbits.Chir Plastics,1986,8:171.
19 Zhang F,Brooks D,Chen W,et al.Improvement of venous flap survival by application of vascular endothelial growth factor in a rat model.Ann Plast Surg,2006,56:670-673.
20 Kaufman T,Angel M,Eichenlaub EH,et al.The salutary effects of the bed on the survival of experimental flaps.Ann Plast Surg,1985,21:14-64.
21 Nakayama Y,Soeda S,Kasai Y.Flaps nourished by arterial inflow through the venous system: an experimental investigation.Plast Reconstr Surg,1981,67:328-334.
22 Yoshimura M,Shimada T,Imura S,et al.The venous skin graft method for repairing skin defects of the fingers.Plast Reconstr Surg,1987,79:243-248.
23 Nichter LS,Haines PC,Artrialized venous perfusion of composite tissue.Am J Surg,1985,150:191.
24 Moshammer HET,Schwarzl FX,Haas FM,et al.Retrograde arterialized venous flap: an experimental study.Microsurgery,2003,23:130-134.
25 Reynoso R,Haddad JL,Sastre N.A few considerations regarding enhancement of arterialized skin flap survival.Microsurgery,2000,20:176-180.
26 Kovacs AF.Comparison of two types of arterialized venous forearm flaps for oral reconstruction and proposal of a reliable procedure.J Craniomaxillofac Surg,1998,26:249-254.
27 Chen HC,Tang YB,Noordhoff MS.Four types of venous flaps for wound coverage: A clinical appraisal.J Trauma,1991,31:1286-1293.
28 Woo SH,Kim KC,Lee GJ,et al.A retrospective analysis of 154 arterialized venous flaps for hand reconstruction: an 11-year experience.Plast Reconstr Surg,2007,119:1823-1838.
29 Suzuki Y,Suzuki K,Ishikawa K.Direct monitoring of the microcirculation in experimental venous flaps with afferent arteriovenous fistulas.Br J Plast Surg,1994,47:554-559.
30 Lam WL,Lin WN,Bell D,et al.The physiology,microcirculation and clinical application of the shunt-restricted arterialized venous flaps for the reconstruction of digital defects.J Hand Surg Eur Vol,2013,38:352-65.
31 Mutaf M,Tasaki Y,Fujii T.Expansion of venous flaps: An experimental study in rats.Br J Plast Surg,1998,51:393-401.
32 Shin HJ,Woo SH,Jeong JH,et al.Survival pattern of previously expanded arterialized venous flaps.J Korean Soc Plast Reconstr Surg,1997,24:459-467.
33 刘春利,袁伟伟,鲁开化.动脉化静脉皮瓣改建后的临床应用.中华显微外科杂志,1998,21:301.
34 Byun JS,Constantinescu MA,Lee WP,et al.Effects of delay procedures on vasculature and survival of arterialized venous flaps: An experimental study in rabbits.Plast Reconstr Surg,1995,96:1650-1659.
35 Kerrigan CL,Wizman P,Hjortdal VE,et al.Global flap ischmia:a comparison of arterial versus venous etiology.Plast Reconstr Surg,1994,93:1485-1495
36 Conforti ML,Connor NP,Heisey DM,et al.Evaluation of performance characteristics of medicinal leech (Hiruda medicinalis) for the treatment of venous congestion.Plast Reconstr Surg,2002,109:228-235.
10.3969/j.issn.1002-7386.2014.10.051
050051 石家庄市,河北医科大学第三医院手外科
张桂生,050051 河北医科大学第三医院手外科;
E-mail:zgshbsy@aliyun.com
R 622.13
A
1002-7386(2014)10-1550-04
2014-01-20)

