高原地区阻塞性睡眠呼吸暂停低通气综合征患者肺动脉高压与血管内皮功能的关系及CPAP的干预作用
杨生岳 戴胜归 冯恩志 殷 和 张 瑛 董红梅
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome, OSAHS)是一种常见的具有潜在危险的睡眠呼吸障碍性疾病。其临床特征是夜间睡眠呼吸过程中上气道狭窄,软组织松弛,舌根后置、松弛,吸气时胸腔负压增大,舌根后坠与咽后壁紧贴造成上气道阻塞,从而引起反复、频繁的呼吸暂停和/或低通气,交替出现缺氧-再氧合。由于机体长期反复的慢性间歇性缺氧(chronic interminttent hypoxia, CIH),从而导致心、脑、肺等多器官功能损害[1-5]。长期反复的CIH可引起肺动脉高压(pulmonary arterial hypertension, PAH),而PAH的形成是导致慢性肺源性心脏病的根本原因,严重者可发生右心衰竭或其它并发症而死亡[6-8]。在高原低氧环境下,人体健康时就存在一定程度的低氧血症,患OSAHS后CIH更严重,并发症更多,预后更差[9]。本研究通过检测高原地区中重度OSAHS合并PAH患者多导睡眠图(polysomnography, PSG)、平均肺动脉压(mean pulmonary arterial pressure, mPAP)、血浆内皮素-1 (endothelin-1, ET-1)和血清中介素(intermedin, IMD)水平变化,并对其进行持续气道正压(continuous positive airway pressure, CPAP)通气治疗,旨在探讨OSAHS患者PAH与血管内皮功能变化的关系及CPAP通气对其的干预作用。
资料与方法
一、一般资料
本研究为前瞻性对照研究,经医院伦理委员会批准,并取得患者的知情同意,符合医学伦理准则。选择2010年10月至2013年12月,我院门诊或住院,并经PSG监测确诊的高原地区(2260 m~3500 m)中重度OSAHS[睡眠呼吸暂停低通气指数(apnea-hypopnea index, AHI)>15次/h]合并PAH患者54例,男30例,女24例,年龄42~76岁,平均(55.2±6.6)岁。纳入标准:OSAHS诊断及分度符合中华医学会呼吸病学分会睡眠呼吸障碍学组制定的《阻塞性睡眠呼吸暂停低通气综合症诊治指南(2011年修订版)》标准[10]。排除标准:排除单纯鼾症、上气道阻力综合征、肥胖低通气综合征、发作性睡病、不宁腿综合征以及心、肺、脑、肝、肾等重要脏器的器质性病变。OSAHS患者在CPAP治疗前及治疗2个月后进行PSG、mPAP、血浆ET-1、血清IMD检测。
二、方法
1. PSG监测:从晚10时至次日晨7时,用多导睡眠监测仪(SW-SM200C)进行睡眠监测,全程记录心电图、脑电图、眼动图、下颌肌肌电图、口鼻气流、胸腹呼吸运动、血氧饱和度(SaO2)、鼾声、体动、体位、腿动等指标。记录分析AHI、睡眠平均血氧饱和度(sleep mean oxygen saturation, MSaO2)、睡眠SaO2<0.75占总睡眠时间百分比(percentage of duration of SaO2<0.75 during sleep, T75)、夜间基础与最低血氧饱和度之差(difference between basic and minimum SaO2during sleep, ΔSaO2)。
2. mPAP测定:采用彩色多普勒超声心动仪(康柏RT-6800型)测定肺动脉血流频谱的右室射血前期时间(RVPEP)与肺动脉血流加速时间(AT),RVPEP是指从心电图Q波起点到肺动脉收缩期血流频谱起点的时间,AT指从肺动脉收缩期血流频谱起点到达峰值速度的时间。mPAP(mmHg)=42.1(RVPEP/AT)-15.7[11]
3. 血浆ET-1和血清IMD测定:取清晨空腹静脉血4 ml,置于含10% 二乙胺四乙酸二钠(EDTA-Na2) 30 μl、抑肽酶30 μl的抗凝试管中,离心(4 ℃,离心半径15 cm,3000 r/min,离心10 min)后分离血浆和血清,置于-30 ℃冰箱内贮存待测。血浆ET-1和血清IMD采用放射免疫分析方法测定,IMD试剂盒由美国phoenix公司提供,ET-1试剂盒由北京东亚免疫技术研究所提供,操作严格按试剂盒说明书的步骤进行。
4. CPAP治疗:OSAHS患者采用无创通气呼吸机(BiPAP-Vision)进行夜间通气治疗,经面罩双水平正压通气,呼吸机参数设置:压力支持(PSV)+呼气末正压(PEEP)通气模式,PSV从6~8 cmH2O开始,每隔5 min增加2 cmH2O,PEEP从2 cmH2O开始,逐渐增加至患者可以接受的水平,PSV最高压力<18 cmH2O,PEEP最高压力<8 cmH2O。治疗时间从晚10点至次日晨7点。
三、统计学方法
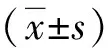
结 果
一、OSAHS患者治疗前mPAP、ET-1和IMD与各项指标的相关性分析
经直线相关分析,mPAP与血浆ET-1、血清IMD、AHI、T75、ΔSaO2呈显著正相关(分别r=0.677、0.729、0.782、0.696、0.706,均P<0.01),与MSaO2呈显著负相关(分别r=-0.716,P<0.01);血浆ET-1、血清IMD与AHI、T75、ΔSaO2呈显著正相关(分别r=0.801、0.663、0.598和0.618、0.770、0.699,均P<0.01),与MSaO2呈显著负相关(分别r=-0.672、-0.741,均P<0.01)。
二、OSAHS患者CPAP治疗前后睡眠监测指标的比较
与治疗前比较,治疗后AHI、T75、ΔSaO2水平显著降低,MSaO2水平显著升高(均P<0.01),见表1。
三、OSAHS患者CPAP治疗前后mPAP和肺血管活性因子指标的比较
与治疗前比较,治疗后mPAP、血浆ET-1、血清IMD水平均显著降低(均P<0.01),见表2。
讨 论
ET-1是由血管内皮细胞合成、释放的一种强烈的缩血管物质,是迄今已知的最强的血管收缩肽,参与诸多疾病的病理生理过程。ET-1在肺部可引起肺血管收缩及血管平滑肌细胞增殖,增加肺血管阻力,导致PAH。IMD是2004年由Roh等[12]研究发现的一种降钙素基因相关肽(caicitonin generelated peptide, CGRP)超家族的一员,又称肾上腺髓质素2。它能无选择性地作用于降钙素受体样受体(calcitonin receptor-like receptor, CRLR)/受体活性修饰蛋白(receptor activity-modifying protein, RAMP)复合物,通过受体复合物上G蛋白的异构激活下游的效应酶及离子通道,发挥生物学效应。IMD的作用十分广泛,对血管的作用主要是血管生成、扩张外周血管、降低血压等,且对缺血心肌、肺组织有保护作用[12]。Burak等[13]报道正常离体大鼠静脉注射IMD后未发现肺循环有明显的变化,但用U-46619制造肺动脉高压(PAH)模型后,静脉注射IMD后表现出剂量依赖性降低PAH,说明IMD能有效扩张肺血管,降低PAH。霍秀青等[14]报道大鼠经模拟低压氧舱处理,随着低氧时间的延长而肺动脉压(pulmonary arterial pressure, PAP)逐渐升高,与此同时低氧大鼠血浆的IMD浓度水平明显高于正常对照组大鼠,且随低氧时间的延长而逐渐升高,在低氧3周时其水平达最高,表明急慢性低氧可引起IMD合成及分泌增加,其水平的升高与低氧性PAH及肺血管重建有重要关系。Gong等[15]报道慢性低氧可引起大鼠PAH和右心室肥厚,血浆和右心室组织中IMD蛋白水平的表达均明显增加,同时右心室IMDmRNA表达也上调,这种上调的表达可以对抗PAH和减轻加重的右心室后负荷。新近对高原肺水肿(high altitude pulmonary edema, HAPE)患者的研究发现,其血清IMD及mPAP水平均显著升高,IMD与mPAP呈显著正相关,与PaO2呈显著负相关。低氧可促使舒血管细胞因子IMD的合成、分泌及增加释放,并参与HAPE发病的病理生理过程。IMD水平升高可能是机体对低氧的一种代偿性保护反应,它可能在肺血管张力调节中发挥重要作用[16]。

表1 OSAHS患者CPAP治疗前后睡眠监测指标的比较

表2 OSAHS患者CPAP治疗前后mPAP和肺血管活性因子指标的比较
OSAHS是指在睡眠期反复发生上气道阻塞并引起呼吸间歇性暂停和/或低通气,本病以睡眠时反复发作的上气道塌陷阻塞为特征,并伴有血氧饱和度降低。这种呼吸模式导致低氧-再氧合交替出现,CIH是其典型特征。CIH可导致PAH、慢性肺心病、右心衰竭,严重影响患者的预后[6-9]。本研究结果显示,高原地区中重度OSAHS患者mPAP与血浆ET-1、血清IMD、AHI、T75、ΔSaO2呈显著正相关,与MSaO2呈显著负相关;血浆ET-1、血清IMD与AHI、T75、ΔSaO2呈显著正相关,与MSaO2呈显著负相关。表明高原中重度OSAHS患者PAH的发生与肺血管内皮功能受损相关。其机制可能与夜间睡眠期间反复、频繁发生呼吸暂停和/或低通气,引起严重的低氧血症,后者促使缩血管因子ET-1和舒血管因子IMD合成、分泌、释放,使其在血液中含量升高有关。ET-1水平升高是导致其PAH的重要原因,而IMD虽然有升高,但不足以抵抗ET-1的缩血管作用,使舒/缩血管物质失衡,从而形成PAH。
我们对高原地区中重度OSAHS合并PAH患者采用CPAP治疗2个月后,结果治疗后与治疗前比较,mPAP、血浆ET-1、血清IMD、AHI、T75、ΔSaO2水平均显著降低,MSaO2水平显著升高。表明CPAP通气治疗能非常有效地改善睡眠呼吸紊乱、低氧血症和肺血管活性物质的失衡,达到降低PAH的作用。这可能是因为CPAP通气是在睡眠呼吸过程中通过正压给予上气道提供一定的压力支持,使上气道管内压提升到超过咽部或下咽部的跨壁压,使上气道扩张,阻止睡眠呼吸过程中上气道软组织塌陷、阻塞,有效解除呼吸暂停和低通气,从而纠正CIH及其引起的继发性低氧性PAH。因此,本研究提示CPAP可能是治疗高原地区OSAHS患者PAH的一种非常重要的措施。
参 考 文 献
1 Savransky V, Nanayakkara A, Li J, et al. Chronic interminttent hypoxia induces atherosclerosis[J]. Am J Respir Care Med, 2007, 175(12): 1290-1297.
2 Drager LF, Bortolotto LA, Lorenzi MC, et al. Early signs of atherosclerosis in obstructive sleep apnea[J]. Am J Respir Care Med, 2005, 172(5): 613-618.
3 Dursunoglu D, Dursunglu N. Cardiovascular disease in obstructive sleep apnea[J]. Tuberk Toraks, 2006, 54(4): 382-396.
4 冯恩志, 杨生岳, 闫自强, 等. 高原慢性肺心病合并阻塞性睡眠呼吸暂停低通气综合征患者血管内皮功能的变化及其与肺动脉高压的关系[J]. 临床肺科杂志, 2011, 16(10): 1504-1506.
5 杨生岳, 冯恩志, 闫自强, 等. 高原地区慢性阻塞性肺疾病合并阻塞性睡眠呼吸暂停低通气综合征患者的随访结果分析[J/CD]. 中华肺部疾病杂志: 电子版, 2012, 5(1): 4-10.
6 王 勇, 马晓蓉, 潘 磊. 阻塞性睡眠呼吸暂停综合征与肺动脉高压[J]. 中华老年多器官疾病杂志, 2010, 9(3): 206-208.
7 Lee R, McNicholas WT. Obstructive sleep apnea in chronic obstructive pulmonary disease[J]. Curr Opin Pulm Med, 2011, 17(2): 79-83.
8 雷祖宝, 吕 志. CPAP对中重度OSAS合并右心衰竭的疗效观察[J]. 临床肺科杂志, 2013, 18(11):2015-2016.
9 杨生岳, 罗晓红, 冯恩志, 等. 高原地区慢性肺心病急性加重期并阻塞性睡眠呼吸暂停低通气综合症患者的预后危险因素[J]. 中国危重病急救医学, 2010, 22(5): 271-274.
10 中华医学会呼吸病学分会睡眠呼吸障碍学组. 阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J]. 中华结核和呼吸杂志, 2012, 35(1): 9-12.
11 唐兰珍, 张尔永, 安 琪, 等. 二维多普勒超声检测肺动脉压的价值与手术直测对照[J]. 中国胸心血管外科杂志, 1996, 3(1): 9-11.
12 Roh J, Chang CL, Bhalla A, et al. Intermedlin is a calcitonin/calcitonin gene-related peptide family peptide acting through the calcitonin receptor-like receptor/receptor-modifying protein receptor complexes[J]. J Biol Chem, 2004, 279(8): 7264-7274.
13 Burak kandilci H, Gumusel B, Wasserman A, et al. Intermedin/adrenomedulin-2 dilates the rat pulmonary vascular bed:dependence on CGRP receptor and nitric oxide release[J]. Peptides, 2006, 27(6): 1390-1396.
14 霍秀青, 于忠和, 王 萍. 低氧对肺动脉高压大鼠中介素合成和分泌的影响[J]. 中国全科医学, 2009, 12(5B):850-852.
15 Gong YS, Fen XF, Wu XM, et al. Chenges of intermedin/adrenomedulin-2 and its receptors in the right ventricle of rat with chronic hypoxic pulmonary hypertension[J]. Sheng Li Xur Bao, 2007, 59(2): 210-214.
16 杨生岳, 冯恩志, 闫自强, 等. 高原肺水肿患者肺血管活性因子水平变化及其与肺动脉高压的关系[J/CD]. 中华肺部疾病杂志: 电子版, 2011, 4(1): 26-29.

