急进高原大鼠肺泡Ⅱ型细胞肺水转运功能与肺损伤的关系
吴 岳 王海燕 张 伟 赵海龙 董红梅 王 静
肺泡Ⅱ型细胞(ATⅡ)占肺泡上皮的60%,对肺泡正常结构和功能的维持具有非常重要的作用。已有研究提示,ATⅡ是肺泡上皮细胞的祖细胞,也是肺泡上皮的干细胞[1]。在细胞的更新及损伤的修复过程中,ATⅡ既可以分化成Ⅰ型细胞,还可通过进行有丝分裂来补充自身数量。相关研究表明,ATⅡ细胞上存在钠水通道,它与肺泡内液体的产生和清除关系密切,在肺水的清除中起着维持细胞内外液体平衡的作用[2]。但ATⅡ与高原低氧肺损伤关系的研究少见。为此,我们观察了急进高原不同时间大鼠肺脏的细胞学形态和超微结构变化,并测定了肺泡液体清除率(alveolar liquid clearance, ALC),旨在探讨ATⅡ肺水转运功能与高原肺损伤的关系。
材料与方法
一、实验材料
从西安(海拔400 m)购买Wistar雄性大鼠60只,体重210~230 g,随机分为4组,每组15只。对照组(T0组)在平原(海拔400 m)进行实验检测,另外3组在10 h内快速运送到海拔4300 m的青海省玛多县,分别于急进高原24 h(T1组)、72 h(T2组)、168 h(T3组)进行实验。
二、研究方法
1. 气管插管和颈动脉插管:检测前1 h用3%戊巴比妥钠(150 mg/kg)腹腔内注射麻醉。麻醉后进行气管切开插管,采用小动物呼吸机(Model 683)行呼吸末正压通气(PEEP为2.20 mmHg),吸氧浓度1.0,呼吸频率60次/min,潮气量10 ml/ka,气道压低于11.0 mmHg。右侧颈动脉行PE50导管插管,用血流动力学检测仪(CARDIOMAX-Ⅱ)监测血压。术后静置1 h,并且把心率维持在300次/min以下。
2.灌注液的配置:按文献方法配置5%小牛血清、乳酸钠林格氏液加伊文思蓝(1 g/L)和I125-白蛋白灌注液[3]。移去呼吸机接头,用5 ml注射器将灌注液10 ml/kg[每只鼠按74kBq(1Ci=3.7×107kBq)]和0.5 ml空气注入大鼠肺内,连接呼吸机,继续通气。灌注前及灌注后10、30、60 min分别记录大鼠心率、血压,并经颈动脉插管抽取动脉血行血气分析。
3. ALC计算:1 h后放血活杀大鼠,取出完整肺。将干燥PE50导管(becton dickinson, US)通过气管插至肺边缘部位,然后吸出肺泡内液体,盛于已经称重过的200 μl离心管内(1/1000 g精密天平),再次称量离心管重量,两者之差即为吸出液体量(Mf)。用R计数仪(SN682型,上海)读取1 min r计数(G),按公式计算每毫克放射量(Cf)。再取约100 μl灌注液原液,同样方法测量原液的Gi和Mi,并计算Ci和ALC。利用下列公式计算ALCCi=Gi/Mi;Cf=Gf/Mf;ALC(%)=(1-Ci/Cf)×100%。
4. 光镜和电镜观察:各组大鼠活体解剖,观察肺组织大体形态学变化。取一侧肺,用10%甲醛缓冲液固定,然后石碏包埋和切片,用苏木精-伊红(hematoxylin and eosin, HE)染色。Olympus光学显微镜下观察肺组织形态学变化。部分肺组织标本用4%戊二醛及1%锇酸混合液固定后,分别进行梯度乙醇脱水,经环氧树脂包埋并行超薄切片后,在电镜下观察肺组织超微结构变化。
三、统计学方法
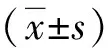
结 果
一、各组大鼠ALC比较
T1组、T2组大鼠ALC(分别为22.60±3.41%、25.28±6.30%)较T0组大鼠(41.14±9.36%)显著降低(均P<0.05),T3组(45.52±10.05%)与T0组比较无统计学意义(P>0.05)。
二、光镜观察
光镜下见T1、T2组大鼠肺组织炎症反应明显,肺泡壁毛细血管充血水肿,肺泡腔内有液体和较多炎细胞聚集。肺组织中偶见有单个散在分布的凋亡细胞,周围无炎性细胞浸润。肺泡Ⅱ型上皮细胞体积较小,呈立方形,细胞核较大呈圆形,核染色质致密浓缩,整个细胞核呈蓝黑色,镜下见部分组织出现坏死,细胞呈现核碎裂,胞浆呈淡红色。T0组及T3组大鼠肺脏病变相对较轻。
三、电镜观察
T1组、T2组大鼠肺脏大多数细胞的胞膜微绒毛减少或消失,部分Ⅱ型肺泡上皮细胞体积缩小、变圆。有些细胞胞浆嗜俄性板层小体数量减少,排空增加;细胞核呈现多形性,并见有假包涵体形成;可见染色质聚集、靠近核膜和核被膜内陷或外折等征象,见图1、图2。T0组及T3组大鼠肺超微结构变化轻于T1及T2组。
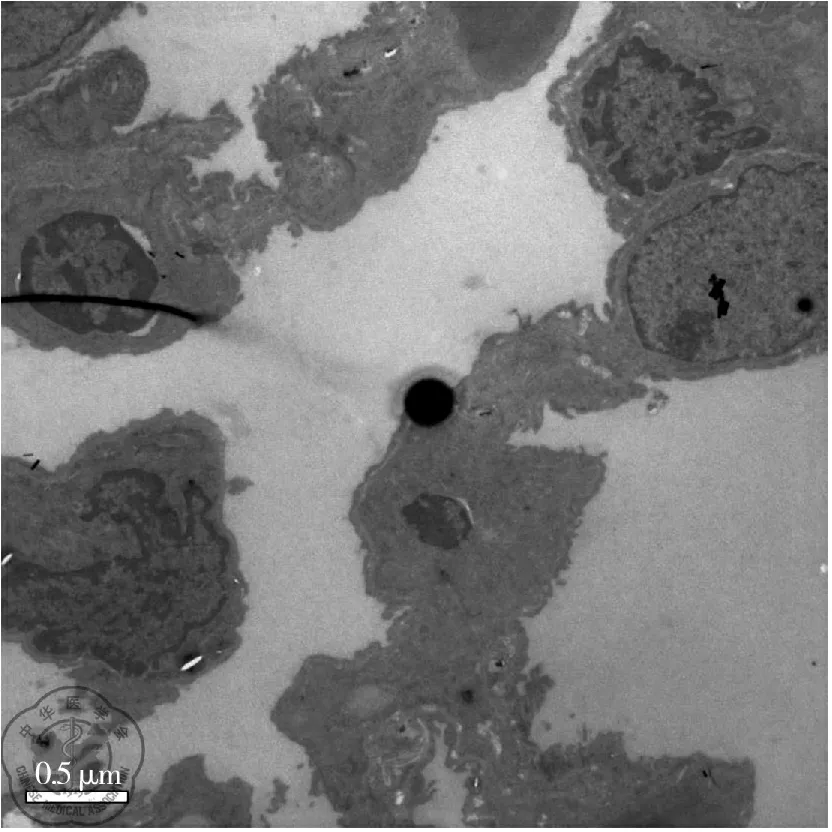
图1 肺泡Ⅱ型上皮细胞核染色质固缩
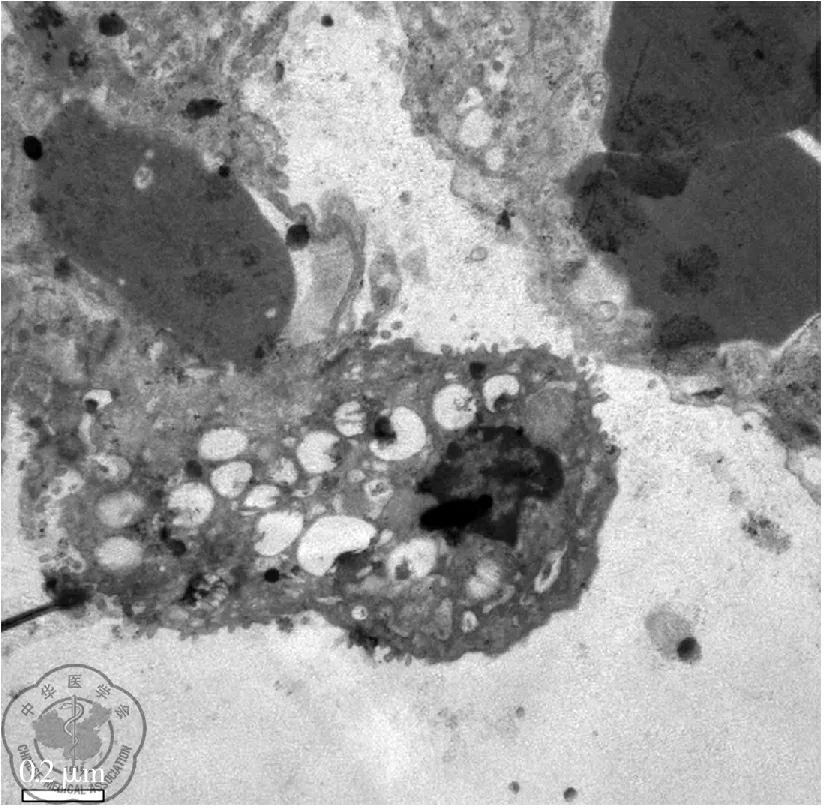
图2 左下方为肺泡Ⅱ型上皮细胞,胞质有大量已经排空的板层小体,核染色质浓缩,固缩
讨 论
ATⅡ细胞具有跨模主动运转功能和分泌生物活性物质的能力,在肺上皮更新以及组织损伤修复过程中起着干细胞的作用[1]。同时,ATⅡ细胞又因为其在不同的生理条件下能表达主要组织相容性复合物Ⅱ类分子,炎症介质和分泌细胞因子参与炎症反应,而被看作是重要的免疫调节细胞之一,具有调节免疫以及防御的作用。
近年对ATⅡ功能的深入了解使人们对急性肺水肿形成机制有了新的认识。既往研究有资料表明肺泡两侧压力差可能是导致急性肺水肿的直接原因。近期有学者发现,肺泡Ⅱ型上皮细胞具有很强的液体转运能力,对维持肺泡内液体的平衡有着一定的作用 。Folkesson等[4]曾对博来霉素引起大鼠亚急性肺损伤的肺水转运功能做了连续的观察,通过检测I125标记的白蛋白变化量来推算肺泡液体通透性的改变,随后计算ALC。发现肺损伤后1 h, ALC下降110%,4 h后ALC下降75%,60 d后方恢复正常。并且发现肺泡上皮对蛋白的通透性呈现显著增加。但肺泡Ⅱ型上皮细胞上钠离子通道数量减少了52%,说明肺泡液体通过单个细胞转运能力下降。基于以上实验,研究者认为肺泡Ⅱ型上皮细胞数量的增加可能是肺水清除率增加的主要原因[4]。
急性肺损伤后的ATⅡ的变化比较复杂。肺泡表面活性物质的合成及分泌功能发生损伤,肺泡内液体转运能力不足或者肺表面活性物质灭活增加,均可以引起肺泡内外液体失衡,从而引起急性肺损伤。ATⅡ数量的增加和细胞的分化不仅可以修复损伤肺泡的结构,还能有效地促进其功能恢复,进而可能阻止肺损伤的发展。有实验表明生长因子可以部分促进ATⅡ的增殖,可能为急性肺损伤的治疗提供理论依据。本实验结果提示急进高原大鼠24 h、72 h后ALC明显下降,究其原因,可能与下列原因有关:①急进高原大鼠受到高原环境包括低氧、高寒的强烈刺激,引起ATⅡ凋亡,导致ATⅡ的数量明显减少,肺水清除率明显下降,大量的液体积聚在肺泡腔内,从而引发肺损伤;②急进高原大鼠ATⅡ发生凋亡,呈现细胞膜上的多数微绒毛减少或消失,而且线粒体出现明显肿胀[5],板层小体的数量出现了减少、排空增加,形成了假包涵体,同时可见核染色质浓缩。这些变化可能影响了气血屏障和呼吸膜的完整性,从而导致肺损伤。
ATⅡ除了合成和释放表面活性物质外,膜上还存在着不同的离子通道如钙离子通道、阿米洛利敏感的钠通道(ENaC)、氯通道(CFTR)、钾通道和Na+-K+-ATP酶、布美他尼敏感的Na+-K+-Cl-共同转运体等,这些通道共同完成肺泡上皮离子的转运过程。在这些通道蛋白的研究中,水通道蛋白(aquaporins, AQPs)的研究明显受到重视,但针对ATⅡ水通道蛋白的研究报道较少[6-7]。种种迹象表明AQPs的变化可能影响肺组织的功能[8-9]。本研究结果提示,急进高原大鼠24 h、72 h ALC明显下降,可能与钠水通道的改变有关。至于是哪种水通道蛋白在高原肺损伤的发生机制中起作用以及具体机制尚有待进一步研究。
本实验显示,急进高原168 h大鼠(T3组)ALC恢复到平原大鼠(T0组)的水平,可能与ATⅡ的增殖和修复有关,其具体机制尚不清楚。应用某些促进ATⅡ增殖和修复的生长因子,可能对高原肺损伤的治疗有益。
参 考 文 献
1 Barkauskas CE, Cronce MJ, Rackley CR, et al. Type 2 alveolar cells are stem cells in adult lung[J]. J Clin Invest, 2013, 123(7): 3025-3036.
2 吴松林, 毛 璞, 莫红缨, 等. 人Ⅱ型肺泡上皮细胞的分离培养与表型维持研究[J]. 中国危重急救医学, 2012, 24(7): 388-389.
3 Wang Y, Folkesson HG, Jayr C, et al. Alveolar epithelial fluid transport can be simultaneously upregulated by both KGF and beta-agonist therapy[J]. J Appl Physiol, 1999, 87(5): 1852-1860.
4 Folkesson HG, Nitenberg G, Oliver BL, et al. Upregulation of alveolar epithelial fluid transport after subacute lung injury in rats from bleomycin[J]. Am J Physiol, 1998, 275(3 Pt 1): L478-490.
5 吴 岳, 赵海龙, 王海燕, 等. 肺泡Ⅱ型细胞凋亡在急进高原大鼠早期肺损伤中的作用[J]. 青海医学院学报, 2013, 34(4): 233-236.
6 何 琳, 李涛平. 肺泡Ⅱ型上皮细胞钠通道在肺水清除中信号转导的研究进展[J]. 国外呼吸杂志, 2007, 27(12): 919-921.
7 吴 岳, 赵海龙, 马祁生, 等. ATⅡ细胞在急性高原肺水肿中的作用及意义[J]. 青海医学院学报, 2008, 29(3): 200-201.
8 Ozu M, Dorr RA, Gutiérreaz F, et al. Human AQP1 is a constitutively open channel that closes by a membrane-tension-mediated mechanism[J]. Biophysical journal, 2013, 104(1): 85-95.
9 Almeida C, Nagarajan D, Tian J, et al. The role of alveolar epithelium in radiation-induced lung injury[J]. PloS One, 2013, 8(1): e53628.

