肺癌临床随机对照试验文献的质量评价
黄春基 沈渝菊 林 海 周建云 尹芃芃 周逸兴 任 然 许汝福
为了提高临床随机对照试验(randomized controlled trials, RCT)的报告质量,CONSORT小组于1996年出台了第一版CONSORT(Consolidated Standard of Reporting Trials)声明,2001年和2010年相继进行了修订[1-2],国内期刊也对CONSORT声明做了相关报道[3-4],对规范临床随机对照试验报告起到了很好的作用,规范的临床试验已成为制定各种疾病诊疗指南的主要依据[5]。但许多作者对CONSORT声明不甚了解,未按CONSORT声明报告临床随机对照试验。本研究按照CONSORT声明的要求,对2013年1~3月份国内部分肺癌治疗的随机对照试验论文进行评价,以期引起广大作者的重视,提高临床随机对照试验报告的质量。
资料与方法
一、 文献筛选
纳入标准:①肺癌治疗性文献;②随机对照试验。
排除标准:①非肺癌治疗性文献;②肺癌非治疗性文献;③个案报道、经验总结、综述、实验研究文献;④非随机对照试验的临床研究文献等。
文献检索:以肺癌、随机、对照为主题词,于2013年4月检索由清华同方光盘股份有限公司出版发行的中国期刊全文数据库2013年1~3月的临床研究论文。
二、 评价内容
参考CONSORT声明的25个条目,自制的肺癌临床随机对照试验论文质量评价表,内容包括文献编号、第一作者、文献标题、发表期刊、是否统计源期刊等文献基本信息,以及标题是否提示随机试验、是否描述随机对照试验设计、研究对象是否报告病理诊断等确诊、是否报告纳入标准、是否报告排除标准、是否与患者签署知情同意书、研究方案是否经所在单位或上级单位医学伦理委员会审查批准、试验组与对照组的干预措施描述是否详实、是否报告样本含量估计方法、是否报告随机分组方法、是否报告各组基线人口统计学资料与临床特征、是否描述进行意向处理分析、是否报告数据统计分析方法,以及试验组和对照组的样本量等。
三、 数据整理
将入选文献全文打印,编号,装订;按照评价表的顺序,利用Excel建立数据库,进行数据录入,并在打印的文献上做出标记;由未参与数据录入的研究者,依据打印的文献对录入的数据进行核对,对不一致的数据由第三者进行核实。
四、 统计学方法
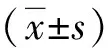
结 果
按照文献纳入标准和排除标准,经检索纳入文献81篇。对照CONSORT声明的要求,81篇文献的评价结果如下。
1.研究设计:描述随机对照试验设计的文献7篇(8.6%);标题显示随机试验的文献2篇(2.5%)、临床研究的文献10篇(12.3%)、疗效观察等的文献69篇(85.2%)。2篇文献研究背景部分描述为回顾性研究,与方法部分描述不一致。
2.研究对象:肺癌患者采用病理诊断等确诊的文献69篇(85.2%),报告有研究对象纳入标准和排除标准的文献分别为72篇(88.9%)和31篇(38.3%);报告与患者签署知情同意书的文献19篇(23.5%),报告研究方案应经所在单位或上级单位医学伦理委员会审查批准的文献2篇(2.5%)。
3.样本含量:81篇文献均未报告样本量的估计方法(报告率为0%)。试验组样本量最小的11例,最大的124例,小于40例的文献42篇,占51.85%,大于60例的文献11篇,占13.58%;对照组样本量最小的10例,最大的90例,样本量小于40例的文献42篇,占51.85%,大于60例的文献10篇,占12.35%。
4.随机分组:81篇文献都描述了随机分组人数,描述使用随机数字分组的文献15篇(18.52%),仅述及“随机分组”、未做任何随机分组描述的文献66篇(81.48%)。
5.干预措施:试验组干预措施描述详实的文献81篇(100.00%)、对照组干预措施描述详实的文献75篇(92.59%)。
6.基线资料:报告了两组人口学基线资料的文献61篇(75.3%)、临床特征基线资料的52篇(64.2%);报告两组人口学资料具有可比性的文献74篇(91.4%)、临床特征具有可比性的67篇(82.7%),但有13篇(16.0%)未报告两组人口学基线资料、15篇(18.5%)未报告两组临床特征基线资料。
7.统计分析:报告按资料类型(计数资料、计量资料)进行统计学分析的文献76篇(93.8%),具体描述各结局指标统计学分析方法的文献5篇(6.2%)。采用主要结局指标的文献55篇(67.9%)。77篇(95.1%)文献报告的设计分组例数与结局分析例数一致,有4篇文献报告了剔除病例,2篇(2.5%)文献描述进行意向处理分析(ITT分析),2篇(2.5%)文献描述按符合方案集分析(PP分析)。
8.统计源论文与非统计源论文比较:按《2013年版中国科技期刊引证报告(核心板)》[6],将纳入文献分为统计源期刊(45篇)和非统计源期刊(36篇)。除人口学资料描述与临床特征描述外,统计源论文与非统计源论文CONSORT声明要求内容符合情况比较无显著差异(P>0.05),见表1。

表1 统计源与非统计源论文CONSORT声明要求内容符合情况
讨 论
一、研究对象知情同意与研究方案伦理审查不够规范
临床随机对照试验应该有严格的病例纳入标准和排除标准,以保证研究对象的同质性。本次研究纳入的81篇文献中,88.9%的文献报告研究对象的纳入标准,高于文献[7]的研究(82.04%)和文献[8]的研究(52.6%),38.3%的文献报告排除标准。按照医学伦理学要求,临床试验必须遵循自主、有利、不伤害、公平的原则,其研究方案应经所在单位或上级单位医学伦理委员会审查批准;按照知情同意的原则,应告知患者研究背景与研究目的,预期可能的益处与风险等,征得患者的同意,签署知情同意书[9]。23.5%的文献与患者签署知情同意书,2.5%的文献报告研究方案经单位医学伦理委员会审查批准。多项研究发现临床试验存在研究对象的纳入标准与排除标准不够规范、有纳入标准无排除标准、知情同意执行不够规范、代签知情同意书、对受试者的经济补偿不到位等问题[10-12]。
二、未报告样本含量的估计方法
样本含量估算是在保证科研结论具有一定可靠性的条件下,根据科学合理的假设确定最小观察例数[13]。CONSORT声明要求明确样本量是如何确定的。本次调查的81篇文献,均未报告样本量是如何确定的,与文献[7]的研究(0.29%)、文献[8]的研究(0%)、文献[14]的研究(0%)基本一致,可能与作者不够重视、期刊未作要求有一定关系。本次调查,51.85%的文献样本量小于40例,试验组和对照组最小样本量分别为11例和10例。由于样本量较小,可能出现假阴性错误,检验效能低[7,13]。如文献[15],每组16例,观察组有效率81.3%,对照组有效率43.8%,经Fisher精确概率法检验,两组间有效率差异无显著意义(P=0.066)。如果两组有效率不变,样本量由16例增加到32例,则两组间有效率差异有显著意义(P=0.004)。因此,应根据文献或预实验的结果,估计临床研究各组的样本含量。
三、描述随机分组不够规范
临床试验研究中,随机分组可使受试者有均等的机会被分配到实验组和对照组,使各处理组间的各种影响因素分布趋于相似,是控制混杂偏倚和选择偏倚的重要方法[16]。本研究显示,81篇文献都描述了随机分组人数,只有18.52%的文献简要描述使用随机数字、抽签等分组方法,与文献[8]的研究(18.4%)一致,高于文献[7]的研究(14.37%)和文献[14]的研究(6.9%)。81.48%的文献仅述及“随机分组”、未做任何随机分组描述,有的文献的随机分组是假随机,如“根据患者意愿和临床肿瘤淋巴结转移(tumor node metastasis, TNM)分期随机分成对照组和观察组”等,有2篇文献研究背景部分描述为回顾性研究,方法部分也冠以随机分组。
四、报告基线人口学资料和临床特征可比性统计量的比例较低
CONSORT声明要求用表格显示各组基线人口统计学资料和临床特征[1-4]。表格-格式化表达随机平行对照试验人口学资料及临床特征,可方便一线实施人员,实现公式化、格式化、流程化操作与表达,方便杂志审查核对与编辑,方便读者阅读理解核对文献信息[17]。本研究显示,75.3%和64.2%的文献报告了两组人口学基线资料和临床特征基线资料,高于文献[7]的研究(1.87%),但限于文章篇幅,大多数文献未使用表格形式。对组间临床基线特征的可比性分析是评价组间均衡的重要方法,91.4%和82.7%的文献报告两组人口学资料和临床特征具有可比性,但给出两组基线资料比较统计量的文献不足10%,且有2篇文献将两组基线资料无显著性差异(P>0.05)描述为两组基线资料差异显著(P<0.05)。如果纳入两组的研究对象基线资料不均衡(没有可比性),可能使研究结果系统地偏离真实情况(偏倚),得出假阳性或假阴性结论[9]。
五、提及采用意向处理分析的比例较低
CONSORT声明要求描述每组被随机分配、接受预期处理和分析主要结局的人数,描述各组随机化后退组和剔除的人数及原因,以及分析是否是在原先设计的组之间进行(意向处理分析——ITT分析)[1-4]。本次调查中,95.1%的文献报告的设计分组例数与结局分析例数一致,但仅有2.5%的文献提及采用ITT分析,略高于文献[7]的0.29%。93.8%的文献报告按资料类型(计数资料、计量资料)进行统计学分析,而具体描述各结局指标统计学分析方法的文献只有6.2%。
统计源论文与非统计源论文比较,除人口学资料描述与临床特征描述外,CONSORT声明要求内容符合情况比较无显著差异(P>0.05)。
本研究表明,国内肺癌治疗随机对照试验文献的质量是较低的,尤其是试验设计、随机分组、知情同意、伦理审查、样本含量估计方法等方面需要进一步提高质量。
本研究分析了81篇纳入文献存在的主要问题,希望引起临床研究者和编辑的重视,在今后的临床试验设计和研究实施中,能够应用和遵循CONSORT声明,提高临床随机对照试验的报告质量。
参 考 文 献
1 Schulz KF, Altman DG, Moher D, et al. CONSORT 2010 Statement:updated guidelines for reporting parallel group randomised trials[J]. BMJ, 2010, 340: c332.
2 Moher D, Hopewell S, Schulz KF, et al. CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials[J]. BMJ, 2010, 340: c869.
3 汪谋岳. 2010年新版CONSORT声明简介[J]. 中国科技期刊研究, 2011, 22(2): 309-310.
4 刘玉秀, 成 琪,刘丽霞. 2010版CONSORT声明:平行组随机试验报告的新指南[J]. 中国临床药理学与治疗学, 2010, 15(10): 1189-1194.
5 Reindollar RH, Regan MM, Neumann PJ, et al. A randomized clinical trial to evaluate optimal treatment for unexplained infertility: the fast track and standard treatment (FASTT) trial [J]. Fertil Steril, 2010, 94(3): 888-899.
6 中国科学技术信息研究所. 2013年版中国科技期刊引证报告(核心板)[M]. 北京:科学技术文献出版社, 2013: 168-249.
7 袁 欣, 胡 丹, 廖联明. CNKI数据库中肿瘤治疗的临床随机对照试验文献评价[J]. 肿瘤学杂志, 2013, 19(8): 639-643.
8 王菊勇, 董昌盛, 许 玲, 等. 中药治疗癌痛临床随机对照试验文献的质量评价[J]. 上海中医药大学学报, 2011, 25(5): 34-40.
9 熊鸿燕, 易 东. 医学科研方法——设计、测量与评价 [M]. 第二版, 重庆:西南师范大学出版社, 2009: 18-19, 26-34.
10 沈玉红, 高 卫, 黄建英, 等. 药物临床试验中存在的主要问题[J]. 中国医院药学杂志, 2012, 32(24):2011-2013.
11 颜江瑛, 何继善, 张阳德. 我国药物临床试验中伦理审查存在的问题与对策[J]. 中国药事, 2012, 26(4): 346-349.
12 姚战鹏, 王婧雯, 金 鑫, 等. 我国药物临床试验中的伦理问题与对策[J]. 中国药房,2012, 23(21): 1931-1933.
13 易东主编. 军事医学统计学[M]. 北京:军事医学科学出版社, 2009: 115-117.
14 姚魁武, 张良登, 王 阶, 等. 近5年部分核心期刊中医药治疗冠心病心绞痛随机对照试验的质量评价[J]. 北京中医药,2011, 30(3): 171-175.
15 蒲德利, 廖江荣. 射频消融联合化疗治疗周围型中晚期非小细胞肺癌疗效观察[J]. 介入放射学杂志, 2013, 22(2): 129-132.
16 李雪迎. 临床试验研究中的随机化方法[J]. 中国介入心脏病学杂志, 2012, 20(3): 136.
17 原 源, 周庆平. 表格-格式化表达随机平行对照临床报告人口学资料及临床特征[J]. 实用中医内科杂志, 2012, 62(2): 25-27.

