红腺忍冬叶抗氧化有效部位多糖的含量变化研究*
★ 施思 郭鑫 朱英
(浙江中医药大学药学院 浙江 杭州 310053)
红腺忍冬LonicerahypoglaucaMiq.为忍冬科忍冬属藤本类植物,又名菰腺忍冬、盘腺忍冬、腺背金银花等[1],为中药山银花的植物来源之一,具有清热解毒、疏散风热之效。药典规定其药用部位为干燥花蕾或带初开的花[2],但因红腺忍冬花期较短、采收时间有限,致使资源相对紧缺。而作为副产品的叶子,虽产量较高,但因为非药用部位而遭弃用。红腺忍冬分布广泛,浙江为其主产区之一[3,4],植物原料资源丰富。故研究开发红腺忍冬叶的有效成分及药用价值有利于有效利用地方植物资源,具有深远的现实意义。本实验室前期已对浙江产红腺忍冬叶的药理作用进行了初步研究[5],结果表明红腺忍冬叶水提液具有较优的抗氧化作用。进一步研究发现,红腺忍冬叶水提液的30%乙醇沉淀物及滤液也具有抗氧化作用,且30%乙醇沉淀物的抗氧化效果强于其它分级醇沉所得的沉淀物和滤液。有报道表明植物多糖及其复合物具有良好的抗氧化作用[6-8],参照相关文献[9,10]拟建立红腺忍冬叶提取液中多糖含量测定方法,并对红腺忍冬叶抗氧化有效部位(水提液、水提液的30%乙醇沉淀物及其滤液)中的多糖含量进行测定和比较,为确定红腺忍冬叶抗氧化有效成分提供帮助。
1 仪器与试药
1.1 仪器 UV-2800H型可见-紫外分光光度计(尤尼柯(上海)仪器有限公司);METTLER AL104电子天平(梅特勒-托利多仪器有限公司);HH-S型恒温水浴锅(巩义市英峪予华仪器厂);CD-100L华迪超声热风干燥箱(浙江省新昌暖通设备厂);SHZ-D(III)循环水式真空泵(巩义市予华仪器有限责任公司);TG16-WS台式高速离心机(湖南湘仪实验室仪器开发有限公司);0.5~10μL和10~100μL型移液器(大龙兴创实验仪器(北京)有限公司)。
1.2 试药 红腺忍冬叶S1-S15批,2011年~2013年采集于浙江省,经浙江中医药大学药用植物教研室陈锡林副教授鉴定为忍冬科植物红腺忍冬LonicerahypoglaucaMiq.的叶子;D-无水葡萄糖对照品(中国食品药品鉴定研究院,批号:110833-201205);其他试剂均为分析纯;水为蒸馏水。
2 方法与结果
2.1 葡萄糖对照品溶液的制备 精密称取105℃干燥至恒重的葡萄糖对照品适量,加蒸馏水溶解并定容,得浓度为1.0mg/mL和0.1mg/mL的葡萄糖对照品溶液,放入冰箱保存备用。
2.2 供试品溶液的制备 精密称取50~60℃干燥至恒重的药材10g,石油醚脱脂2次,每次24h,弃去石油醚,将药材挥至无石油醚味,加12倍量蒸馏水,煎煮2次,每次微沸1h(保持水位),趁热过滤,合并滤液,浓缩至100mL。将所得水提浓缩液平均分成两等份。一份作为红腺忍冬叶水提液供试品(No.1)供含量测定用,一份用于30%乙醇沉淀。
将用于醇沉的水提浓缩液,加无水乙醇适量至溶液含醇度为30%。加醇时应不断用玻璃棒搅拌,以避免局部醇浓度过高。静置过夜,3000r/min离心10min,分离滤液和沉淀,得30%乙醇直接沉淀物和滤液。滤液回收溶剂,得浸膏;沉淀低温干燥。将滤液浸膏和干燥沉淀分别置于50mL容量瓶中,加蒸馏水溶解并定容至刻度,摇匀,得30%乙醇沉淀后滤液供试品溶液(No.2)和沉淀供试品溶液(No.3)。
No.1、No.2、No.3均相当于药材浓度为0.1g/mL。
2.3 5%苯酚溶液的配制 精密称取苯酚100g,加0.10g铝片和碳酸氢钠0.05g,蒸馏,收集182℃馏分。称取该馏分5.0g,置于100mL容量瓶中,加蒸馏水溶解并定容至刻度,摇匀,得5%苯酚溶液,移至棕色试剂瓶,备用。
2.4 DNS试剂的配制 将3,5-二硝基水杨酸(DNS)6.3g和2mol/L氢氧化钠262mL,加到500mL含有182g酒石酸钾钠的热水溶液中,再加入5g重苯酚和5g亚硫酸钠,搅拌溶解,冷却后转置1 L容量瓶中,加蒸馏水定容至刻度,摇匀,得DNS试剂,移至棕色试剂瓶中放置1周后使用。
2.5 测定波长的选择
2.5.1 总糖测定波长的选择 按总糖测定标准曲线项下,对葡萄糖对照品溶液与供试品溶液分别进行显色,并在400~600nm范围内扫描,结果如图1。由图可知苯酚-浓硫酸显色试剂本身对显色体系的影响很小,可忽略,故选择485nm处为总糖最佳测定波长。

图1 总糖显色扫描图谱示意图
2.5.2 还原糖测定波长的选择 按还原糖测定标准曲线项下,对葡萄糖对照品溶液与供试品溶液分别进行显色,并在400~600nm范围内扫描,结果如图2。由图可知,DNS试剂本身即有较强的吸收,且因在显色过程中DNS试剂的消耗量不定导致其对显色体系的干扰无法明确判定。综合考虑并参考相关文献[11]后选择550nm为还原糖最佳测定波长较以消除DNS试剂的干扰。

图2 还原糖显色扫描图谱示意图
2.6 显色条件的优化 分别对苯酚-硫酸显色法、DNS显色法显色相关因素进行单因素考察,以确定较优显色条件。结果如图3、4所示,综合考虑得,苯酚-硫酸显色法较优显色条件应为:5%苯酚用量为1mL、浓硫酸用量为7mL、显色温度为100℃、显色时间为10min;DNS显色法较优显色条件应为:DNS试剂用量为1.5mL、显色温度为100℃、显色时间为10min。
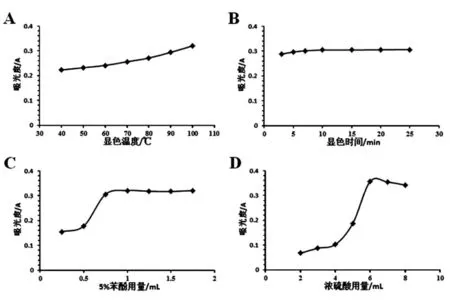
图3 苯酚-硫酸显色法显色考察
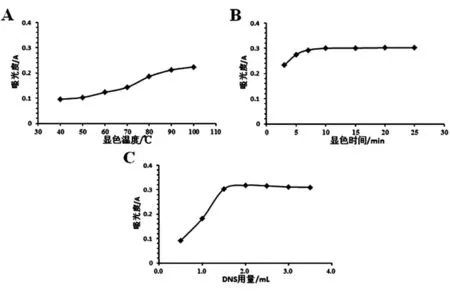
图4 DNS显色法显色考察
2.7 标准曲线的绘制
2.7.1 总糖测定标准曲线 精密吸取0.1mg/mL葡萄糖对照品溶液0.2,0.4,0.6,0.8,1.0,1.2,1.4mL,分别置于7支干燥的10mL容量瓶中,加蒸馏水至2mL,混匀,加1.0mL 5%苯酚溶液,摇匀,迅速加入7mL浓硫酸,置沸水中水浴10min,以流水冷却至室温,以空白管为对照,测定485nm波长处的吸光度。以葡萄糖显色浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。得回归方程为A=58.857C-0.0054(r=0.9997),葡萄糖浓度为0.002~0.014mg/mL时显色线性关系良好。
2.7.2 还原糖测定标准曲线 精密吸取1.0mg/mL葡萄糖对照品溶液0.2,0.4,0.6,0.8,1.0,1.2,1.4mL,分别置于7支干燥的10mL容量瓶中,加1.5mL DNS试剂,加蒸馏水定容至刻度,摇匀后置沸水中浴10min,以流水冷却至室温,以空白管为对照,测定550nm波长处的吸光度。以葡萄糖显色浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。得回归方程为A=5.371C-0.0524(r=0.9996),葡萄糖浓度为0.02~0.14mg/mL时显色线性关系良好。
2.8 方法学考察
2.8.1 精密度考察 精密吸取S9批药材水提液供试品溶液(No.1)0.01mL,按2.7.1项下操作显色,连续测定6次,得总糖测定的精密度RSD为0.13%。精密吸取S9批水提液供试品溶液(No.1)0.5mL,按2.7.2项下操作显色,连续测定6次,得还原糖测定的精密度RSD为0.07%。
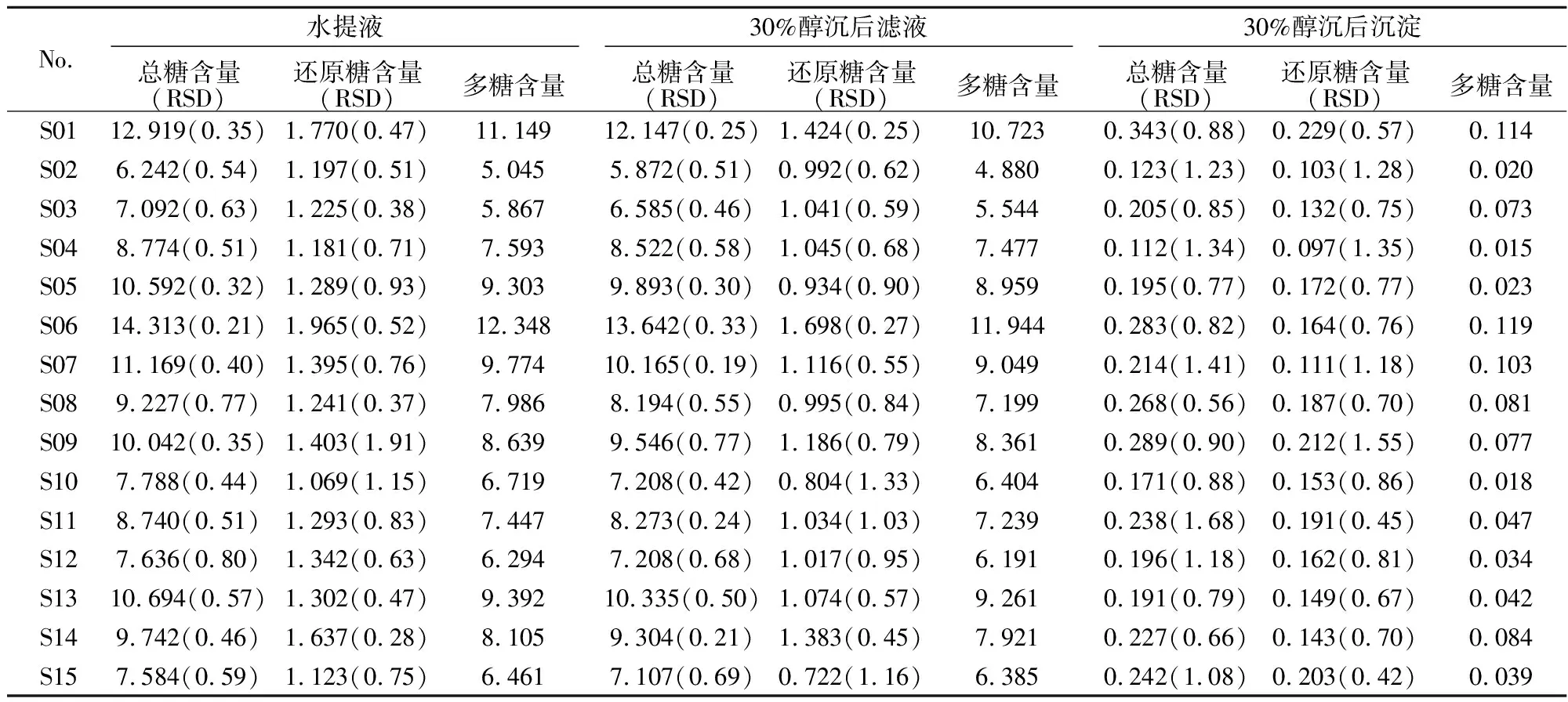
表1 不同批次红腺忍冬叶抗氧化有效部位中总糖、还原糖及多糖含量(mg·mL-1,n=3)
2.8.2 稳定性考察 精密吸取S9批药材水提液供试品溶液(No.1)0.01mL、0.5mL各1份,分别按2.7.1及2.7.2项下操作显色,并于显色后0,20,40,60,90,120min测定吸光度,得总糖测定和还原糖测定的稳定性RSD分别为0.75%和1.06%,表明供试品在显色后2h内稳定。
2.8.3 重复性考察 精密称取S9批药材10.0g 6份,按2.2项下制备水提液供试品溶液(No.1)。各取0.01mL按2.7.1项下操作显色测定,得总糖测定的重复性RSD为1.23%;各取0.5mL按2.7.2项下操作显色测定,得还原糖测定的重复性RSD为1.58%。
2.8.4 加样回收率考察 精密称取已知总糖和还原糖含量的S9批药材5.0g 9份,按2.2项下制备水提液供试品溶液(No.1)。分成3组,每组分别加入适宜量(1∶0.8;1∶1;1∶1.2)的葡萄糖对照品,摇匀得加样回收待测液(No.4)。取待测液0.01mL、0.5mL分别按2.7.1及2.7.2项下操作显色,得总糖和还原糖的平均加样回收率分别为98.56%、99.37%,RSD分别为1.43%、1.84%。
2.9 总糖、还原糖及多糖的含量测定 按照所建立的苯酚-硫酸联合3,5-二硝基水杨酸法测定15批红腺忍冬叶抗氧化有效部位(水提液、30%乙醇沉淀物及其滤液)中总糖及还原糖的含量,并计算多糖含量,结果如表1。
3 分析与讨论
常用的多糖测定方法为苯酚-硫酸法,其原理是:多糖类成分在浓硫酸作用下水解生成单糖,并迅速脱水生成糖醛衍生物,该衍生物可与苯酚生成橙黄色化合物用于比色测定。但是药材中存在的单糖、双糖、低聚糖及其它还原性成分在该反应过程中也会显色形成干扰,从而影响测定的准确性[12]。故本实验采用苯酚-硫酸法测定总糖含量,3,5-二硝基水杨酸法(DNS法)测定还原糖的含量,取两者差值为多糖含量,以消除还原类成分对多糖含测的干扰,使测得的多糖含量更接近真实值。
实验结果表明:浙产红腺忍冬叶水提液中多糖含量为5.045~12.348mg/mL,水提液30%乙醇沉淀后滤液中多糖含量为4.880~11.944mg/mL,水提液30%乙醇沉淀物中多糖含量为0.015~0.119mg/mL;同一批次,多糖含量均为水提液>水提液30%乙醇沉淀后滤液>水提液30%乙醇沉淀物;不同批次之间多糖含量差异较大,可能与药材采收地区、时间不同等因素有关。植物多糖作为自然界含量最丰富的初级代谢产物,具有良好的抗氧化活性,且细胞毒性较低,具有良好的发展前景[13,14]。因本实验室前期药理实验表明,红腺忍冬叶水提液、30%乙醇沉淀物及其滤液均具有一定的抗氧化作用。由此可推测,多糖可能是红腺忍冬叶水提液及其30%乙醇沉淀后滤液抗氧化作用的有效成分之一;且因水提液30%乙醇沉淀物比水提液及水提液30%乙醇沉淀后滤液中多糖含量低很多,故猜测红腺忍冬叶应还有其它抗氧化有效成分存在,有待进一步研究。
[1]吴庆华.红腺忍冬的繁殖研究[J].时珍国医国药,2007,18(10):2 396-2 397.
[2]国家药典委员会.中华人民共和国药典﹒一部[S].北京:中国医药科技出版社,2010:28-29.
[3]胡普辉,杨雪红.中国金银花发展现状及对策探讨[J].陕西农业科学,2009,55(5):104-106.
[4]徐建伟,赵小俊,王雪艳,等.常用中药材金银花的评价、育种和应用研究进展[J].科技创新导报,2011,(1):17.
[5]朱英,李键.红腺忍冬叶抗氧化作用的实验研究[J].浙江中医药大学学报,2012,36(10):1117-1122.
[6]郑瑞生,封辉,戴聪杰,等.植物中抗氧化活性成分研究进展[J].中国农学通报,2010,26(9):85-90.
[7]王忠雷,杨丽燕,张小华,等.天然产物抗氧化活性成分研究进展[J].药物评价研究,2012,35(5):386-390.
[8]杨玉红,郝慧敏.药用植物多糖的生物学功能及应用研究进展[J].生物学教学,2013,38(1):6-8.
[9]张志君,孙伟,李永亮,等.3,5-二硝基水杨酸法联合苯酚-浓硫酸法测定不同产地黄精中多糖含量[J].中国实验方剂学杂志,2012,18(6):106-109.
[10]孙文,巢志茂,王醇,等.瓜蒌饮片中总糖及还原糖的含量测定[J].中国实验方剂学杂志,2013,19(9):96-99.
[11]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2002,29(8):534-536.
[12]S. Suzanne, Nielsen. Food Analysis Laboratory Manual[M]. Holland: Kluwer Academic / Plenum Publishers, 2010:47-53.
[13]王涛,赵谋明.多糖的研究进展[J].现代食品科技,2007,23(1):95,103-106.
[14]邓小云,丁登峰,戴美红,等.植物多糖药理作用研究进展[J].中医药导报,2006,12(9):86-88.

