突触蛋白Synapsin在氧糖剥夺模型中的表达及意义
刘洪雨,莽 靖,杨 乐,胥桂华,李宗树,王娇琦,何金婷*,徐忠信*
(1.吉林大学中日联谊医院,吉林 长春130033;2.吉林省人民医院,吉林 长春130021)
突触蛋白(Synapsin)是反映神经元、突触功能状况的内在标志物[1],本研究应用PC12细胞进行氧糖剥夺处理,建立缺血性脑损伤模型,采用Western blot方法检测不同时间氧糖剥夺模型细胞中的Synapsin蛋白表达,探讨Synapsin蛋白在氧糖剥夺模型中的表达及意义。
1 材料与方法
1.1 细胞株
PC12细胞株(大鼠肾上腺嗜铬细胞瘤)购自北京银紫晶生物技术公司。
1.2 主要试剂和仪器
DMEM培养基购自美国Gibco公司;胎牛血清购自北京鼎国公司;鼠神经生长因子(NGF)、胰蛋白酶均购自美国Sigma公司;抗突触素抗体购自武汉博士德生物技术公司;Model550酶联分析仪:美国BIO-RAD;激光共聚焦显微镜:日本OLYMPUS。
1.3 实验方法
PC12细胞经NGF刺激6 d后应用含有连二亚硫酸钠的无糖DMEM培养液洗涤细胞3次,继而继续应用无糖DMEM培养液孵育细胞,并放入37℃孵箱内的缺氧罐内继续培养[2]。
接种于6孔板内的PC12细胞经NGF(100 ng/ml)连续刺激后,分别进行氧糖剥夺3 h,6 h, 9 h,12 h和24 h,而后消化、收集细胞,RIPA冰上裂解20 min,12 000转/min,离心5 min,取上清液。SDS-PAGE电泳后转膜,恒流1 mA/cm2,转移1.5 hr。转移结束后,50%甲醇脱色至背景清晰,双蒸水清洗,风干夹于两层滤纸中保存。用0.01M PBS洗膜,5 min×3次。加入包被液,室温平稳摇动2 h。弃包被液,0.01M PBS再次洗膜,5 min×3次。一抗4℃孵育过夜,而后0.01M PBS洗膜,5 min×4次。使用辣根过氧化物酶偶联的二抗(按合适稀释比例用0.01M PBS稀释),室温孵育2 h。弃二抗,用0.01M PBS洗膜,5 min×4次。加入显色液,避光显色至出现条带时放入双蒸水中终止反应[2-3]。
1.4 统计学方法
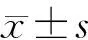
2 结果
2.1 PC12细胞形态学变化
培养3天后,PC12细胞开始停止分裂。并逐渐分化为具有交感神经元特征的细胞,开始长出神经突起,培养5天后,大多数PC12细胞转变为类似于交感神经元的形态,突起逐渐增多并延长,形成稀疏的网络。随着培养时间的延长,交感神经元样细胞的胞体逐渐增大[4]。
2.2 MTT法检测氧糖剥夺后细胞活力
用MTT法检测氧糖剥夺后3 h、6 h、9 h、12 h、16 h、24 h的细胞存活率,如图1所示,随OGD时间的延长,细胞存活率明显下降,而OGD12 h后细胞存活率下降更明显,OGD24 h细胞存活率为65.8%,与对照组比,差异显著(P<0.05)。

图1 PC12 氧糖剥夺后不同时间细胞活力
2.3 Synapsin蛋白的表达变化
应用Western Blot检测氧糖剥夺模型处理的PC12细胞内Synapsin蛋白的表达,如图2和对照组相比较,随NGF诱导时间的延长,与对照组(P<0.05),相比细胞Synapsin蛋白的表达逐渐变浅。
3 讨论
缺血性脑损伤是一个复杂、多因素、多层次的病理变化过程,其中脑缺血发生后引发的一系列缺血级联反应是其根本因素。因此,针对缺血性脑损伤发生机制的研究具有重要意义。PC12细胞来源于鼠肾上腺嗜铬细胞瘤(一种交感神经系统的肿瘤)主要分泌产物为儿茶酚胺类递质包括多巴胺、去甲肾上腺素等。膜上有NGF受体,受生理水平NGF诱导后停止分裂,长出神经突起,分化为具有交感神经元特性的细胞,常被用于分析神经元分化和NGF作用分子机制的研究,也被用于研究生长因子调节神经细胞基因表达改变的机制[5]。
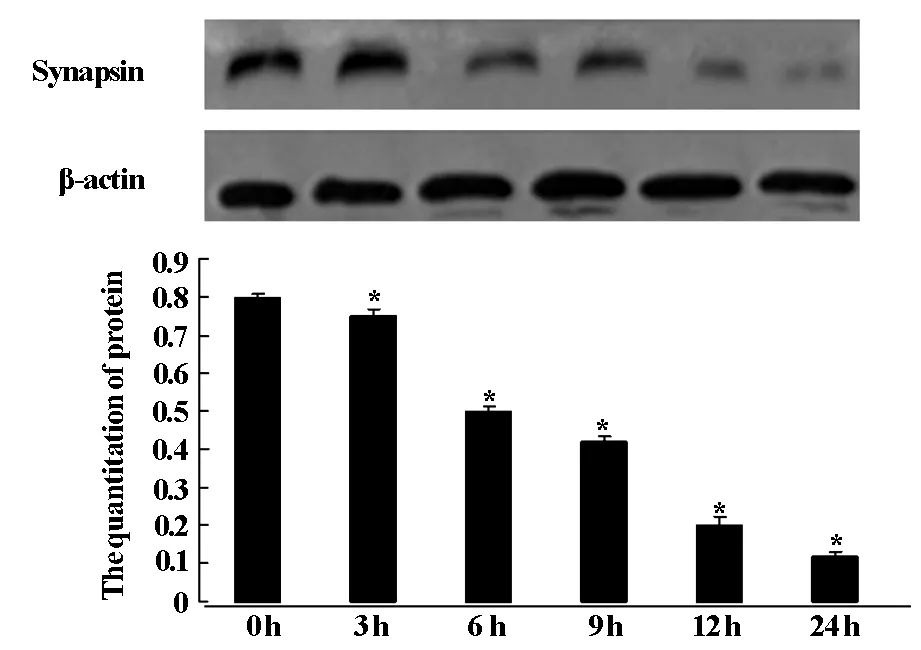
图2 OGD不同时间synapsin蛋白的表达变化
氧糖剥夺(oxygen glucose deprivation/OGD)是在细胞水平上模拟缺血/低氧刺激的经典模型。通过对细胞培养条件的改变,包括将细胞放入低氧箱或者更换无糖的培养基,可模拟细胞在缺血/低氧情况下的损伤,细胞会产生坏死、凋亡、自噬等现象[6]。本研究应用PC12细胞模拟细胞缺血/低氧损伤后,建立氧糖剥夺模型,分别观察OGD3 h、6 h、9 h、12 h、24 h不同时间,并采用MTT法分析细胞的存活率,结果显示,随氧糖剥夺时间增加,神经元存活率由99.7%下降至64.3%,表明模拟缺血缺氧对神经元产生了影响。
突触蛋白(Synapsin)是一种与突触相关同时具有神经元特异性的磷酸蛋白,是一种反应神经元及突触功能状况的内在标志物,突触素(Synaptophysin)可以调节神经元突起的延长、参与突触发生的过程[7]。通过磷酸化和非磷酸化来调节神经递质释放对神经元的早期发育和再生也起着至关重要的作用。关于脑缺血后突触蛋白的表达变化,国内外研究结果并不一致[8]。本研究表明氧糖剥夺后突触蛋白表达和PC12细胞活率呈正相关,Synapsin蛋白参与突触囊泡的介导转运、神经递质的释放、突触囊泡循环,参与突触发生[9],研究证实,突触蛋白是反映神经元和突触反映神经元、突触功能状况的内在标志物,本研究同时采用Western Blot检测氧糖剥夺PC12细胞内Synapsin蛋白表达变化,结果显示,与对照组相比,随着氧糖剥夺时间的延长,Synapsin蛋白表达水平逐渐降低,提示神经元缺血后随时间变化,神经细胞的神经元特性、突触功能逐渐减低。突触蛋白在神经递质释放过程中起着至关重要的调节作用,并参与中枢神经元早期发育,因此,调节脑缺血后突触蛋白的表达可能作为诊治脑缺血后病理、生理改变的一种方法,也为研究脑缺血后神经再生和可塑性提供一种途径。
作者简介:刘洪雨,女,在读硕士,主要研究方向:缺血性脑损伤与保护研究。
参考文献:
[1]Kumar MR,Bhat,Nityanand Maddodi.Transcriptional regulation of human MAP2 gene in melanoma:role of neuronal bHLH factors and Notch1 signaling[J].Nucleic acids research,2006,34(13):3819.
[2]Chunli Mei,Jinting He,JingMang.NGF combined with OGD induces neural ischemia tolerance in PC12 cells[J].AJBR,2011,5(10):315.
[3]Koji Ikegami,Masahiro Mukai.TTLL7 is a mammalian -tubulin polyglutamylase required for growth of MAP2-positive neurites[J].The journal of biological chemistry,2006,281(41):30707.
[4]Jae Young Lee,Joo-Woon Lee.Neuroactive conducting scaffolds:nerve growth factor conjugation on active ester-functionalized polypyrrole[J].J R Soc Interface,2009,6:801.
[5]Katarzyna Mnich,David P.Inhibition by anandamide of 6-hydroxydopamine induced cell death in PC12 cells[J].International journal of cell biology volume,2010,97:10.
[6]Ronchini C,Capobianco AJ.Induction of cyclin D1transcription and CDK2ac tivity by Notch (ic):implication for cell cycle disruption in transformation by Notch(ic)[J].Mol Cell Biol,2001,21:592 5.
[7]Damian C,Genetos,Whitney K.Oxygen tension modulates neurite outgrowth in PC12 cells through a mechanism involving HIF and VEGF[J].J Mol Neurosci,2010,40:360.
[8]BaonzaA,FreemanM.Control of cell proliferationin the Drosophila eye by Notch signaling[J].Dev Cell,2005,8:529.
[9]Larsena EC,Hatchera JF.Effect of D609 on phospholipid metabolism and cell death during oxygen-glucose deprivation in PC12 cells[J].Neuroscience,2007,146(3):946.

