海洋真菌Mucor circinelloides MNP12010102的次级代谢产物研究
,,, ,
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江工业大学 生物与环境工程学院,浙江 杭州 310014)
近年来,由于对陆生动植物的药源发现越来越稀少,海洋已成为人类开垦新药的处女地.海洋约占地球总面积71%[1],微生物资源丰富,种类繁多,是生物资源的巨大宝库.它独特的高盐、高压、低温、寡营养等环境,赋予了海洋微生物独特的代谢途径和机体防御机制[2],使其产生的代谢物的化学结构新颖、生理功能独特,为提取和分离天然生物活性分子提供了新来源[3].
为了寻找新的生物活性成分,本课题对海洋真菌MucorcircinelloidesMNP12010102发酵液的乙酸乙酯萃取相进行了化学成分的研究,分离得到7个化合物,通过1H NMR,13C NMR以及文献对照等方法,鉴定为过氧化麦角甾醇(Ⅰ),麦角甾醇(Ⅱ),cyclo-(S-Pro-8-hydroxy-R-Ile)(Ⅲ),cyclo-(S-Pro-S-Leu)(Ⅳ),cyclo-(S-Pro-R-Phe)(Ⅴ),2-(4-hydr oxyphenyl)ethylacetate(Ⅵ),和tyrosol(Ⅶ),其中化合物Ⅲ—Ⅶ均为首次从该属真菌中分离得到.本研究还对上述化合物进行了细胞毒活性实验.
1 实验部分
1.1 菌株来源
海洋真菌MNP12010102分离自2012年4月采集到的中国东海(北纬28.25°、东经122.60°海域)海水.
由南京金斯瑞生物科技公司鉴定为卷枝毛霉Mucorcircinelloides.菌种保藏于中国典型培养物保藏中心.
1.2 仪器和材料
HPLC(LC-20A)(日本岛津公司);超净工作台(上海恒益科技有限公司);Spectra Max M5多功能酶标仪(美国Molecular Devices公司);Autospect 3000质谱仪(美国Thermo公司);核磁共振波谱仪500 MHz(瑞士Bruker公司);Revco Elite II CO2培养箱(美国Thermo公司);Luna 5u C18制备色谱柱(美国Phenomenex公司);四甲基偶氮唑盐(MTT)购自Sigma公司;改良型RPMI1640细胞培养基购自奥赛飞世尔生物化学制品有限公司;GF254高效薄层硅胶(青岛海洋化工厂);其余试剂为国产分析纯.
前列腺癌细胞PC-3和胰腺癌细胞PANC-1均来自浙江工业大学生物与环境工程学院毒理实验室.
1.3 培养与提取
将该菌株28 ℃,200 r/min,摇床培养7 d,静置培养7 d,所得发酵液经过萃取和浓缩后,得到发酵液粗浸膏22 g.该乙酸乙酯萃取部分具有较好的生物活性,因此参考文献[4]中MTT-HPLC联用模型等方法指导下完成以下的分离工作.
1.4 分 离
将乙酸乙酯浸膏用大孔树脂粗分,以V(甲醇)∶V(水)=1∶4,2∶3,3∶2,4∶1,1∶0梯度洗脱,快速分离,按极性由高到低分粗分为6个组分,再经反复过硅胶柱(石油醚/乙酸乙酯或二氯甲烷/甲醇),Sephadex LH-20凝胶柱色谱和半制备HPLC等方法分离纯化得到化合物Ⅰ(64 mg)、化合物Ⅱ(35 mg)、化合物Ⅲ(9 mg)、化合物Ⅳ(15 mg)、化合物Ⅴ(10 mg)、化合物Ⅵ(154 mg)、化合物Ⅶ(14 mg).
2 结果和讨论
2.1 结构鉴定
化合物Ⅰ为白色针状结晶,1H NMR(500 MHz, CDCl3)δ6.51(d,J=8.5 Hz,1H,C7-H),6.25(d,J=8.5 Hz,1H,C6-H),5.23(dd,J=15.3,8.3 Hz,1H,C22-H),5.15(dd,J=15.3,8.3 Hz,1H,C23-H),3.99(m,1H,C3-H),1.01(dd,J=6.7,1.7 Hz,3H,C21-Me),0.92(d,J=6.8 Hz,3H,C28-Me),0.89(s,3H,C19-Me),0.84(d,J=1.3 Hz,3H),0.83(d,J=1.3 Hz,3H),0.82(s,3H,C18-Me).该化合物的氢谱为典型的甾醇特点,确定为过氧化麦角甾醇[5].
化合物Ⅱ为白色针状结晶,1H NMR(500 MHz,CDCl3)δ5.58(dd,J=5.5,2.3 Hz,1H,C7-H),5.40~5.39(m,1H,C6-H),5.24(dd,J=15.2,7.1 Hz,1H,C22-H),5.18(dd,J=15.3,7.8 Hz,1H,C23-H),3.65(m,1H,C3-H),2.48(ddd,J=14.3,4.5,2.2 Hz,1H,C2-H),2.30(t,J=12.2 Hz,1H,C4-H),1.05(d,J=6.6 Hz,3H,C21-Me),0.96(d,J=4.4 Hz,3H,C19-Me),0.93(d,J=6.8,3H,C28-Me),0.85(d,J=5.5 Hz,3H,C26-Me),0.84(d,J=7.1 Hz,3H,C27-Me),0.64(s,3H,C18-Me),确定为麦角甾醇[6].
化合物Ⅲ为黄色油状(甲醇),1H NMR(500 MHz,MeOD)δ4.26~4.18(m,1H,C9-H),4.09(s,1H,C6-H),3.56(ddd,J=13.9,8.6,5.8 Hz,1H,C3-H),3.52~3.49(m,1H,C3-H),2.36~2.31(m,1H,C5-H),2.20~2.16(m,1H,C10-H),2.08~2.01(m,1H,C4-H),2.00~1.91(m,2H,C4-H or C5-H),1.46(dqd,J=15.0,7.5,4.4 Hz,1H,C11-H),1.38~1.30(m,1H,C11-H),1.09(d,J=7.2 Hz,3H,C13-Me),0.95(t,J=7.4 Hz,3H,C12-Me).13C NMR(126 MHz,MeOD)δ172.4(C-1),167.6(C-7),61.3(C-6),60.0(C-9),46.2(C-3),37.1(C-10),29.5(C-5),25.4(C-11),23.2(C-4),15.5(C-13),12.6(C-12).参照文献[7],鉴定该化合物为cyclo-(S-Pro-8-hydroxy-R-Ile).
化合物Ⅳ为黄色油状(甲醇),1H NMR(500 MHz,MeOD)δ4.28(dd,J=11.8,4.1 Hz,1H,C6-H),4.15(dd,J=7.0,4.0 Hz,1H,C9-H),3.54(d,J=4.7 Hz,1H,C3-H),3.52(d,J=4.6 Hz,1H,C3-H),2.35~2.27(m,1H,C5-H),2.09~2.03(m,1H,C4-H),2.01(ddd,J=9.6,6.1,2.1 Hz,1H,C10-H),1.96~1.92(m,1H,C4-H),1.91~1.86(m,1H,C11-H),1.54(ddd,J=11.3,6.9,4.0 Hz,1H,C10-H),1.58~1.49(m,1H,C5-H),0.98(d,J=3.2 Hz,3H,C13-Me),0.97(d,J=3.2 Hz,3H,C12-Me).13C NMR(126 MHz,MeOD)δ172.8(C-1),168.9(C-7),60.3(C-6),54.6(C-9),46.4(C-3),39.4(C-10),29.1(C-5),25.8(C-11),23.6(C-4),23.3(C-12),22.2(C-13).经查阅文献,上述数据与文献[8]一致,故鉴定化合物为cyclo(S-Pro-S-Leu).
化合物Ⅴ为黄色油状(甲醇),1H NMR(500 MHz,MeOD)δ7.29(d,J=7.2 Hz,2H),7.25(d,J=7.0 Hz,2H),4.46(d,J=4.3 Hz,1H),4.08(dd,J=10.4,6.3 Hz,1H),3.72~3.63(m,1H),3.61(s,1H),3.59~3.51(m,1H),3.42~3.35(m,1H),3.20(dd,J=13.3,4.2 Hz,1H),3.16(dd,J=13.9,4.6 Hz,2H),2.16~2.03(m,1H),1.88~1.72(m,2H),1.29~1.19(m,1H),1.20~1.11(m,2H).13C NMR(126 MHz,MeOD)δ170.9(C-7),166.9(C-1),137.4(C-1′),131.3(C-1′),129.4(C-2′),128.1(C-3′),127.9(C-4′),60.1(C-6),57.7(C-9),45.9(C-3),38.2(C-10),29.6(C-5),22.8(C-4).经过数据分析,并结合文献[9-10],鉴定该化合物为cyclo-(S-Pro-R-Phe).
化合物Ⅵ为黄色油状(甲醇),1H NMR(500 MHz,MeOD)δ7.05(d,J=8.4 Hz,2H,C2′-H,C6′-H),6.71(d,J=8.4 Hz,2H,C3′-H,C5′-H),4.20(t,J=7.1 Hz,2H,C1-H),2.83(t,J=7.1 Hz,2H,C2-H),2.01(s,3H,Me).13C NMR(126 MHz,MeOD)δ172.9(COOCH2),157.1(C-4′),130.9(C-2′,6′),129.9(C-1′),116.0(C-3′,4′),66.6(C-1),35.2(C-2),20.8(Me).经文献查阅,上述数据与文献[11]基本一致,鉴定该化合物为2-(4-hydr oxyphenyl)ethylacetate.
化合物Ⅶ为白色片状晶体(甲醇),1H NMR(500 MHz,MeOD)δ7.02(d,J=8.0 Hz,2H,C2-H,C6-H),6.72(d,J=8.0 Hz,2H,C3-H,C5-H),3.68(t,J=7.2 Hz,2H,C1-H),2.71(t,J=7.2 Hz,2H,C2-H).13C NMR(126 MHz,MeOD)δ155.8(C-4′),129.8(C-2′,6′),129.5(C-1′),114.7(C-3′,5′),63.2(C-1),38.01(C-2).上述数据与文献[12-13]基本一致,鉴定该化合物为tyrosol.
化合物Ⅰ—Ⅶ的结构式分别为

2.2 化合物抗癌活性测定
采用MTT实验方法[14-15]分析化合物Ⅰ—Ⅶ分别对PC-3和PANC-1这2种肿瘤细胞系的增殖抑制作用.以紫杉醇为阳性对照,结果如表1所示.化合物Ⅰ,Ⅱ和Ⅳ—Ⅶ对PC-3细胞具有有意义的抑制作用,化合物Ⅰ—Ⅲ对PANC-1细胞具有一定的细胞毒活性,其中化合物Ⅰ对肿瘤细胞PC-3和PANC-1具有相对较好的抑制活性.
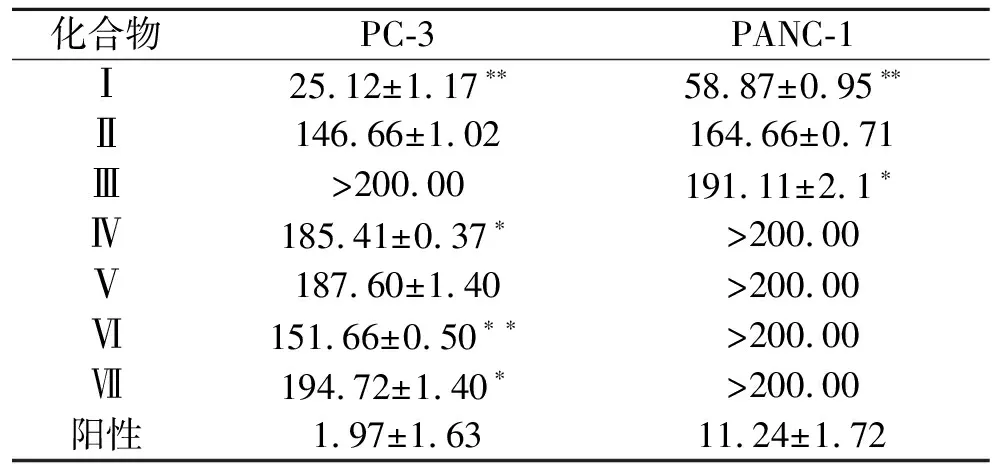
表1 化合物Ⅰ—Ⅶ对2种肿瘤细胞的IC501)
3 结 论
本实验从东海海洋来源的1株卷枝毛霉属真菌MucorcircinelloidesMNP12010102的发酵产物中分离鉴定了7个化合物,其中包括了3个环二肽(Ⅲ,Ⅳ,Ⅴ),2个甾醇(Ⅰ,Ⅱ)及2个苯酚类衍生物(Ⅵ,Ⅶ).cyclo-(S-Pro-8-hydroxy-R-Ile)(Ⅲ),cyclo-(S-Pro-S-Leu)(Ⅳ)和cyclo-(S-Pro-R-Phe)(Ⅴ)为首次从该属海洋真菌中分离得到,具有一定的细胞毒性.苯酚类衍生物2-(4-hydr oxyphenyl)ethylacetate(Ⅵ)和tyrosol(Ⅶ)首次从该属海洋真菌中分离得到,常被用作药物中间体,对PC-3细胞具有一定的抑制作用.体外抗肿瘤活性研究实验表明,化合物Ⅰ对肿瘤细胞PC-3和PANC-1有相对较好的抑制活性,具有潜在的药物开发价值.
杜克大学的科学家2014年7月27日发表在《自然》(Nature)上的一篇文章发现,卷枝毛霉菌(Mucorcircinelloides)产生抗药性的新途径:表观RNA可以干扰(RNAi)抑制相关基因的表达,进而产生暂时的、可逆的抗药性.而科学界一直以来都只知道微生物产生抗药性的惟一不可逆途径是:细菌和真菌在药物靶点基因产生突变产生抗药性.这一研究成果引起学术界的广泛关注,也使得卷枝毛霉菌(Mucorcircinelloides)成为明星微生物,随着其第二种抗药性新途径的发现,该菌种的特有次级代谢产物也必将成为科学家们研究的一个新热点[16].
参考文献:
[1] 朱伟明,王俊锋.海洋真菌生物活性物质研究之管见[J].菌物学报,2011,30(2):218-228.
[2] 王鸿,陈俊,倪建良,等.生物活性导向分离海洋真菌Alternariasp. MNP801次级代谢产物[J].浙江工业大学学报,2014,42(1):40-44.
[3] KJER J, DEBBAB A, ALY A H, et al. Methods for isolation of marine-derived endophytic fungi and their bioactive secondary products[J]. Nature Protocols,2010,5(3):479-490.
[4] 陈霞.海洋微生物ENP702#活性分子定点识别及分离研究[D].杭州:浙江工业大学,2012.
[5] 刘佳佳,袁遥,陈淑娟,等.红豆杉内生真菌产过氧麦角甾醇的分离[J].天然产物研究与开发,2010,22(B08):225-228.
[6] 李尚德,魏美燕,李志华,等.一株红树内生真菌Penicilliumsp.(ZZF29#)次级代谢产物的分离与鉴[J].应用化学,2012,29(9):727-729.
[7] YANG Bin, DONG Jun-de, ZHOU Xue-feng, et al. Proline-containing dipeptides from a marine sponge of a Callyspongia species[J].Helvetica Chimica Acta,2009,92(6):1112-1117.
[8] PEDRAS M S C, YU Yang, LIU Jun, et al. Metabolites produced by the phytopathogenic fungus rhizoctonia solani: isolation, chemical structure determination, syntheses and bioactivity[J]. Zeitschrift fur Naturforschung C-Journal of Biosciences,2005,60(9/10):717-722.
[9] FURTADO N A, PUPO M T, CARVALHO I, et al. Diketopiperazines produced by an Aspergillus fumigatus Brazilian strain[J]. Journal of the Brazilian Chemical Society,2005,16(6B):1448-1453.
[10] XIE Hai-hui, DAN Yang, WEI Xiao-yi. Diketopiperazines and nucleosides from mycelial cultures of Dichomitus squalens[J]. Chinese Journal of Natural Medicines,2008,6(5):395-398.
[11] 阙东枚,戴好富,曾艳波,等.见血封喉内生真菌Acremoniumsp. J1化学成分研究[J].中国药物化学杂志,2009,19(3):200-205.
[12] 唐雨,张瑜,袁久志,等.松花粉化学成分的分离与鉴定[J].沈阳药科大学学报,2011,28(6):429-432.
[13] KWAK J H, KANG M W, ROH J H, et al. Cytotoxic phenolic compounds from Chionanthus retusus[J]. Archives of Pharmacal Research,2009,32(12):1681-1687.
[14] 梁颖,张晓莉,陶冀,等.红花多糖对人肝癌SMMC-7721细胞增殖的抑制作用[J].中医药学报,2011,39(5):32-35.
[15] 唐岚,赵亚,单海峰,等.甜瓜蒂中葫芦素类成分分离及体外抗癌活性研究[J].浙江工业大学学报,2012,40(4):388-391.
[16] SILVIA C, CECELIA S W, SOO C L, et al. Antifungal drug resistance evoked via RNAi-dependent epimutations[EB/OL].[2014-07-27]. http://www.nature.com/nature/journal/vaop/ncurrent/full/nature13575.html.

