动力相关蛋白和视神经萎缩症蛋白在高氧诱导早产鼠肺损伤中的作用*
余 莉,董文斌
(1.泸州医学院附属医院新生儿科,四川泸州 646000;2.重庆市永川区人民医院儿科 402160)
高氧肺损伤是抢救危重新生儿的主要并发症之一,存活早产儿甚至出现肺发育障碍[1],如病死率很高的支气管肺发育不良(bronchopulmonary dysplasia BPD)是造成早产儿致残和死亡的重要原因之一(30%~40%)。高氧是BPD形成的主要因素,高氧肺损伤时调控细胞凋亡的调节因子可能改善早产儿高氧肺损伤。大量研究证实,动力相关蛋白(dynamin related protein 1,DRP1)和视神经萎缩症蛋白(optic atrophy 1,OPA1)在肺损伤中具有重要的意义,DRP1是介导线粒体分裂的因子,DRP1表达增强致线粒体持续分裂引起细胞凋亡[2]。OPA1是介导线粒体内膜融合及稳定线粒体的分子。本研究在前期建立早产大鼠高氧肺损伤模型的基础上,研究DRP1/OPA1在早产大鼠高氧肺损伤发病中的作用。
1 材料与方法
1.1 实验动物及分组 早产Wistar大鼠48只随机分为对照组(吸入氧体积分数为21%)和高氧组(吸入氧体积分数为95%)。
1.2 模型制备 参照本课题前期建立高氧肺损伤动物模型的方法[3]。高氧组置于95%氧箱中,对照组置于同一室内21%氧的空气中。两组相同喂养1、3、7d时分批断颈放血处死后取肺组织,固定包埋,切片作苏木精-伊红(HE)染色观察肺组织的病理变化,免疫组织化学观察DRP1/OPA1在肺组织的表达与分布,末端转移酶标记技术(TUNEL)法检测细胞凋亡。
1.3 实验材料与仪器 实验材料:DRPl多克隆抗体(兔抗鼠)购自abcam公司;OPAl多克隆抗体(兔抗鼠)购自R&D公司;原位凋亡检测试剂盒:瑞士罗氏公司;SP法免疫组化试剂盒:中国北京中杉金桥生物技术有限公司。主要实验仪器:微量加样枪、超低温冰箱、倒置相差显微镜、电热恒温鼓风干燥箱、压力蒸气灭菌器、低温高速离心机、激光共聚焦显微镜、数字智能测氧仪。
1.4 指标检测
1.4.1 肺组织病理形态学观察 肺组织切片HE染色观察比较肺组织病理变化。
1.4.2 免疫组化SP法检测DrP1/OPA1在肺组织的表达SP法严格按照试剂盒说明书操作,阳性反应为胞质染成棕黄色或黄褐色。结果判定:Image-pro 6.0图像分析软件分析图像,每张切片在400倍视野下随机选取6个非重叠视野,测定其平均光密度值(Average optical density,AOD),算出平均值进行统计分析。
1.4.3 TUNEL法检测细胞凋亡 严格按照试剂盒说明书操作,阳性反应为细胞核染成黄色或棕黄色。结果判定:每张切片在400倍视野下随机选6个非重叠视野,计数的方式得出每个视野凋亡细胞数及总细胞数,算出凋亡指数,最后求平均值。凋亡指数(Apoptotic index,AI)=凋亡细胞数/总细胞数×100%。
2 结 果
2.1 在光镜下观察,对照组大鼠肺组织细胞紧密排列,呈铺鹅卵石样改变,透明度好,分裂相明显,囊泡壁厚,胞质中颗粒稀少有粗大的嵴突。高氧组大鼠肺组织细胞数量随时间(1、3、7 d)较对照组显著减少,细胞形态改变不规则,肺泡结构破坏明显,胞质中出现较多空泡、炎性细胞、颗粒物聚集,细胞间隙变大,细胞碎片大量填充其间,上皮细胞肿胀间隔增粗肺泡腔变小,见图1。
2.2 DRP1和OPA1在肺组织的表达与分布 免疫组化SP检测,各实验组肺组织细胞胞质均有表达。与对照组相比,高氧暴露时间越长,高氧组DRPl的表达(OD值)明显增加,OPAl的表达(OD值)明显降低,DRP1/OPA1比值明显增加,差异具有统计学意义(P<0.05),见表1~3。
2.3 TUNEL检测凋亡结果 对照组在各时间点仍然可见少量被染成黄色或棕黄色的TUNEL阳性细胞,高氧组则随着高氧暴露时间延长,AI呈逐渐增高趋势,可见大量TUNEL阳性细胞出现在支气管上皮细胞和肺泡上皮细胞中,与对照组相比,差异有统计学意义(P<0.01)。见表4。
2.4 细胞凋亡与DRP1/OPA1蛋白表达比值的相关分析 早产鼠肺组织细胞凋亡分别与DRP1/OPA1蛋白表达的直线相关,细胞AI和DRP1/OPA1比较,r=0.725,P<0.01,提示呈显著正相关。
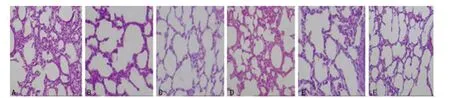
图1 肺组织病理学形态改变(×100)
表1 早产鼠肺组织DRP1的表达(,n=6)

表1 早产鼠肺组织DRP1的表达(,n=6)
a:P<0.05,与同时间点对照组比较;b:P<0.05,与同组1d比较;c:P<0.05,与同组3d比较。
组别 1d 3d 7d 39 0.872高氧组 1634.57±108.85a 8008.14±530.26ab 13132.32±594.57abc 615.8260.000 t 4.324 12.152 26.444 P F P对照组 789.86±58.95 772.31±42.82 770.39±67.84 0.10.005 0.000 0.000
表2 早产鼠肺组织OPA1的表达(,n=6)

表2 早产鼠肺组织OPA1的表达(,n=6)
a:P<0.05,与同时间点对照组比较;b:P<0.05,与同组1d比较;c:P<0.05,与同组3d比较。
组别 1d 3d 7d.34 0.501 0.622高氧组 3126.91±264.91a 1399.81±268.62ab 579.76±99.20abc 133.31 0.000 t 13.648 27.203 41.315 P F P对照组 3935.42±263.99 3764.15±281.53 3907.80±2310.000 0.000 0.000
表3 线粒体分裂蛋白DRP1和融合蛋白OPA1比值变化(,n=6)

表3 线粒体分裂蛋白DRP1和融合蛋白OPA1比值变化(,n=6)
a:P<0.05,与同时间点对照组比较;b:P<0.05,与同组1d比较;c:P<0.05,与同组3d比较。
组别 1d 3d 7d F P对照组 0.200±0.01 0.205±0.01 0.197±0.01 3.303 0.084高氧组 0.52±0.01a 5.72±0.05ab 22.68±0.07abc 1694000.000 t 63.737 212.235 541.772 P 0.000 0.000 0.000
表4 各组早产鼠肺组织细胞凋亡指数(,n=6)
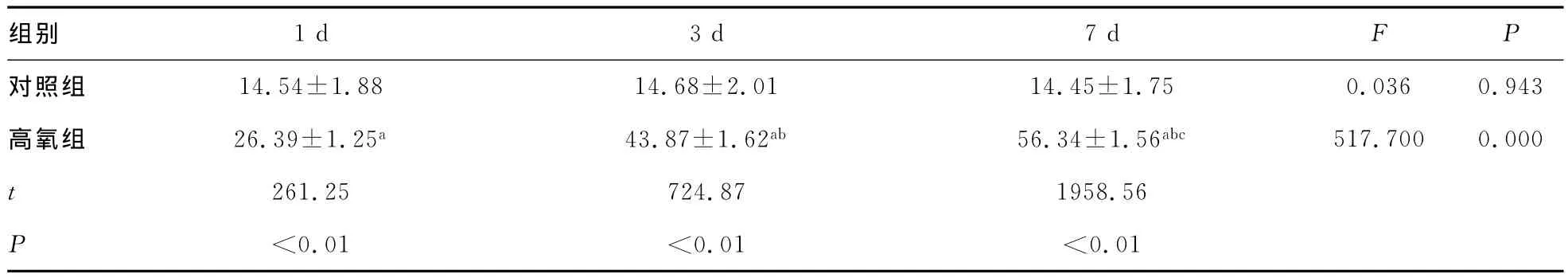
表4 各组早产鼠肺组织细胞凋亡指数(,n=6)
a:P<0.05,与同时间点对照组比较;b:P<0.05,与同组1d比较;c:P<0.05,与同组3d比较。
组别 1d 3d 7d F P对照组 14.54±1.88 14.68±2.01 14.45±1.75 0.036 0.943高氧组 26.39±1.25a 43.87±1.62ab 56.34±1.56abc 517.7000.000 t 261.25 724.87 1958.56 P<0.01 <0.01 <0.01
3 讨 论
长时间吸入高氧可引起多器官功能衰竭,肺是高氧后最常受累的器官之一。细胞凋亡是高体积分数氧导致肺损伤的一个十分明显的组织学特点,细胞凋亡在高氧肺损伤发病机制中扮演重要角色,细胞凋亡与肺损伤的程度呈正相关。线粒体分裂是细胞凋亡的早期事件,研究表明DRP1和OPA1蛋白分别是调节线粒体分裂融合的关键蛋白,通过持续对立的融合分离来维持动态平衡[3-4]。
3.1 线粒体形态和细胞凋亡 细胞凋亡的主要途径是线粒体途径。细胞凋亡的早期,线粒体融合和分裂失衡管网状线粒体崩溃成为点泡状,线粒体片段化改变,线粒体膜间隙释放促凋亡蛋白造成线粒体数量增加,线粒体碎裂明显。研究证实,在细胞凋亡的早期,线粒体分离,形态变化;抑制线粒体的分离,促进线粒体融合可能抑制细胞凋亡[5-6],说明线粒体分离和融合平衡导致线粒体形态变化,和细胞凋亡有关。线粒体形态改变:线粒体膜改变,线粒体通透性转变孔(mitocho-ndrial permeability transition pore mtPTP)开放,死亡促进因子(deathepromoting factor DPF)和膜间隙蛋白 (intermembrane space IMS)经mtPTP释放,IMS活化Caspase,促进凋亡;线粒体释放多种凋亡诱导因子到细胞质中,线粒体释放细胞色素C,激活凋亡的半胱氨酰天冬氨酸特异性蛋白酶Caspase(cysteingl aspartate specific protease)酶通路,黄素蛋白AIF核片段化又改变线粒体膜通透性,促凋亡因子同样激活Caspase,凋亡诱导因子能促进细胞色素C释放;机体处于高氧状态时活性氧在线粒体中大量产生,活性氧族作为信号转导因子诱发凋亡信号传导途径,活化核转录因子和细胞凋亡相关基因导致细胞凋亡。本实验随着高氧暴露时间的延长,高氧组细胞形态改变不规则,肺泡结构破坏明显;高氧组可见大量黄色或棕黄色的TUNEL阳性细胞出现。暴露高氧时间越长,TUNEL阳性细胞越多,细胞凋亡指数增高,差异有明显统计学意义,提示吸入高浓度氧可以诱导早产鼠肺组织发生细胞凋亡。
3.2 DRPl、OPAl与线粒体形态变化
3.2.1 DRPl与线粒体分离 DRPl在线粒体外膜潜在分裂点聚集使线粒体分散,产生片段化的线粒体,线粒体数量增加,诱导膜间隙释放促凋亡蛋白。超表达DRP1分子加速线粒体分裂[7],促进细胞凋亡[8-9],抑制 DRP1 表达可以降低凋亡,降低线粒体分裂[10-12]。本研究显示高氧组DRP1表达较对照组显著增加,证实高氧诱导细胞凋亡中,DRP1表达上调促进线粒体分离导致细胞凋亡。
3.2.2 OPA1与线粒体融合 OPA1以寡聚体稳定线粒体的嵴结构,减轻细胞凋亡起到重要作用[13]。抑制OPA1表达融合能力的降低,线粒体片段化改变,线粒体嵴减少,细胞出现凋亡[14-15]。相反,高表达OPA1,诱导线粒体形态发生网络化[16],缩小线粒体嵴膜连接,抑制膜间蛋白的释放,抑制细胞色素C的释放,抑制细胞凋亡。本研究组OPA1表达较对照组显著减少,从而证实高氧导致肺损伤细胞凋亡过程中,抑制线粒体融合蛋白OPA1表达导致线粒体融合减少促进细胞凋亡。
3.3 DRP1/OPA1比值变化致线粒体形态改变与细胞凋亡 线粒体分裂增强,线粒体融合抑制或者两者共同作用线粒体片段化改变,线粒体碎裂增强,形态改变导致线粒体功能异常促进细胞凋亡。发现线粒体碎裂增强,TUNEL阳性细胞数表达增多,提示线粒体形态变化与细胞凋亡关系密切。凋亡诱导物在增强线粒体分裂蛋白DRP1表达同时抑制线粒体融合蛋白OPA1表达,导致线粒体融合和分裂失衡,促进细胞凋亡。
总之,本研究证实了高氧导致早产大鼠肺组肺损伤,发现高氧后涉及上调DRP1的表达水平,促进线粒体分离;下调OPA1的表达水平,抑制线粒体融合导致细胞凋亡。提示DRP1/OPA1在肺损伤时发挥重要作用,可以抑制DRP1,激活OPA1来改善高氧致肺损伤,降低细胞凋亡,其机制有待进一步研究。
[1]Gordo-Vidal F,Calvo-Herranz E,Abella-Alvarez A,et al.Hyperoxia-induced pulmonary toxicity[J].Neonatology,2012,102(1):1-8.
[2]Sue FN,Kristi LN,Richard JY.Mitochondrial dynamics and apoptosis[J].Genes Dev,2008,22(6):1577-1590.
[3]党嘉文,孙鸿燕,董文斌,等.小窝蛋白-1在早产鼠高氧肺损伤中的表达及其意义[J].实用儿科临床杂志,2011,26(12):959-961.
[4]Arnold YS,Joseph AM,Debapriya D,et al.New insights into the role of mitochondria in aging:Mitochondrial dynamics and more[J].J Cell Sci,2010,123(9):2533-2542.
[5]Claudia Figueroa-Romero,Jorge A,Ifiiguez-Lluhi,et al.SUMOylation of the mitochondrial fission protein Drp l occurs at multiple nonconsensus sites.within the B domain and is linked to its activity cycle[J].FASEB J,2009;23(11):3917-3927.
[6]Verstreken P,Ly CV,Venken,et al.Synaptic mitochondria are critical form obilization of reserve pool vesicles at Drosophila neuromuscular junctions.Neuron,2005,4(7):365-378.
[7]Aurblien Olichon,Laurent Baricault,Nicole Gas,et al.Loss of OPAl Perturbates the Mitochondrial Inner Membrane Structure and Integrity,Leading to Cytochrome C Release and Apoptosis[J].J Biol Chem,2003,278(2):7743-7746.
[8]Sung GC,Du QS,Shuang H,et al.Drp-1dephosphorylation in ATP depletion-induced mitocho-ndrial injury and tubular cell apoptosis[J].Am J Physiol Renal Physiol,2010,299(6):199-206.
[9]Craig B,Sung GC,Wang CY,et al.Mff is an essential factor for mitochondrial recruitmengt of Drp-1during apoptosis[J].Am J Physiol Cell Physiol,2011,300(3);447-455.
[10]Hidenori O,Katsuyoshi M.Molecular mechanisms and physiologic functions of mitochondrial dynamics[J].J Biochem,2011,149(3):241-251.
[11]Wang HM,Precious JL,Mariusz K,et al.Effects of overexpression of huntingtin proteins on mitochondrial integrity[J].Hum Mol Genet,2009,18(4):737-752.
[12]Claudia FR,Jorge AL,Julia S,et al.SUMOylation of the iochon-drial fission protein Drp1occurs at multiple nonconsensus sites within the B domain and is linked to its activity cycle[J].FASEB J,2009,23(11):3917-392.
[13]Frezza C,Cipolat S,Brito OMd,et al.OPA1Controls Apoptotic Cristae Remodeling Independently from Mitochondrial Fusion[J].Cell 2006,15(8):177-189.
[14]Cipolat S,Martins de Brito O,Dal Zilio B,et al.OPA1requires mitofusin 1to promote mitochondrial fusion[J].Proc Natl Acad Sci USA,2004,101(56):15927-15932.
[15]Griparic L,van der Wel NN,Orozco IJ,et al.Loss of the intermembrane space protein Mgm1/OPA1induces swelling and localized constrictions along the lengths of mitochondria[J].J Biol Chem,2004,279(79):18792-18798.
[16]Waterham HR,Koster J,van Roerm and CW,et al.A lethal defect of mitochondrial and peroxisomal fission[J].Nengl Jmed,2007,356(13):1736-1741.

