大鼠急性脑缺血模型中基质金属蛋白酶9和转化生长因子β1的表达及其组织来源分析*
王艳国, 李得春, 胡 海, 张 圆
(包头医学院 1病理生理学教研室, 2第一附属医院检验科,内蒙古 包头 014060)
急性缺血性脑卒中是指各种原因所致脑部血液供应障碍,导致脑组织缺血、缺氧性坏死,出现相应的神经功能缺损症状,其具有发病率高、病死率高与致残率高等特点,严重威胁着人类的健康。缺血性脑卒中的严重并发症之一是出血转化,即脑血管在急性缺血缺氧后,血管内皮细胞坏死,细胞间隙加大,合并局部代谢物蓄积刺激,导致脑血管壁通透性增高,血液成分渗出,严重者甚至发生局部脑血管破裂,并发脑出血,造成更为严重的神经功能损害[1]。但是,出血转化的机制一直不是十分明确,近年来的研究发现基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)的表达与出血性转化相关[2]。
MMP-9是基质金属蛋白酶家族成员之一, 又称为明胶酶B,生理情况下MMP-9主要生物学功能是参与细胞外基质(extracellular matrix,ECM)的降解及重构。脑血管基底膜与间质内的细胞外基质是维持血脑屏障完整的重要结构基础,其细胞外基质的重要成分如胶原、糖蛋白、脂蛋白等均为MMP-9的作用底物,病理情况下MMP-9 可以通过降解细胞外基质使血-脑屏障受损,通透性增加。国外的临床研究[3-4]和我们的前期工作[5]均表明血浆MMP-9 水平升高的缺血性脑卒中患者比MMP-9水平未升高的患者更容易发生出血转化,并且MMP-9 水平高低与发生出血转化的严重程度相关。亦有研究表明,MMP-9基因序列的-474处有转化生长因子 β1(transforming growth factor β1,TGF-β1)抑制元件的序列,TGF-β1可以作用于此,在基因水平抑制MMP-9的转录,从而减少细胞外基质降解,降低出血转化发生率[6]。
但是,目前相关研究对急性缺血性脑卒中MMP-9和TGF-β1表达变化规律尚存争议[7],更重要的是缺血性脑卒中MMP-9和TGF-β1的组织来源尚不清楚,而临床研究多通过采集血样来开展,在确定组织来源方面较为困难。因此,本研究通过建立大鼠急性脑缺血模型,观察急性脑缺血卒中大鼠组织中MMP-9和TGF-β1的表达情况,并对其主要组织来源进行了初步探究;同时在相应时点检测大鼠血浆MMP-9和TGF-β1浓度的动态变化。
材 料 和 方 法
1 动物
10~12周龄、体重280~330 g清洁级雄性Wis-tar大鼠,购于包头医学院动物中心,喂养于本院实验动物中心动物房,给予灭菌处理后的饲料及饮用水,所有动物实验遵照包头医学院实验动物伦理学规定。
2 主要试剂及仪器
TRIzol试剂购自Invitrogen;PrimeScript逆转录试剂盒、RNase Inhibitor 、Oligo d(T)15引物和dNTP Mixture均购自TaKaRa;SYBR Green JumpStartTMTaq购自Sigma;抗大鼠MMP-9和TGF-β1抗体均购自Abcam;大鼠MMP-9和TGF-β1的ELISA检测试剂盒购自BD;7500型Q-PCR仪购自ABI;酶标仪购自BioRad。
3 主要方法
3.1大鼠线栓法急性脑缺血模型的建立 大鼠术前称体重, 按7%水合氯醛5 mL/kg腹腔注射麻醉后, 仰卧位固定于自制的固定板上。实验全部选用左侧大脑中动脉,采用石蜡线栓法建立大鼠永久大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型,按完全随机化原则分为正常对照组、假处理组,每组各18只;急性缺血性卒中6 h、12 h、1 d、3 d、7 d和14 d组,每组6只,共计72只。术后动物苏醒良好,送回动物房保证水粮充足。神经功能评分采用Zealonga 5 分制评分法:0分,不出现神经功能症状;1分,出现左侧Horner;2分,拎起尾巴时,右前爪不能伸直;3分,向右侧转圈;4分,向右侧倾倒;5分,死亡。1~4分视为模型成功。
3.2实时荧光定量PCR检测MMP-9和TGF-β1的表达 分离海马和大脑皮质,分别研磨,加入TRIzol,参照说明书提供的方法抽提总RNA,将提出的脑组织总RNA溶于约10μLDEPCH2O中,总RNA经紫外分光光度计测定浓度,取1μg总RNA在 20μL体系逆转录得到cDNA。在PCR反应管内,先加入模板1μL,然后加入10μmol/L上、下游引物各0.5μL,SYBRGreenreal-timePCRMix10μL,用水补足反应体积至20μL。Q-PCR反应的引物均由宝生物工程(大连)有限公司合成,序列见表1。

表1 定量PCR引物序列
3.3MMP-9和TGF-β1组织化学染色 分别在6 h、12 h、1 d、2 d、6 d和14 d 时,以CO2麻醉法处死大鼠。取各组大鼠脑组织标本置于4%多聚甲醛固定液中浸泡固定24 h后入全自动脱水仪梯度脱水,脱水后用石蜡包埋,并用石蜡切片机对蜡块进行5 μm厚连续冠状切片,置于载玻片上,烤片,常规二甲苯脱蜡,乙醇脱水。用抗大鼠MMP-9和TGF-β1抗体,按照说明书要求进行组织化学原位染色。染色面积的比较通过软件(Image-Pro Plus 6.0)进行定量。
3.4ELISA检测大鼠血浆中MMP-9和TGF-β1麻醉各时点模型大鼠后开腹,从下腔静脉用肝素抗凝采血管抽血5mL,以2 000×g离心20min取上清,用于ELISA检测。根据试剂盒说明书要求操作并且使用酶标仪在450nm波长处测定各孔的A值,MMP-9和TGF-β1的表达水平以ng/L表示。
4 统计学处理
用SPSS 18.0统计软件分析。数据以均数±标准差表示。组间比较采用两个独立样本t检验和单因素方差分析。Real-time PCR结果使用7500 Software V2.0.6软件进行数据处理和分析。以P<0.05为差异有统计学意义。
结 果
1 成功建立大鼠急性脑缺血模型
正常对照组(18只)和假手术组大鼠(18只)清醒后精神、饮食和活动基本正常,均未发现明显神经功能缺损症状和体征, 神经功能评价均为0 分。模型组大鼠清醒后出现精神萎靡、反应迟钝及食欲不振等症状,同时发现大鼠出现不同程度的行走时转圈,身体向一边倾倒,提颈时右侧肢体屈曲,上抬困难甚至右侧偏瘫等神经功能缺损体征,神经功能评价为1~4 分。通过Zealonga 5 分制评分法对缺血组大鼠进行神经功能评分,结果为: 1分10只,2分13只,3分12只,4分1只。
2 Real-time PCR 检测缺血大鼠脑组织中MMP-9和TGF-β1的表达
正常对照组与假处理组所表达的MMP-9水平差别没有统计学意义。与假处理组大鼠相比,MMP-9 mRNA水平在急性缺血6 h即开始升高,到急性缺血2 d时最高,缺血各组分别与假处理组样本相比,差异均有统计学意义,见图1。而TGF-β1mRNA水平在急性缺血12 h开始升高,到急性缺血6 d时达到最高水平,之后直到14 d TGF-β1mRNA的表达水平缓慢回落。正常对照组与假处理组所表达的TGF-β1水平差别没有统计学意义。与假处理组样本相比,缺血时间为12 h、1 d、2 d、6 d和14 d的样本差异有统计学意义,见图2。正常对照组与假处理组所表达的TGF-β1水平差异没有统计学意义。

Figure 1. The mRNA level of MMP-9 in the brain of sham rats and acute cerebral ischemia rats.Mean±SD.n=6. *P<0.05, **P<0.01 vs sham.
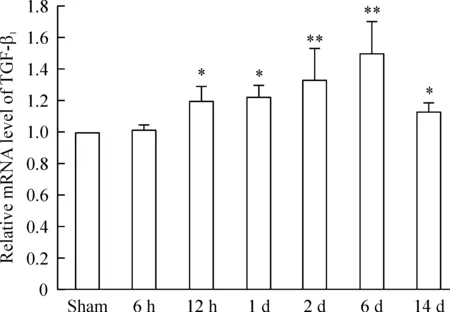
Figure 2. The mRNA level of TGF-β1 in the brain of sham rats and acute cerebral ischemia rats.Mean±SD.n=6.*P<0.05, **P<0.01 vs sham.
3 组织化学染色观察缺血大鼠脑组织中 MMP-9和TGF-β1的表达
对正常对照组、假处理组、急性脑缺血后6 h、12 h、1 d、2 d、6 d和14 d 采集的大脑切片,进行MMP-9组织化学染色后发现,正常对照组和假处理组样本上基本没有MMP-9表达,而从急性脑缺血后1 d起,大脑的皮质和海马区域开始有MMP-9表达。急性脑缺血后2 d左右,大脑皮质的MMP-9表达最高,对大脑皮质和海马区域的MMP-9的阳性面积进行定量分析,发现其远高于假处理组(皮质1.76%±0.51%vs8.66%±2.08%;海马2.83%±0.50%vs14.67%±4.04%),见图3。而TGF-β1组织化学染色后发现:在急性缺血2 d后皮质和海马区域开始能观察到TGF-β1表达,6 d时最明显(皮质1.26%±0.49%vs8.33%±2.56%;海马1.54%±0.49%vs11.67%±3.05%),之后开始减少,见图4。

Figure 3. The expression of MMP-9 in rat brains 2 d after acute cerebral ischemia.Scale bar=500 μm.Mean±SD.n=6.**P<0.01 vs sham.

Figure 4. The expression of TGF-β1 in rat brains 2 d after acute cerebral ischemia. Scale bar= 500 μm.Mean±SD.n=6.**P<0.01 vs sham.
4 ELISA检测大鼠血浆中MMP-9和TGF-β1
ELISA结果显示缺血后12 h,血浆中即可检测到MMP-9和TGF-β1的表达。与假处理组相比,缺血1 d时2种蛋白的表达差异有统计学意义,见图5、6。
讨 论
急性缺血性脑卒中现在已经是心脑血管系统的常见病,多发病。临床常常采用溶栓药物加以治疗,以求改善被栓塞区脑组织的功能。但是,部分急性脑缺血卒中患者常常伴发出血转化,如果这部分人群给予溶栓治疗,则会导致脑缺血向脑出血转化,加重病人的组织损伤,影响神经功能。因此,探究急性脑缺血后出血转化的机制和动态变化规律,对于阐明相关病理过程,优化治疗策略,具有积极意义。
我们的前期工作通过采集多例发生了出血转化和未出现出血转化的急性脑缺血性卒中病人的血浆[4],发现了MMP-9的血浆水平和出血转化之间具有一定联系,提示血浆MMP-9浓度高的患者更倾向于发生出血转化。但是,收到临床工作的实际和医学伦理学的限制,未能对MMP-9的浓度进行多时点的动态观察。其次,急性缺血性脑卒中患者体内MMP-9的组织来源问题一直未见明确报道,而动物实验有利于明确脑组织原位MMP-9表达情况。再次,有研究表明,在急性缺血性脑卒中时,TGF-β1可能与MMP-9的表达具有相关性,但是也缺乏体内实验研究的结果[8]。
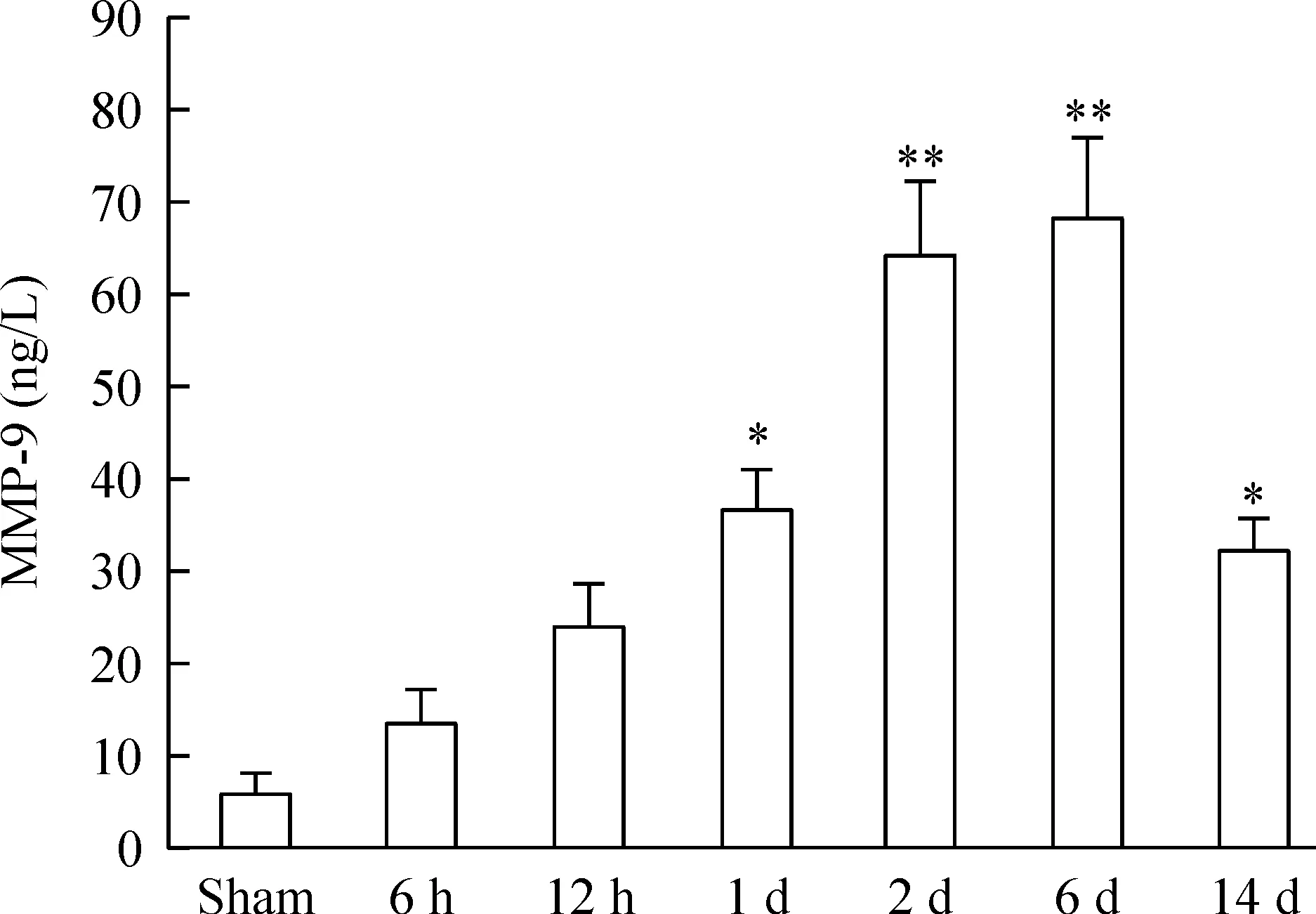
Figure 5. The MMP-9 expression in the plasma of sham rats and acute cerebral ischemia rats.Mean±SD.n=6.*P<0.05, **P<0.01 vs sham.
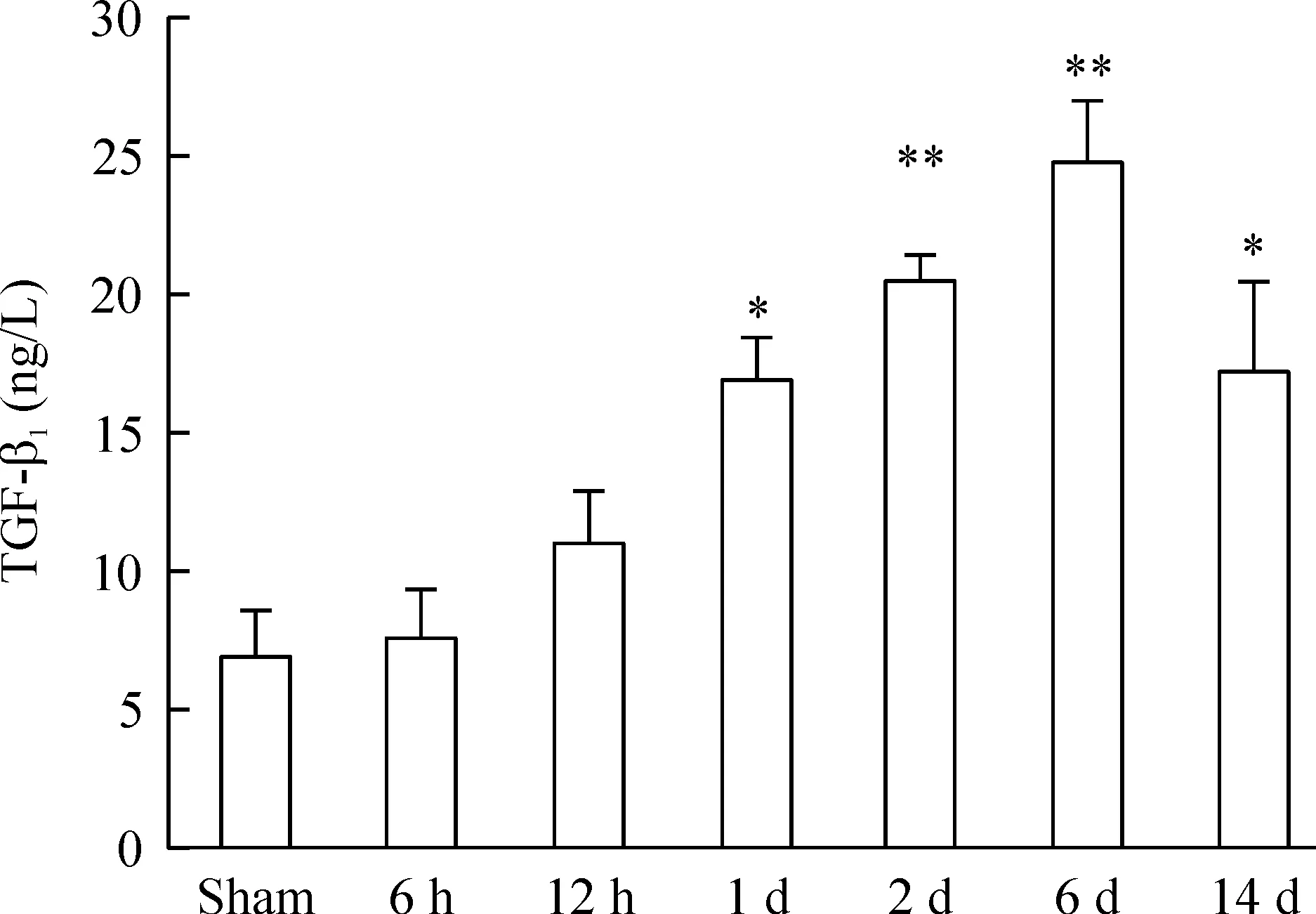
Figure 6. The TGF-β1 expression in the plasma of sham rats and acute cerebral ischemia rats.Mean±SD.n=6.*P<0.05, **P<0.01 vs sham.
血-脑屏障主要由脑毛细血管内皮细胞、血管基底膜及胶质细胞终足构成,血管基底膜与间质内的细胞外基质是维持血脑屏障完整的重要结构基础。脑组织中MMP-9的水平升高可以通过降解细胞为基质,直接增加血脑屏障的通透性,其病理意义比血浆中MMP-9含量的意义更为重要。本研究首先成功建立了大鼠急性脑缺血模型,然后通过组织化学染色,发现建模后12 h,动物的大脑皮质和海马即可有MMP-9表达,而以2 d时最为明显,而对其脑组织的MMP-9 mRNA水平进行分析,发现其在缺血后6 h即开始上升,该结果与组织化学染色结果相互印证。血清中的MMP-9在缺血1 d左右显著升高,缺血6 d达到最高峰。
TGF-β1是具有多重调节功能的细胞转化生长因子, 其生物学作用复杂多样,并依据不同的细胞类型和病理环境而发生变化。传统观点认为TGF-β1可促进神经元生存,促进其分化, 增加神经元的轴突数目, 并具有加速神经组织修复的作用[6]。在本研究中,TGF-β1的表达与MMP-9的表达具有一定相关性,具体表现为MMP-9在急性脑缺血早期出现,然后缓慢回落。而TGF-β1在急性脑缺血后出现的时间晚于MMP-9,然后在缺血6 d 时上升到一较高水平然后回落,其内在机制仍有待进一步研究。血清中的TGF-β1在缺血1 d 左右即显著升高,在缺血后6 d 达到峰值。但是,MMP-9的回落是否和TGF-β1相关,仍有待进一步研究。
[参 考 文 献]
[1]JicklingGC,LiuD,StamovaB,etal.Hemorrhagictransformationafterischemicstrokeinanimalsandhumans[J].JCerebBloodFlowMetab, 2014, 34(2):185-199.
[2] Silva Y, Leira R, Tejada J, et al. The role of matrix metalloproteinases in human cerebral stroke[J]. Stroke, 2005, 36(1):86-91.
[3]MontanerJ,MolinaCA,MonasterioJ,etal.Matrixmetalloproteinase-9pretreatmentlevelpredictsintracranialhemorrhagiccomplicationsafterthrombolysisinhumanstroke[J].Circulation, 2003, 107(4):598-603.
[4] Jha R, Battey TW, Pham L, et al.Fluid-attenuated inversion recovery hyperintensity correlates with matrix metalloproteinase-9 level and hemorrhagic transformation in acute ischemic stroke[J]. Stroke, 2014, 45(4):1040-1045.
[5] 王艳国, 刘国荣, 李得春. 血浆基质蛋白酶-9 预测急性缺血性脑卒中出血转化的研究[J].包头医学院学报,2011, 27(4):23-25.
[6] Bain JM,Ziegler A,Yang Z,et al. TGF beta1stimulates the over-production of white matter astrocytes from precursors of the brain marrow in a rodent model of neonatal encephalopathy[J].PLoS One, 2010, 5(3) :e9567.
[7] 汪顺清,赵 峰,黄 立, 等. 急性缺血性脑卒中患者外周血Foxp3表达与TGF-β1的变化[J]. 医学临床研究, 2007,12(24):2023-2026.
[8] Jia F, Pan YH,Mao Q,et al. Matrix metalloproteinase-9 expression and protein levels after fluid percussion injury in rats the effect of injury severity and brain temperature[J]. J Neurotrauma,2010,27(6):1059-1068.

