经皮冠状动脉介入术前他汀再负荷对围术期循环内皮祖细胞及炎症因子的影响
贺甫威, 叶红华, 费晓红, 楼燕如, 王世奇, 杨 锐, 胡烨文, 陈晓敏
(宁波市第一医院心内科,浙江 宁波 315010)
内皮祖细胞(endothelial progenitor cells,EPCs)为血管内皮细胞的前体细胞,由骨髓动员到外周血中。它们具有一定的扩增能力及分化潜能,在胚胎期参与血管的形成,出生后可参与受损血管的修复[1-2]。冠心病的本质上是一种血管疾病,由于内皮祖细胞参与血管内皮修复,因此在冠心病发生发展中循环内皮祖细胞的缺乏可能起到重要作用[3]。他汀类药物也称3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)还原酶抑制剂,具有竞争性抑制细胞内胆固醇合成早期过程中限速酶的活性,继而上调细胞表面低密度脂蛋白(low-density lipoprotein,LDL)受体,加速血浆LDL的分解代谢,降低血浆中LDL;此外,还具有抑制平滑肌细胞增殖、抑制血小板聚集、抗炎及稳定斑块的作用[4-7];在临床上已被广泛应用于抗动脉粥样硬化。近年来,以ARMYDA系列研究为代表的他汀类药物对经皮冠状动脉介入术(percutaneous coronary intervention,PCI)围术期干预的相关研究提示术前强化他汀负荷治疗或长期服用他汀治疗的患者术前再负荷可显著降低围术期心梗等主要心血管不良事件[8]。然而在不同的研究中他汀再负荷的方案大不相同,同时不同他汀的负荷方案对他汀多效性影响的研究较少。因此,我们比较了3种PCI术前阿托伐他汀再负荷方法对长期服用他汀的稳定性冠心病患者围术期循环内皮祖细胞及炎症因子的影响。
材 料 和 方 法
1 主要试剂
血清肌钙蛋白I(troponin I,TnI)检测试剂盒(Beckman Coulter); C反应蛋白(C-reactive protein,CRP)由SYNCHRON System测定 (Beckman Coulter);可溶性细胞间附分子Ⅰ (soluble intercellular adhesion molecule 1,sICAM-1) ELISA 试剂盒(Bender);藻红蛋白(phycoerythrin,PE)标记的小鼠抗人CD133/AC133和CD144单克隆抗体(Miltenyi Biotec);藻红蛋白-花青素5(phycoerythrin and cyanidin 5,PC5)标记的鼠抗人CD45单克隆抗体(Beckman Coulter);别藻蓝蛋白(allophycocyanin,APC)标记的鼠抗人CD34单克隆抗体(Miltenyi Biotec);FITC标记的小鼠抗人VEGFR-2/KDR单克隆抗体和流式检测专用红细胞裂解液(R&D)。
2 患者资料
45例长期服用他汀的并选择择期行PCI的稳定性冠心病患者随机分成3组。稳定性冠心病患者定义为:由于运动或其它增加心肌需氧量的情况所诱发的短暂胸痛发作,休息或舌下含服硝酸甘油后疼痛常可迅速消失且病程稳定在1个月以上[9]。入选标准:45岁以上80岁以下男性及绝经后女性;长期接受他汀治疗(>8周),接受择期PCI术。排除标准:急性冠脉综合征,糖尿病,ALT/AST大于正常上限,肌酐>30 mg/L,左心室射血分数<30%,具有明确感染灶的急慢性感染,血液系统疾病,肿瘤,全身免疫性疾病。
3 方法
3.1分组 45例符合入排标准的患者随机分成3组。所有患者 PCI术前1 h、术后1 h、术后6 h及术后24 h分别留取外周血用于EPCs测定。PCI术前即刻及术后24 h测定TnI水平;按照2012年发布的第三版全球心肌梗死定义中PCI相关心肌梗死的定义为PCI术后肌钙蛋白较99%正常上限值升高达5倍[10]。sICAM-1与CRP是被认为与冠心病相关的炎症因子,我们分别于PCI术前即刻及术后24 h测定这2种蛋白的外周血水平。临床随访了PCI术后30 d的主要不良心脏事件(major adverse cardiac events,MACEs),包括死亡、非致死性心肌梗死和靶血管血运重建事件。
3.2内皮祖细胞检测 将所采集的3mL静脉全血标本各取100μL,分别加入4管BD公司流式细胞仪专用检测管中;各加入5μL胎牛血清,室温条件下孵育15min以阻断Fc片段。随机抽取1管作阴性对照,抽取第2管中加入10μL由PE标记的CD133/AC133抗体及10μL由FITC标记的VEGFR-2/KDR抗体,在第3管中加入10μL由FITC标记的VEGFR-2/KDR抗体及由APC标记的CD34抗体,最后1管中加入10μL由FITC标记的VEGFR-2/KDR抗体及PE标记的CD144抗体,最后在所有检测管中加入PC5标记的CD45抗体5μL,混匀后置于4 ℃冰箱中避光孵育45min。混匀后加入流式细胞仪检测专用红细胞裂解液裂解红细胞,振荡混匀,置于37 ℃恒温箱中避光放置10min,接着以1 500r/min离心5min后弃上清;再加入3mLPBS,混匀后以1 500r/min再次离心5min,弃上清,加入500μLPBS液,充分振荡混匀,最后利用FACSCalibur流式细胞仪分别检测分析100μL中CD45-/CD133+/CD34+标记细胞CD45-/CD34+/KDR+以及CD45-/CD144+/KDR+标记细胞的总数来代表外周血EPCs数量。
4 统计学处理
所有资料利用SPSS 16.0软件进行数据处理,计量资料以均数±标准差(mean±SD)表示,组间均数比较采用方差分析;计数资料比较采用卡方检验;对有相关趋势的变量进行相关分析。以P<0.05为差异有统计学意义。
结 果
1 基本情况的比较
3组患者组间基线特征匹配良好,无显著差异,见表1;PCI治疗及术后MACEs发生情况统计均无明显差异,见表2。
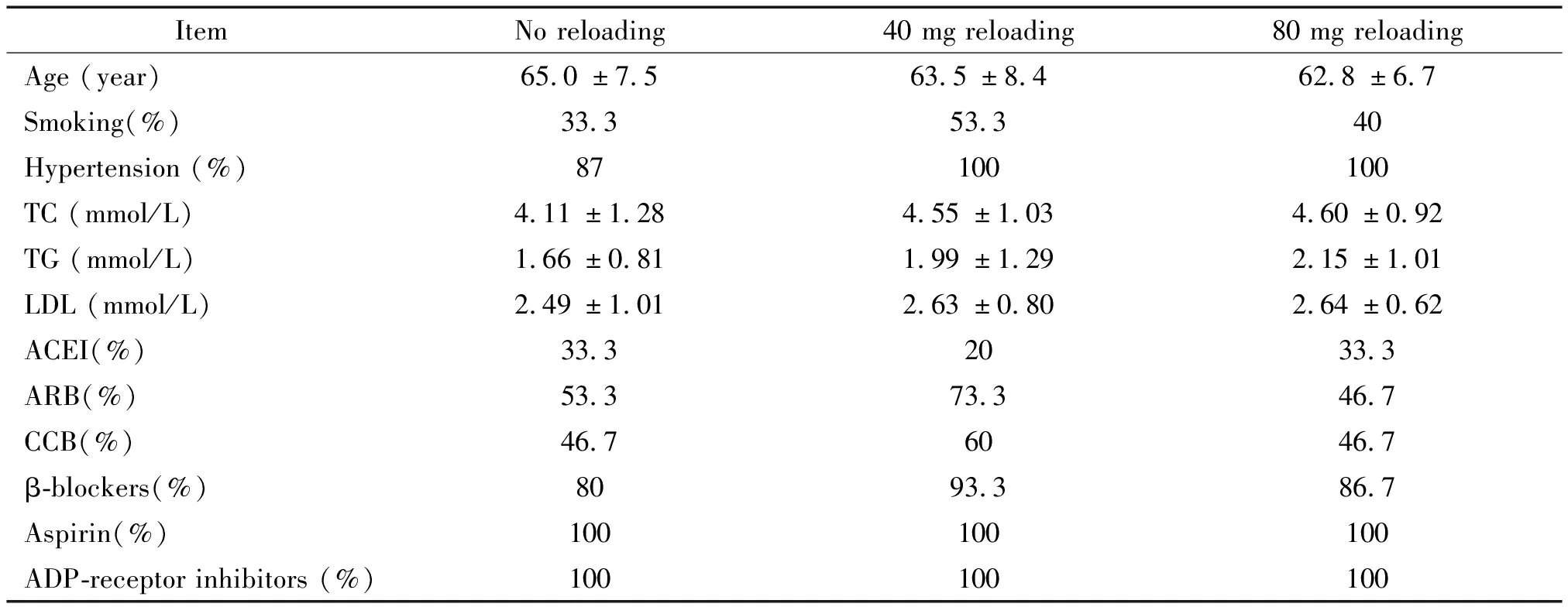
表1 患者临床基线资料

表2 3组患者PCI治疗及MACE事件
MACEs included death in 30 d after PCI, non-fatal myocardial infarction and target vessel revascularization.
2 PCI术前与术后内皮祖细胞的变化
在80 mg再负荷组,标记为CD45-/CD133+/CD34+和CD45-/CD34+/KDR+的EPCs 术后1 h及术后6 h与术前相比明显升高(P<0.05),见表3。80 mg再负荷组标记为CD45-/CD133+/CD34+的 EPCs 术后1 h及术后6 h较术前相比分别升高了1.6倍及1.3倍。标记为CD45-/CD34+/KDR+的EPCs术后1 h及术后6 h较术前相比分别升高了1.4倍和1.7倍。标记为CD45-/CD144+/KDR+的EPCs水平术后较术前无显著差异。对照组及40 mg再负荷组患者术前与术后外周血内皮祖细胞水平的比较无显著差异,见表3。80 mg再负荷组标记为CD45-/CD133+/CD34+及 CD45-/CD34+/KDR+的EPCs 在术后6 h达到最高峰,并且在术后24 h恢复到术前水平。对照组及40 mg再负荷组,大部分患者的内皮祖细胞水平术后1 h达到最高峰并且基本维持在这一水平。
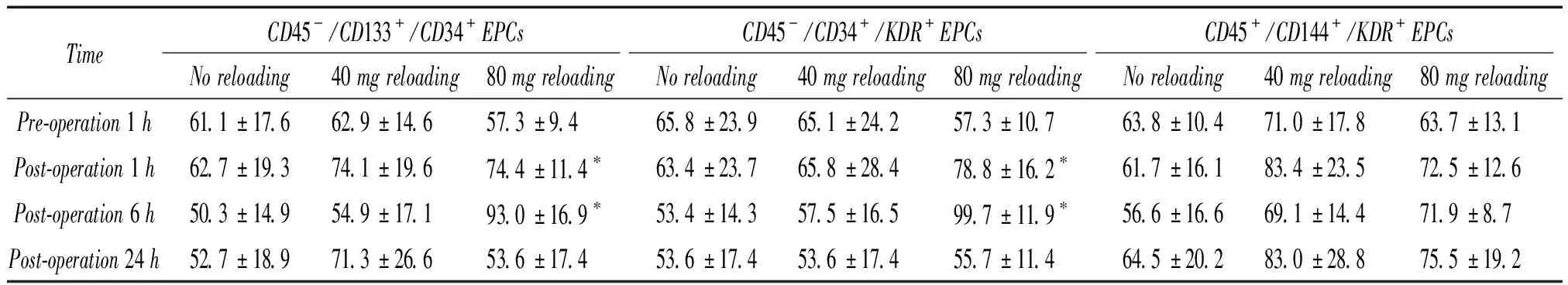
表3 3组患者不同抗体标记的内皮祖细胞PCI术前及术后不同时点的变化情况
*P<0.05 vspre-operation.
3 PCI术前与术后sICAM-1 与CRP的变化
3组患者术后sICAM-1及CRP水平均较术前升高,其中无负荷组升高最为明显,与术前相比差异显著(P<0.05);40 mg再负荷组和80 mg再负荷组术后sICAM-1及CRP水平虽有升高,但与术前比较无显著差异,见表4。另外,他汀的剂量增加伴随着术后炎症因子水平的下降,提示大剂量他汀再负荷治疗可以减少围术期血浆炎症水平。

表4 3组患者PCI术前与术后sICAM-1 及CRP的变化情况
*P<0.05vspre-operation.
4 PCI术前与术后血清TnI的变化
在3组患者中术后血清TnI水平均较术前显著增加,差异有统计学意义。但他汀再负荷组,围术期的心肌损伤较对照组存在减轻趋势。80 mg再负荷组术后血清TnI增加水平与对照组相比明显减少,见表5。按照2012年发布的第三版全球心肌梗死定义中PCI相关心肌梗死的定义(PCI术后肌钙蛋白较99% 正常上限值升高达5倍),无他汀负荷组为8例,40 mg他汀负荷组为6例,80 mg他汀负荷组为3例;他汀再负荷组较无他汀负荷组发生围术期心肌梗死呈减少趋势。

表5 3组患者PCI术前术后TnI水平的比较
*P<0.05vspre-operation.
讨 论
冠心病患者往往合并存在内皮祖细胞动员减少及功能下降[11-14]。ARMYDA-RECAPTURE研究证实PCI术前他汀再负荷治疗可以减轻围术期心肌损伤。同时Vasa等[16]的研究显示在冠心病患者服用阿托伐他汀(40 mg/d)治疗4周后,外周血内皮祖细胞数量较服用前显著增加。然而Hristov等[17]的研究显示长期(大于8周)应用他汀治疗可降低外周血内皮祖细胞数量。上述不同发现使我们想到是否因为长期他汀治疗使内皮祖细胞对常规剂量他汀治疗不再敏感; 也可能是因为长期他汀治疗使结合内皮祖细胞的整联蛋白正向调节,这就要求更大剂量的他汀类药物以促进内皮祖细胞的动员;最后PCI术前他汀如何治疗可以使获益最大化需要进一步研究来探讨。
EPCs是人体生理或病理过程中一群动态演变的细胞系列。在体外培养中,附着在培养皿表面的EPCs从椭圆形逐渐变成纺锤形,随着内皮祖细胞的分化和成熟,EPCs开始表达特定的内皮细胞标志物,这使得他们能够从其它的各种干细胞和骨髓细胞中成熟的内皮细胞类型区分开来。以CD34+/CD133+/KDR+来标记内皮祖细胞是目前主要一种方式。体外标记为CD133+的细胞在外周血中可被诱导分化成内皮细胞,此时它们不再表达CD133,因此CD133的表达是内皮祖细胞的特定标签,并可以使内皮祖细胞从成熟内皮细胞中区分出来。CD34被认为是造血干/祖细胞的标志物,但标记为CD34-的EPCs亚群也有报道[18]。KDR是表达在成熟内皮细胞和内皮祖细胞细胞膜上的酪氨酸激酶受体。然而,内皮祖细胞不表达血管性血友病因子(vWF)和血管内皮钙黏蛋白(CD144)[11]。随着内皮祖细胞分化和成熟,vWF及CD144的表达增强,CD133的表达降低。一旦内皮祖细胞分化为成熟的内皮细胞,CD133的表达缺失。最后,CD45是白细胞的表面标记,在内皮祖细胞中基本不表达。因此,将不同的表面比较组合起来可以区分不同分化阶段的内皮祖细胞。因此本研究中检测分别代表祖细胞(CD45-/CDl33+/CD34+标记细胞),分化较早期的EPCs (CD45-/CD34+/ KDR+标记细胞)和分化较晚期的EPCs(CD45-/CD144+/ KDR+标记细胞)系列以期较为全面地反映EPCs在PCI围术期的的变化。
在我们的研究中,2种他汀再负荷治疗方案均能减少患者围术期心肌损伤,但是术前12 h服用80 mg阿托伐他汀及术前2 h追加40 mg阿托伐他汀再负荷方案较无他汀负荷组围术期心肌损伤的减少显著(P<0.05),而PCI术前连续7 d服用40 mg阿托伐他汀再负荷治疗与无负荷组比较,围术期心肌损伤仅呈减少趋势。我们的研究显示在无他汀负荷组患者中长期他汀治疗的围术期循环内皮祖细胞的水平并不增高,但PCI术前给予短期大剂量阿托伐他汀治疗的患者可以提高围术期循环分化较早期内皮祖细胞的水平。上诉研究结果表明在长期服用他汀治疗的患者中PCI术前短期大剂他汀治疗可以动员骨髓内皮祖细胞。我们研究的局限性是一个相对较小的样本规模和缺乏对EPCs的功能研究。此外,围PCI手术期心肌缺血可能通过活化血管内皮生长因子刺激内皮祖细胞活化;其它PCI相关病理生理改变特别是在对照组中EPCs活化可能影响了血清sICAM-1和CRP血清水平。另外,PCI术中心肌缺血可能通过刺激血管内皮生长因子的释放而动员内皮祖细胞的同时也会带来其它的病理生理改变特别是在对照组中出现的sICAM-1及CRP水平的升高。
总之,我们的研究结果提示PCI术前短期大剂量再负荷治疗可以提高长期服用他汀治疗的稳定性冠心病患者PCI治疗效果。PCI术前短期接受大剂量他汀再负荷治疗的稳定性冠心病患者外周血分化较早期的内皮祖细胞显著升高并且心肌损伤指标血清TnI显著降低。阿托伐他汀是我们的研究中唯一用到的他汀并且样本量较小,在以后的研究中可以增加样本量同时可以使用其它种类的他汀来观察是否有类似作用。
致谢: 感谢宁波市第一医院实验室周影在流式细胞仪应用方面的指导,感谢陈莹在本实验期间提供的帮助。
[参 考 文 献]
[1]PellicciaF,PasceriV,RosanoG,etal.Endothelialprogenitorcellspredictlong-termprognosisinpatientswithstableanginatreatedwithpercutaneouscoronaryintervention[J].CircJ, 2013, 77(7):1728-1735.
[2] Wojakowski W, Pyrlik A, Król M, et al. Circulating endothelial progenitor cells are inversely correlated with in-stent restenosis in patients with non-ST-segment elevation acute coronary syndromes treated with EPC-capture stents (JACK-EPC trial)[J]. Minerva Cardioangiol, 2013, 61(3):301-311.
[3]VanCraenenbroeckEM,DenolletJ,PaelinckBP,etal.CirculatingCD34+/KDR+endothelialprogenitorcellsarereducedinchronicheartfailurepatientsasafunctionofTypeDpersonality[J].ClinSci(Lond), 2009, 117(4):165-172.
[4] Nawawi H, Osman NS, Annuar R, et al. Soluble intercellular adhesion molecule-1 and interleukin-6 levels reflect endothelial dysfunction in patients with primary hypercholesterolaemia treated with atorvastatin[J]. Atherosclerosis, 2003, 169(2):283-291.
[5]PääjärviG,RoudierE,CrisbyM,etal.HMG-CoAreductaseinhibitors,statins,inducephosphorylationofMdm2andattenuatethep53responsetoDNAdamage[J].FASEBJ, 2005, 19(3):476-478.
[6] Pollack CV Jr, Hollander JE, Chen AY, et al. Non-ST-elevation myocardial infarction patients who present during off hours have higher risk profiles and are treated less aggressively, but their outcomes are not worse: a report from Can Rapid Risk Stratification of Unstable Angina Patients Suppress ADverse Outcomes with Early Implementation of the ACC/AHA Guidelines CRUSADE initiative[J]. Crit Pathw Cardiol, 2009, 8(1):29-33.
[7]Zapolska-DownarD,SiennickaA,KaczmarczykM,etal.SimvastatinmodulatesTNFα-inducedadhesionmoleculesexpressioninhumanendothelialcells[J].LifeSci, 2004, 75(11):1287-1302.
[8] Pasceri V, Patti G, Nusca A, et al. Randomized trial of atorvastatin for reduction of myocardial damage during coronary intervention: results from the ARMYDA (Atorvastatin for Reduction of My ocardial Damage during Angioplasty) study[J]. Circulation, 2004, 110(6):674-678.
[9]JISFC-WHO.Nomenclatureandcriteriafordiagnosisofischemicheartdisease.Reportofthejointinternationalsocietyandfederationofcardiology/worldhealthorganizationtaskforceonstandardizationofclinicalnomenclature[J].Circulation, 1979, 59(3):607-609.
[10] Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction[J]. J Am Coll Cardiol, 2012, 60(16):1581-1598.
[11]YeJ,NiP,KangL,etal.Apelinandvascularendothelialgrowthfactorareassociatedwithmobilizationofendothelialprogenitorcellsafteracutemyocardialinfarction[J].JBiomedRes, 2012, 26(6):400-409.
[12] Padfield GJ, Tura-Ceide O, Freyer E, et al. Endothelial progenitor cells, atheroma burden and clinical outcome in patients with coronary artery disease[J]. Heart, 2013, 99(11):791-798.
[13]ScacciatellaP,D’AmicoM,PennoneM,etal.EffectsofEPCcapturestentandCD34+mobilizationinacutemyocardialinfarction[J].MinervaCardioangiol, 2013, 61(2):211-219.
[14] Scalone G, De Caterina A, Leone AM, et al. Effect of exercise on circulating endothelial progenitor cells in microvascular angina[J]. Circ J, 2013, 77(7):1777-1782.
[15]DiSciascioG,PattiG,PasceriV,etal.Efficacyofatorvastatinreloadinpatientsonchronicstatintherapyundergoingpercutaneouscoronaryintervention:resultsoftheARMYDA-RECAPTURE(AtorvastatinforReductionofMyocardialDamageDuringAngioplasty)RandomizedTrial[J].JAmCollCardiol, 2009, 54(6):558-565.
[16] Vasa M, Fichtlscherer S, Adler K, et al. Increase in circulating endothelial progenitor cells by statin therapy in patients with stable coronary artery disease[J]. Circulation, 2001, 103(24):2885-2890.
[17]HristovM,FachC,BeckerC,etal.Reducednumbersofcirculatingendothelialprogenitorcellsinpatientswithcoronaryarterydiseaseassociatedwithlong-termstatintreatment[J].Atherosclerosis, 2007, 192(2):413-420.
[18] Krichevsky AM, Sonntag KC, Isacson O, et al. Specific microRNAs modulate embryonic stem cell-derived neurogenesis[J]. Stem Cells, 2006, 24(4):857-864.

