新型卟啉化合物抗肿瘤细胞增殖作用筛选及机理
郝 顺,张丹丹,梅文杰,林 严,李文娜
(1.遵义医学院珠海校区 药理学教研室,广东 珠海 519041;2.广东药学院 药学系,广东 广州 510006)
光动力学疗法(Photodynamic therapy, PDT)是除手术、放疗以及化疗之外的又一种治疗恶性肿瘤的方法,具有特异性高、无依赖性、毒副作用小以及对正常组织无损伤等特点[1],现已广泛应用于临床。当光敏剂进入患者体内,能动态地浓集于生长异常的组织,再经一定波长的光辐射后,发生光动力敏化反应产生单线态氧等活性物质,从而导致生物大分子氧化失活而引起细胞凋亡,达到治疗的目的[2]。而光敏剂是PDT中最关键的因素,目前应用最广泛的光敏剂是卟啉类化合物[3],其作为光敏药物用于临床已有20余年历史,除代表性的血卟啉衍生物(HpD)、原卟啉IX等,人工合成的金属卟啉化合物也因其具有独特的结构与生物功能在医学研究上取得了较大进展。
本研究将对新合成的6种金属卟啉化合物的抗肿瘤作用进行细胞水平的筛选,并研究其作用机理,为该类化合物的后继开发合成提供理论依据。
1 材料与方法
1.1 实验细胞 肝癌细胞(HepG2)、肺癌细胞(A549)和乳腺癌细胞(MCF-7),均由遵义医学院珠海校区中心实验室提供。
1.2 药品与试剂药品 Rup-03、Rup-04、 HDW-01、HDW-02、HDW-03以及HDW-04均由广东药学院梅文杰教授合成并馈赠,药物结构图(见图1)。
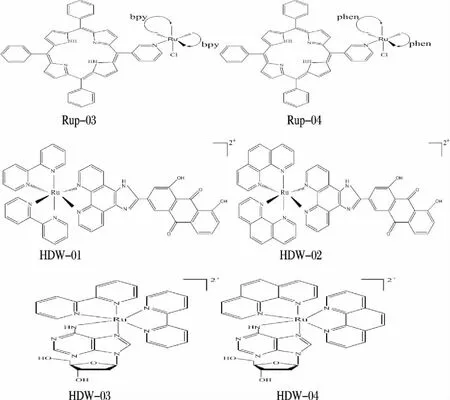
图1 6种药物的药物结构图
其他主要试剂:Annexin V-FITC/PI细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司,批号:130521);RPMI1640培养基(美国Gibco,批号:1279327);小牛血清(杭州四季青生物工程材料有限公司,批号:130902);胰蛋白酶 (国药集团,批号:20070719);MTT(Sigma,批号:2497b516);SRB(广州威佳科技有限公司,进口分装);Giemsa (天津市天新精细化工开发中心,批号:20080705);其余试剂均为分析纯。
1.3 主要仪器 超净工作台SW-CJ-ZF型(苏州苏洁净化设备有限公司);CO2培养箱-HF90/HF240型(上海利康瑞生物工程有限公司);倒置显微镜(德国,Leica-351);Elx-800型全自动酶标仪(德国,Leica);流式细胞仪CUBE6(德国Partec公司);全自动凝胶成像分析系统(美国Bio-RAD公司);电子分析天平BSA124S(德国Sartorius);高速离心机(安徽中科中佳科学仪器有限公司);UV-7501分光光度计(无锡科达仪器厂)。
1.4 细胞培养 将冻存细胞复苏,接种于含10%小牛血清、1%双抗(100U/mL青霉素和100 μg/mL链霉素)的RPMI-1640培养基的培养瓶中,置37 ℃、5% CO2培养箱内孵育,待细胞长至80%~90%时传代培养。
1.5 药物干预及光动力学处理 按最佳光照及培养时间加药干预细胞[4],即取处于对数增长期的细胞接种在培养板里,细胞密度调整为96孔培养板:4×104~5×104个/mL;24孔培养板:5×104~105个/mL;6孔培养板:1.2×105~2×105个/mL,待细胞生长至90%时加入药物培养24h,100 W 普通白炽灯光照2 h,继续放入培养箱中培养12 h。
1.6 SRB法和MTT法测定药物对细胞增殖的影响 取处理后的细胞,采用SRB和MTT法[5]测定药物对细胞增殖的影响,并按下公式计算肿瘤细胞的生长抑制率。

1.7 Griess法测定细胞上清液中NO自由基的含量[6]取处理后的细胞上清液100 μL于96孔板,加入等量Griess试剂,轻轻振荡数次,待反应液完全混匀后,于540 nm处检测各孔OD值。以亚硝酸钠做标准曲线(y=364.3518x-3.2530,R2=0.999 1),并计算细胞中的NO自由基的浓度。
1.8 Giemsa染色观察细胞形态 取处理后的细胞,用甲醇固定细胞10 min 。加入Giemsa染液染色20 min。弃染液,用三蒸水冲去板上多余的染料,空气中自然干燥。于倒置显微镜观察染色结果。
1.9 流式细胞仪检测细胞凋亡 按照Annexin V-FITC/PI细胞凋亡检测试剂盒方法处理细胞并进行流式细胞仪的观察和检测。
1.10 DNA 完整性检测 根据试剂盒方法提取肿瘤细胞DNA,应用DNA核酸染料GoldView[7]进行琼脂糖凝胶电泳检测,采用凝胶成像系统观察条带,拍照记录。

2 结果
2.1 药物对细胞增殖的影响 由表1~3可见,6种药物对各肿瘤细胞的生长均具有一定的抑制作用,各药的IC50数值分别为:Rup-03 IC50 = 2.95 × 10-5mol/L, Rup-04 IC50 = 41.59 mol/L,HDW-01 IC50 = 1.26 × 10-6mol/L,HDW-02 IC50 = 6.57 × 10-6mol/L,HDW-03 IC50 = 1.07 × 10-3mol/L和HDW-04 IC50 = 8.21 × 10-5mol/L。

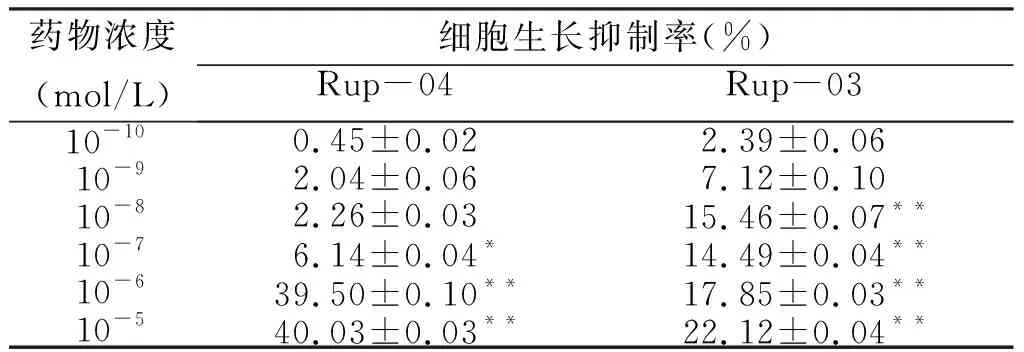
药物浓度(mol/L)细胞生长抑制率(%)Rup-03Rup-0410-100.45±0.022.39±0.0610-92.04±0.067.12±0.1010-82.26±0.0315.46±0.07**10-76.14±0.04*14.49±0.04**10-639.50±0.10**17.85±0.03**10-540.03±0.03**22.12±0.04**
与空白组比较,*P<0.05,**P<0.01。

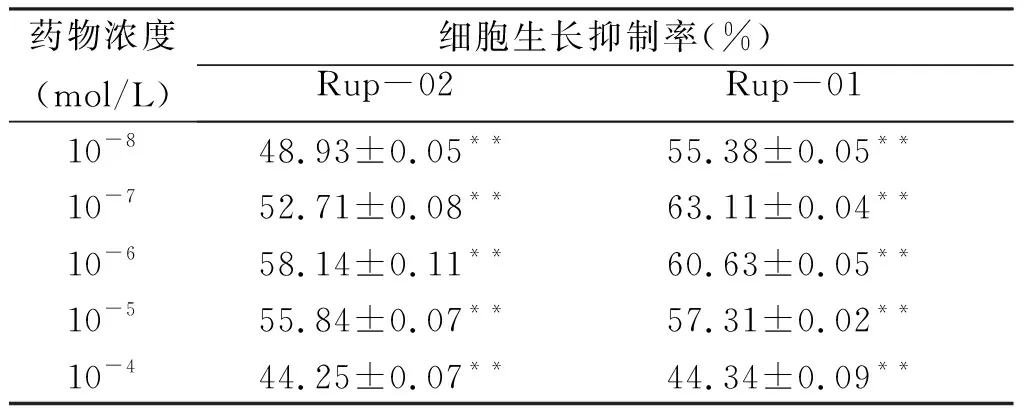
药物浓度(mol/L)细胞生长抑制率(%)Rup-01Rup-0210-848.93±0.05**55.38±0.05**10-752.71±0.08**63.11±0.04**10-658.14±0.11**60.63±0.05**10-555.84±0.07**57.31±0.02**10-444.25±0.07**44.34±0.09**
与空白组比较,**P<0.01。


药物浓度(mol/L)细胞生长抑制率(%)Rup-03Rup-0410-817.85±0.2710.56±0.1210-726.78±0.13*28.78±0.10**10-632.24±0.11**33.15±0.04**10-536.43±0.10**37.52±0.07**10-443.35±0.04**49.92±0.19**
与空白组比较,*P<0.05,**P<0.01。
2.2 药物对HepG2细胞上清液中NO自由基含量的影响 由图2可以见随药物浓度增加,细胞上清液中NO的量随之增多,呈浓度-效应关系。
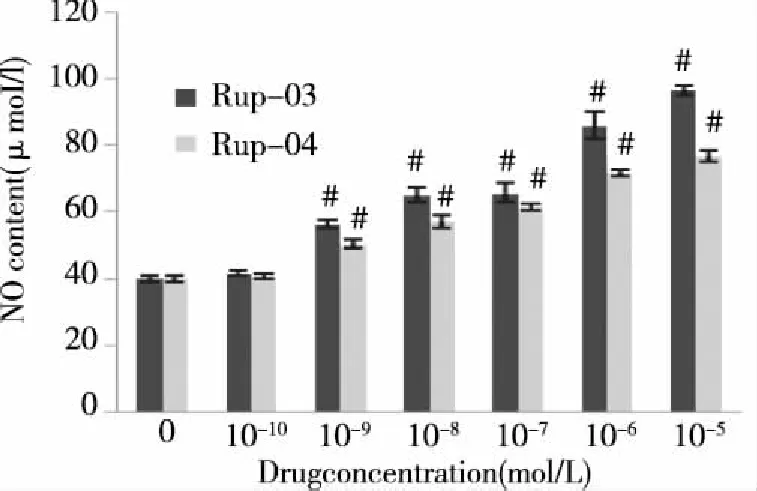
与各组空白组比较#P<0.01。图2 Rup-03和Rup-04对HepG2细胞NO含量变化的影响
2.3 Giemsa染色法观察Rup-03对HepG2细胞形态的影响 采用Giemsa法观察Rup-03(10-10~10-5mol/L)对HepG2细胞的影响,如图3A可见,光镜下为加药的HepG2细胞呈梭形或多边形生长,细胞大小均一、轮廓清晰。给药后,细胞形态开始发生变化,细胞间接触消失,与邻近细胞产生分离(见图3B、C、D),且随着药物浓度的增加,细胞凋亡情况越加严重,细胞核固缩变圆,细胞边缘出现了皱褶和卷曲(见图3E、F),进而细胞破裂,染色质溢出,死亡细胞较多(见图3 G)。
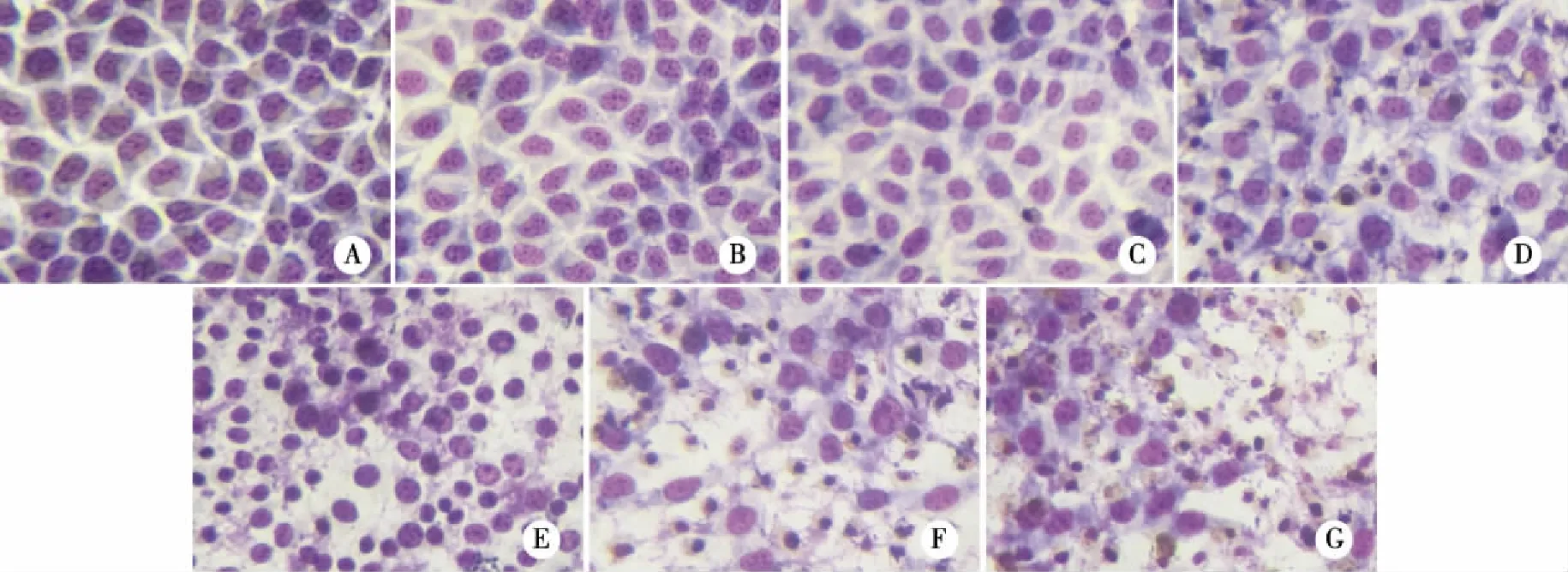
A:未用Rup-03处理的HepG2细胞;B-G:Rup-03为10-10、10-9、10-8、10-7、10-6、10-5mol/L时的细胞形态。 图3 Giemsa染色观察Rup-03对HepG2细胞形态的影响(×250)
2.4 流式细胞仪检测细胞凋亡 AnnexinV-FITC/PI双染色后,流式细胞仪分析结果见图4,Q2象限表示AnnexinV(+)/PI(+)的晚期凋亡细胞以及坏死细胞,Q3象限表示AnnexinV(+)/PI(-)的早期凋亡细胞(通常AnnexinV阳性群表示凋亡细胞,因此用象限Q2+Q3的值表示细胞凋亡率),由图4可见随着药物浓度从10-9mol/L增加到10-6mol/L,细胞凋亡率由15.15%上升到83.20%。

注:A:未用Rup-03处理的HepG2细胞凋亡情况;B-E:Rup-03为10-9、10-8、10-7、10-6mol/L时HepG2细胞凋亡情况。 图4 流式细胞仪观察Rup-03诱导HepG2细胞的凋亡
2.5 DNA完整性检测 由图5可见未加入Rup-03的HepG2细胞的DNA凝胶电泳为单一明亮条带,当Rup-03浓度为10-9mol/L时与未用药物处理的细胞条带相差不大,但当浓度大于10-8mol/L时,DNA条带已变化为涂布状,且条带亮度越来越暗。
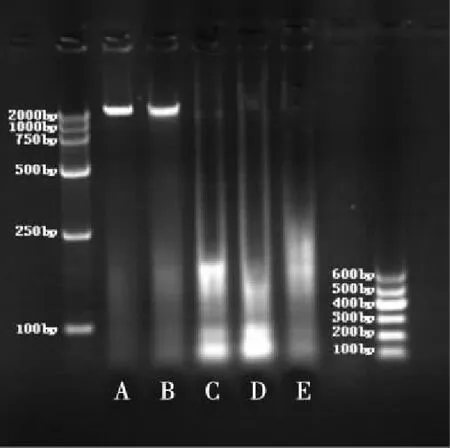
A:未用药物处理的HepG2细胞;B-E:Rup-03为10-9、10-8、10-7、10-6mol/L时HepG2细胞DNA条带。图5 Rup-03对HepG2细胞DNA凝胶电泳的影响
3 讨论
金属卟啉化合物对一些组织具有特殊的亲和力,将其注入肿瘤患者体内,能聚集在病变部位,再利用卟啉化合物具有特殊的电子吸收和荧光吸收的特征将病变部位与机体的其他部位相区分,就可以确定肿瘤的准确部位[8]。此外,这类化合物还具有良好的光化学性质,当其选择性浓集于肿瘤靶部位时,在氧的存在下,用某种波段的光或激光照射病灶,化合物可以吸收能量并激发出单线态氧(1O2)等自由基杀死肿瘤细胞从而达到治疗效果。
SRB法和MTT法测定结果表明,Rup-03、Rup-04、HDW-03和HDW-04对实验用瘤株生长的抑制作用具有浓度依赖性,但HDW-01、HDW-02对A549细胞生长抑制作用却随浓度增大呈现先上升后下降的趋势。观察细胞对药物作用的敏感性,HDW-01和HDW-02作用A549细胞时,细胞生长抑制率总体波动不到20%,细胞对药物浓度变化所产生的反应不显著,且浓度升高,细胞生长抑制率反而降低;HDW-03和HDW-04作用于MCF-7细胞时,尽管最低浓度和最高浓度的生长抑制率相差较大,但浓度越高,其对细胞的生长抑制率作用变化浮动范围越小,细胞对药物的反应性也相应减弱。因此我们选定Rup-03和Rup-04检测对HepG2细胞中NO含量的影响。
NO属于活性氮自由基,高浓度的NO具有促凋亡的作用[9],若细胞凋亡程度较高,则细胞内NO的含量也相应较高。由图2可以看出Rup-03诱导细胞内NO生成的效果要优于Rup-04,此作用与HepG2细胞生长抑制率的结果一致,因此选Rup-03进行Giemsa染色来观察细胞形态学的变化。
细胞凋亡时细胞的形态变化将经历三个过程[10-11]:首先是凋亡开始,可观察到细胞变圆、细胞间接触消失以及与邻近细胞分离,核内染色质会缩聚到核膜的边缘,呈块或碎裂状变化;其次是凋亡小体(apoptotic body)的形成;最后,巨噬细胞或邻近的细胞将吞噬凋亡小体。本实验中,Giemsa染色结果观察到加入了药物Rup-03的HepG2细胞发生了凋亡,细胞的形态从大小均一、清晰完整变化至细胞核固缩变圆、细胞生长密度下降、活细胞数减少,且随着药物浓度的增加凋亡情况越显著。当浓度为10-10mol/L时,所有肿瘤细胞的形态与正常细胞形态相似,无明显变化,这表明10-10mol/L这一浓度对细胞杀伤作用较弱,当药物浓度为10-5mol/L时,大量细胞脱壁,细胞碎裂状现象严重,具有完整细胞核的细胞数目不足一半(见图3G),说明受损伤的细胞较多。因此选定10-9~10-6mol/L浓度范围的Rup-03做进一步的机理研究。
细胞凋亡早期,细胞膜内的磷脂酰丝氨(Phosphatidylserine,PS)会从细胞膜内侧翻转到了细胞膜外侧,而这一变化可通过Annexin V-FITC凋亡检测试剂盒来检测。当细胞凋亡时胞浆内的Ca2+、Mg2+升高,激活核酸内切酶将导致180~200 bp及其倍数的小DNA片段出现,这是细胞凋亡时最主要的生化特征。流式细胞仪和DNA完整性检测的结果都表明随着Rup-03浓度的升高,细胞凋亡现象越来越明显,在10-6mol/L浓度时达到最高峰。
本实验结果显示6种新型卟啉化合物对肿瘤细胞都具有一定的杀伤作用,效果最好的药物是Rup-03,最适药物浓度为10-9~10-6mol/L,其机制可能是通过自由基途径诱导细胞凋亡。本文仅从细胞凋亡角度研究了新型金属卟啉化合物的抗肿瘤作用,要完全阐明药物的作用机理,还需更多的实验探索。
[参考文献]
[1] 张彦,陈灵智,王燕,等.卟啉类化合物作为光敏剂在治疗癌症方面的研究概况[J].河南化工,2010,27(1):7-8.
[2] Schneider-Yin X,Kurmanaviciene A,Roth M,et a1.Hypericin and 5-aminolevulinic acid-induced protoporphyrin IX induce enhanced phototoxicity in human endometrial cancer cells with non-coherent white light[J]. Photodiagnosis Photodyn Ther,2009,6 (1):12-18.
[3] Zawacka-Pankau J,Krachulec J,Grulkowski I,et al.The p53-mediated cytotoxicity of photodynamic therapy of cancer: Recent advances[J]. Toxicol Appl Pharmacol,2008,232(3): 487-497.
[4] 李文娜,夏嫱,刘银花,等.两种新型卟啉化合物光动力体外抑癌作用的研究[J].抗感染药学,2011,8(4):253-257.
[5] 黄银久,宋宝安,金林红,等.SRB法和MTT法抗肿瘤药物筛选结果相关性研究[J].生物学杂志,2009, 26(4):13-16.
[6] Green L C, Wagner D A, Glogowski J, et al. Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids[J]. Anal Biochem,1982,126(1):131-138.
[7] 王燕,彭莉萍,罗镇明.琼脂糖电泳中核酸染料Goldview最佳使用方案的建立[J].遵义医学院学报,2012,35(4):276-278.
[8] 杨建东,王都留.卟啉及金属卟啉化合物的合成及应用研究进展[J]. 首都师范大学学报, 2012,33(4):14-18.
[9] 谢萍.自由基与细胞凋亡[J].生物学教学,2004,29(1):3-4.
[10] Vermeulen K,VanBockstaele D R,Berneman Z N.Apoptosis:mechanisms and relevance in cancer[J]. Ann Hematol ,2005,84(10): 627-639.
[11] 刘海峰,孙文汇,高洪,等.细胞凋亡的特征及其检测方法[J]. 动物医学进展,2008,29(3):106-108.

