小柴胡汤对肝纤维化大鼠肝脏CYP2E1表达的影响
李 晋,徐尚福,张晓洁,白国辉,罗 果
(1.遵义医学院 医学与生物学研究中心,贵州 遵义 563099;2.遵义医学院 基础药理省部共建教育部重点实验室暨药理学教研室,贵州 遵义 563099)
肝纤维化是多种慢性肝病向肝硬化发展的中间病理阶段,肝星状细胞(hepatic stellate cell, HSC)的激活是肝纤维化发生的关键环节[1]。现认为在组织、细胞、分子水平上的主要促纤维化发生机制包括创伤愈合反应的慢性活化、氧化应激、上皮-间质相互作用的紊乱[2]。氧化应激本身即可活化HSC,促进肝纤维化形成。CYP2E1是肝脏药物代谢酶系细胞色素P450的重要亚型,与氧化应激(Oxidative Sress, OS)关系密切[3]。因此本研究通过观察小柴胡汤对肝纤维化大鼠肝组织CYP2E1表达的影响,探讨小柴胡汤抗肝纤维化的可能机制。
1 材料与方法
1.1 主要材料 小柴胡颗粒(四川禾润制药有限公司,批号:110505);四氯化碳-分析纯(国药集团化学试剂北京有限公司);RNAiso plus、Power SYBR Green PCR Master Mix、Prime ScriptTMRT reagent Kit及Primer均购自TakaRa公司;兔抗大鼠CYP2E1多克隆抗体(bs-1725R,北京博奥森生物技术有限公司);免疫组化检测试剂盒(GK500705,基因科技上海有限公司)。
1.2 分组与给药 健康SD雄性大鼠(SPF级,合格证号:SCXK(渝)2007-0005),体重200±20g,适应性喂养1周后随机分为5组(每组10只),包括空白对照组(control),模型组(model),小柴胡汤低(XCHT(1g/kg))、中(XCHT(2g/kg))、高(XCHT(4g/kg))剂量组(小柴胡颗粒1 g=3.58g原生药)[4]。皮下注射10%四氯化碳5 mL/kg造模,每周2次,共14周[5],空白对照组以同样方法皮下注射等量生理盐水。第9周开始治疗组按1 mL/100g灌胃给药6周,每天1次(空白对照组和模型组给予等量蒸馏水)。第14周末将全部大鼠隔夜禁食,次日以乙醚麻醉腹主动脉采血处死,迅速切取2块肝组织,一块用10%的甲醛固定后制备石蜡切片,另一块于-80°冰箱保存用于Real-time RT-PCR。
1.3 肝组织病理学检查 新鲜同部位肝组织10%福尔马林固定,梯度酒精脱水,二甲苯透明后石蜡包埋。切片后二甲苯脱蜡,梯度酒精水化,行常规HE染色,光镜下观察肝组织纤维化程度和炎症浸润程度。
1.4 肝组织免疫组化方法检测CYP2E1蛋白表达 按说明书采用2步法进行免疫组化染色。标本用中性福尔马林固定,石蜡包埋、切片,常规脱蜡,3%H2O2溶液去除内源性过氧化物酶,0.1mol/L 枸橼酸盐缓冲液进行高压热修复3min,正常山羊血清封闭非特异性抗原,滴加兔抗大鼠CYP2E1抗体(1∶200稀释),4℃孵育过夜后加二抗,DAB显色。采用image proplus 6.0 图像分析系统对结果进行积分光密度(IOD)值分析。
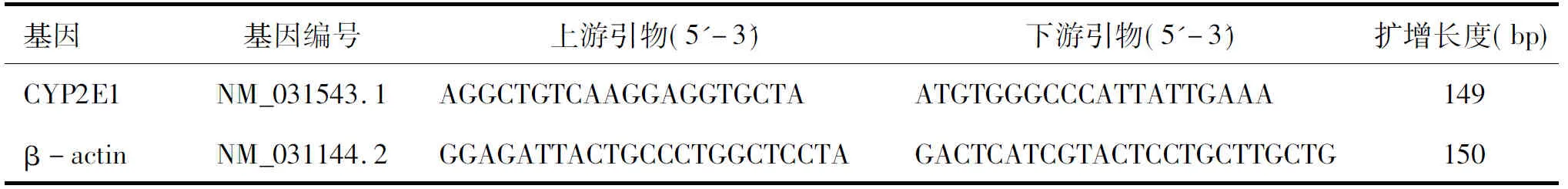
1.5 Real-time RT-PCR检测大鼠肝脏组织CYP2E1 mRNA表达 采用Trizol抽提总RNA,纯化后紫外分光光度计进行样品纯度和浓度鉴定。从NCBI中查出相关基因序列,由TaKaRa生物工程公司设计合成(见表1)。2步法逆转录-聚合酶链反应,PCR反应体系为20μL ,95℃×3min预变性;95℃×10s变性;60℃×1min退火,40循环。结果采用相对定量法进行统计[6]。
表1引物序列
2 结果
2.1 肝脏病理学改变 HE染色显示,给予CCl4造模后大鼠肝组织正常肝小叶结构破坏,多数肝细胞出现脂肪变性,汇管区和中央静脉区有胶原纤维条索形成;小柴胡汤给药后肝组织破坏现象明显改善,中央静脉周围呈放射状排列的肝细胞索破坏有明显改善,肝小叶破坏状况明显好转,脂肪变性减轻,其中以高剂量组效果最为显著(见图1)。
2.2 小柴胡汤对肝纤维化大鼠肝脏组织CYP2E1蛋白表达的影响 肝组织胞膜及胞浆内棕黄色颗粒为CYP2E1阳性表达。空白对照组大鼠肝组织中央静脉周围见少量CYP2E1(0.78×105±0.17×105)沉积;模型组CYP2E1(2.69×105±1.06×105)呈弥漫性分布,与空白对照组相比,表达明显增多(P<0.01)。与模型组比较,小柴胡汤中(1.47×105±0.45×105,P<0.05)、高剂量组CYP2E1(1.03×105±0.29×105,P<0.01)表达明显减少,小柴胡汤低剂量组(2.65×105±0.76×105)与模型组相比无显著差异(见图2、3)。
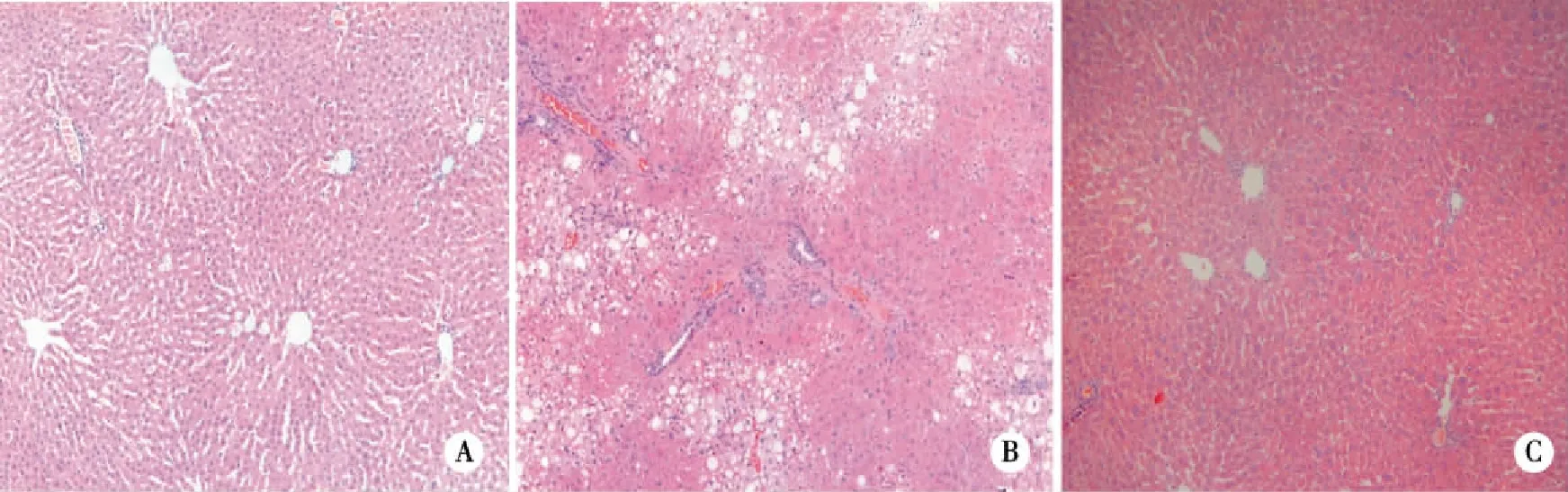
A:control;B:model;C:XCHT(4g/kg)。图1 小柴胡汤对肝纤维化大鼠肝组织形态学影响(×100)

A:control;B:model;C:XCHT(1g/kg);D:XCHT(2g/kg);E:XCHT(4g/kg);标尺为20μm。图2 小柴胡汤对肝纤维化大鼠肝组织CYP2E1蛋白表达的影响(×200)

图3 各组大鼠肝组织CYP2E1蛋白积分光密度(IOD)值比较
2.3 小柴胡汤对肝纤维化大鼠肝组织CYP2E1 mRNA的表达的影响 Real-time RT-PCR结果显示,模型组肝组织CYP2E1 mRNA(205.4±39.497)表达较空白对照组(100.00±22.73)明显升高(P<0.01),与模型组比较,小柴胡汤各剂量组均下调CYP2E1 mRNA的表达,小柴胡汤高剂量组CYP2E1 mRNA(106.92±27.32)的表达显著下降(P<0.01),小柴胡汤低、中剂量组与模型组比较无统计学意义(见图4)。

图4 小柴胡汤对肝纤维化大鼠肝脏组织CYP2E1 mRNA的表达的影响
3 讨论
肝纤维化是慢性肝病向肝硬化发展的必然途径,积极防治肝纤维化理应引起人们的高度重视。小柴胡汤出自《伤寒论》,是中医十大名方之一,为治少阳病之主方。由柴胡、黄芩、人参、半夏、甘草、生姜、大枣7味药组成。现代研究表明,小柴胡汤具有显著的抗炎保肝、解热镇痛等作用,在临床上主要用于治疗慢性乙型肝炎、肝纤维化、预防肝癌,是日本汉方药中产量最大和用量最多的方剂[7]。本研究显示小柴胡汤可改善CCl4引起的大鼠肝纤维化的病理学状态。
细胞色素P450(cytochrome P450,CYP450)是位于滑面内质网上的一组混合功能氧化酶系,是肝脏代谢最主要的酶系之一,人类中确定的CYP450同工酶有20多种,CYP2E1是最主要的同工酶,在肝脏中占肝细胞色素酶总量的7%,参与许多低分子有机化合物及药物在体内的代谢,并能催化许多前致癌物和前毒物的活化过程。CYP2E1可以引起许多毒物物质的代谢盒激活,催化产生活性氧物质,如超氧阴离子基团和过氧化氢等,与氧化应激关系密切[8]。氧化应激,体内氧化与抗氧化作用失衡,产生过多活性氧( reactive oxygen species,ROS)。过多的ROS攻击细胞内蛋白质、核酸等生命大分子,是引起众多疾病发生的重要原因。目前有研究证实多种急、慢性肝病及肝硬化中存在氧化应激,从而加重疾病的病理进程[9]。过多的ROS增强脂质过氧化程度,损伤细胞生物膜功能,并通过协同细胞因子及肝细胞凋亡使肝细胞炎症、坏死及纤维化加重[10]。肝细胞内CYP2E1表达增加是ROS产生的主要原因。本课题研究表明CCl4引起的大鼠肝纤维化组织CYP2E1表达明显高于空白对照组,说明CYP2E1参与肝纤维化的形成。而小柴胡汤可下调CYP2E1的表达,提示小柴胡汤可能通过抑制CYP2E1的表达而改善CCl4诱导的大鼠肝纤维化。
[参考文献]
[1] Yin C, Evason K J, Asahina K, et al. Hepatic stellate cells in liver development, regeneration, and cancer[J]. J Clin Invest,2013,123(5):1902-1910.
[2] Parola M, Pinzani M. Hepatic wound repair[J]. Fibrogenesis Tissue Repair, 2009,2(1): 4.
[3] Shahraki J, Motallebi A, Aqhvami M, et al. Ichthyotoxic Cochlodinium polykrikoides Induces Mitochondrial Oxidative Stress and Apoptosis in Rat Liver Hepatocytes[J]. Iran J Pharm Res, 2013, 12(4): 829-844.
[4] 帅峰. 中药小柴胡汤对肝纤维化大鼠MMPs与TIMPs mRNA的影响[J]. 安徽医药, 2009, 13(2): 139- 140.
[5] 李晋, 白玉, 姜妙娜, 等. 肝复康对肝纤维化大鼠肝组织TIMP-1表达的影响[J]. 遵义医学院学报, 2009, 32(6): 547-550.
[6] Xu S F, Yu L M, Fan Z H, et al. Improvement of ginsenoside Rg1 on hematopoietic function in cyclophosphamide-induced myelosuppression mice[J].Eur J pharmacol,2012,695(1-3):7-12.
[7] 李杰芬. 关于小柴胡汤引起间质性肺炎及其对策[J]. 国外医学:中医中药分册,1997,19(3):64-65.
[8] Wang C, Li H, Meng Q, et al. ATF4 deficiency protects hepatocytes from oxidative stress via inhibiting CYP2E1 expression[J]. J Cell Mol Med, 2014, 18(1): 80-90.
[9] Bolukbas C, Bolukbas F F, Horoz M, et al. Increased oxidative stress associated with the severity of the liver disease in various forms of hepatitis B virus infection[J]. BMC Infect Dis,2005,5(31):95.
[10] 徐忠,谢斌,吴小翎.CYP2E1在肝细胞癌中的作用研究进展[J].国际消化病杂志,2009,29(4):271-272.

