Tryptase和TIM-1双阳性肥大细胞在不同程度人牙周炎组织中的量化研究*
李 娟, 尹小萍, 蓝 田, 吕芳丽, 黄 博, 陈 柯, 黄世光△
(1暨南大学医学院口腔医学系, 广东 广州 510632; 2中山大学医学院寄生虫教研室,广东 广州 510080;3广州市妇女儿童医疗中心口腔科,广东 广州 510623)
T细胞免疫球蛋白黏蛋白1(T-cell immunoglobulin mucin 1,TIM-1)作为一种免疫调节分子,并能影响肥大细胞的功能[1]。我们前期的研究显示肥大细胞的募集和脱颗粒、肥大细胞Toll样受体4(Toll-like receptor 4, TLR4)与牙周炎的严重程度相关,提示肥大细胞在牙周炎的发病及病理过程中起重要作用[2-4]。研究显示TIM-1可能发挥双向的免疫调节作用[5]。目前类胰蛋白酶(tryptase)和TIM-1双阳性肥大细胞与牙周炎的关系未见报道。本文通过免疫荧光双染色方法观察分析不同病变程度牙周炎牙龈组织中tryptase和TIM-1双阳性肥大细胞的表达,探讨tryptase和TIM-1双阳性肥大细胞在牙周炎发病中的作用。
材 料 和 方 法
1 研究对象
1.1牙周炎病例选择 选择2010年1月~2013年1月在暨南大学荔湾口腔教学医院牙周科就诊的25~65岁成年人共92例,其中男性47例[(46±13)岁],女性45例[(42±14)岁],所有患者均无糖尿病和其它系统疾病;纳入标准依据美国牙周病学会1999年的牙周病新分类指南[6];所有受试者均在取材前1周先行龈上和龈下刮治术,并签署知情同意书。
1.2分组及取材 (1)正常对照组27例,取自因正畸治疗需要拔除的牙周健康的前磨牙:牙龈无炎症、无牙周袋、无附着丧失、X线片显示无牙槽骨吸收; (2)轻度牙周炎组34例,为需要接受临床牙冠延长术的慢性牙周炎患者:牙龈有炎症、探诊出血、牙周袋≤4 mm、附着丧失≤2 mm、X线片显示牙槽骨吸收不超过根长的1/3;(3)重度牙周炎组31例,取自无保留价值或预后极差需要拔除的重度牙周炎患者:牙周袋>6 mm、附着丧失≥5 mm、X线片显示牙槽骨超过根长的1/2、甚至达根长的2/3、多根牙有根分叉病变、牙齿多有松动、炎症明显或可发生牙周脓肿。本研究未收集到中度牙周炎的牙龈标本。
2 方法
2.1组织标本采集、处理与观察 牙龈标本于4%中性甲醛液中固定48 h以上,制成颊舌向5 μm厚度连续切片,HE染色,光学显微镜下观察牙龈组织学改变。由2名病理医师盲法观察,并对牙龈组织的炎症细胞浸润情况进行评分,求其平均值。炎症程度评分标准参照Huang等[7]的方法:0:无炎症细胞浸润;1:轻度炎症,炎症细胞局部呈小灶状浸润;2:中度炎症,炎症细胞呈灶状及片状浸润;3:重度炎症,炎症细胞在牙龈组织内呈弥漫性浸润。
2.2Tryptase和TIM-1双阳性肥大细胞免疫荧光双染色法 免疫荧光双染色:Ⅰ抗tryptase抗体(Abcam,稀释浓度为1∶200)和TIM-1抗体(武汉博士德,稀释浓度为1∶100);Ⅱ抗山羊抗鼠IgG(H+L)Alex Flour® 488(Cell Signaling Technology)和山羊抗兔IgG(H+L)Alex Flour®555(Cell Signaling Technology),稀释浓度为1∶200。牙龈切片经过柠檬酸液修复、Ⅱ抗血清封闭,Ⅰ抗孵育,避光条件下Ⅱ抗孵育荧光染色后,立即在荧光显微镜下观察。免疫荧光阳性信号tryptase表达为绿色荧光,TIM-1表达为红色荧光,定位于细胞膜或细胞浆,同一视野tryptase与TIM-1重叠后为橘黄色荧光。染色切片由2名病理医师于荧光显微镜下观察tryptase和TIM-1双阳性肥大细胞,并计数,通过测量切片组织的面积,获得每平方毫米的细胞个数(cells/mm2),取其平均值。
3 统计学处理
数据以均数±标准差 (mean±SD) 表示,采用SPSS 13.0统计学软件分析。不同组间的牙龈组织病理学观察数据使用多个独立样本比较的Kruska-Wallis检验分析,多组间每平方毫米tryptase和TIM-1双阳性肥大细胞数的比较采用多个独立样本两两比较的Nemenyi检验。以P<0. 05为差异有统计学意义。
结 果
1 组织学观察
正常对照组,未见明显炎症细胞浸润(图1A1、A2);轻度牙周炎组,可见少量散在炎症细胞浸润(图1B1、B2);重度牙周炎组,出现明显的炎症细胞浸润,并见淋巴细胞和浆细胞(图1C1、C2)。各组牙龈组织炎症程度评分见图2,结果显示,与正常对照组相比较,轻度和重度牙周炎组的炎症程度评分显著升高(P<0.05);重度牙周炎组的炎症程度评分明显高于轻度牙周炎组(P<0.05)。
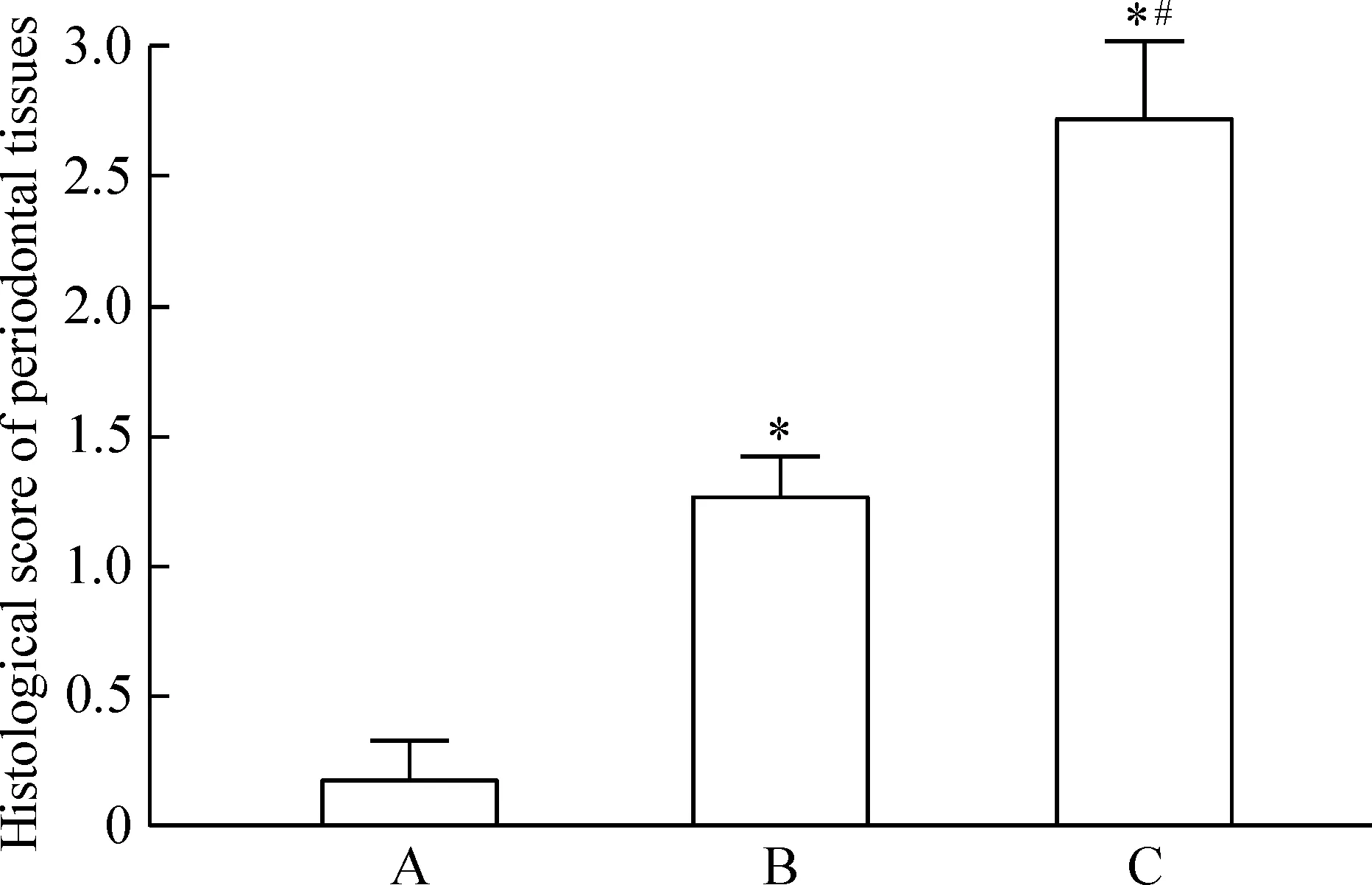
Figure 2. Scoring of inflammation in gingival tissues. A: healthy control group (n=27); B: mild periodontitis group (n=34); C: severe periodontitis group (n=31). Mean±SD. *P<0.05 vs A; #P<0.05 vs B.
2 Tryptase和TIM-1双阳性肥大细胞免疫荧光双染色结果
各组牙龈组织tryptase和TIM-1双阳性肥大细胞免疫荧光双染色结果见图3。在正常对照组,牙龈组织tryptase和TIM-1双阳性肥大细胞数量较少,表达较弱,且无明显的脱颗粒现象;在轻度牙周炎组,牙龈组织中tryptase和TIM-1双阳性肥大细胞数量增加;在重度牙周炎组,牙龈组织中出现大量tryptase和TIM-1双阳性肥大细胞,肥大细胞有明显的脱颗粒现象。各组牙龈组织中tryptase和TIM-1双阳性肥大细胞密度见图4,结果显示,与正常对照组相比,轻度慢性牙周炎组(P<0.05)和重度慢性牙周炎组(P<0.01)牙龈组织tryptase和TIM-1双阳性肥大细胞数量明显升高;重度牙周炎组tryptase和TIM-1双阳性肥大细胞个数显著高于轻度牙周炎组(P<0.05)。

Figure 3. Representative photomicrographs of mast cell infiltration with tryptase-TIM-1 immunofluorescence double-staining(×1000).A: healthy control group; B: mild periodontitis group; C: severe periodontitis group.
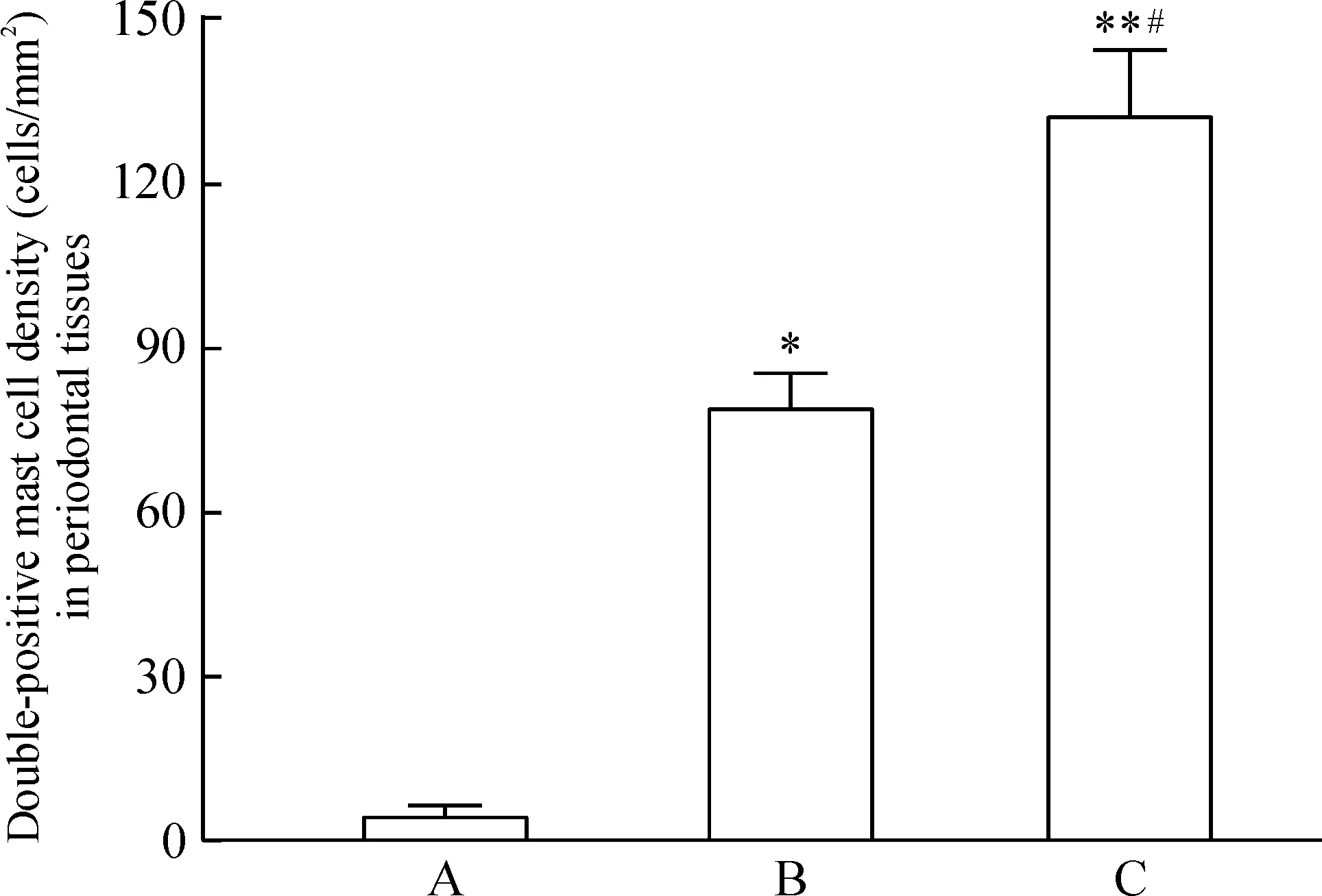
Figure 4. Tryptase and TIM-1 double-positive mast cells in periodontal tissues of different groups. A: healthy control group (n=27); B: mild periodontitis group (n=34); C: severe periodontitis group (n=31). Mean±SD. *P<0.05,**P<0.01 vs A; #P<0.05 vs B.
讨 论
TIM家族是T细胞表面的跨膜蛋白家族。研究表明,TIM-1和TIM-3是TIM家族中的2个重要成员,分别在分化成熟的Th2细胞和Th1细胞上表达,参与Th细胞免疫反应的调控。TIM-1可增强Th2细胞的活化,TIM-3可下调Th1细胞的免疫功能[8]。TIM-1最初被确认为甲型肝炎病毒细胞受体1(hepatitis A virus cellular receptor 1,HAVCR1),后来被称为肾脏损伤分子1(kidney injury molecule 1,KIM-1),是哮喘和过敏的重要易感性基因,在Th2细胞上强表达,在T细胞活化中作为协同刺激分子调节机体免疫应答[9-10]。
研究显示TIM-1在肥大细胞、巨噬细胞和树突状细胞等固有免疫细胞表面均有表达[1,11],影响白细胞介素4(interleukin 4,IL-4)、IL-10、IL-17、干扰素 γ(interferon γ,IFN-γ)等的释放[12]。TIM-4是TIM-1的配体之一,TIM-1与TIM-4的相互作用调节Th细胞免疫应答及平衡Th1/Th2细胞因子[13]。T细胞活化早期,在T细胞抗原受体(T-cell receptor,TCR)刺激下,TIM-1表达增加,与其配体结合,刺激抗原呈递细胞(antigen presenting cells,APCs)表达,为T细胞增殖提供正向的共刺激信号,同时APCs上TIM-1的表达可以直接对APCs传递正向信号,进而增强T细胞的活化[12,14]。临床研究表明,甲型肝炎病毒(hepatitis A virus, HAV)感染患者罹患哮喘和过敏性鼻炎的风险下降,提示TIM-1可能直接调节Th2介导的免疫应答,表达在Th2细胞表面的TIM-1与HAV结合直接改变T细胞的分化及调节Th1/Th2细胞之间的平衡[9]。实验显示,使用TIM-1单克隆抗体可以减少过敏原诱导的呼吸道炎症[5],阻断TIM-1与配体间的相互作用可以为Th2介导的免疫应答及过敏性哮喘提供有效抗炎治疗[12]。然而,TIM-1抗体在识别TIM-1的不同基因结构时,对Th1和Th2细胞因子的产生及呼吸道炎症会出现明显的双重性作用。哮喘动物模型实验结果显示:TIM-1单克隆抗体在识别黏蛋白的外显子4时,可以加重呼吸道炎症及Th2细胞因子的产生;当抗体与TIM-1的IgV蛋白反应时则阻断炎症反应[5]。研究表明,小鼠肥大细胞能够表达TIM-1,经IgE抗原刺激,腹腔肥大细胞或骨髓来源培养的肥大细胞TIM-1表达下调。使用重组小鼠TIM-4(rmTim-4),能促进骨髓的肥大细胞Th2细胞因子IL-4、IL-6和IL-13的产生[1, 15],提示TIM-1可通过调节肥大细胞的作用而影响T细胞介导的免疫反应。
牙周病是由菌斑生物引起的牙周支持组织的感染性疾病,导致牙周支持组织的破坏。目前认为由细菌激发的宿主免疫和炎症反应造成的牙周组织破坏远大于细菌对牙周组织的直接破坏作用[16-17]。研究显示,牙周病免疫机制与T细胞,尤其是Th1/Th2细胞之间的调节密切相关,但关于牙周病Th1与Th2细胞作用的精确机制尚未阐明。研究发现,肥大细胞能够分泌Th1型和Th2型细胞因子,影响T细胞的分化[18]。肥大细胞作为机体固有免疫细胞之一,参与黏膜炎症、机体防御和组织修复等;活化的T细胞能够激活肥大细胞脱颗粒释放一系列介质,包括组胺、白细胞三烯、血小板激活因子、蛋白酶和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等[2,19],引起牙周组织的破坏和牙槽骨的吸收[2, 20]。人肥大细胞根据其分泌的蛋白酶不同分为2类,一类是只能分泌tryptase的肥大细胞;另一类是能分泌tryptase、类糜蛋白酶(chymase)和羧肽酶(carboxypeptidase)的肥大细胞[21]。Tryptase为丝氨酸蛋白酶类,对中性粒细胞具有化学引诱作用,可以刺激上皮细胞增殖、分泌IL-8,刺激外周感觉神经分泌炎性神经肽诱导神经源性炎症[2]。
本研究观察到,tryptase阳性肥大细胞的表达量随慢性牙周炎炎症程度的增加而升高,慢性牙周炎中肥大细胞有明显的脱颗粒现象,我们的结果提示肥大细胞可能通过分泌细胞因子参与慢性牙周炎的防御和破坏机制,这一结果与Batista等[2]及Huang等[3]研究结果相一致。本实验采用免疫荧光双染色法首次证实了人慢性牙周炎牙龈组织的肥大细胞表达TIM-1,实验观察到tryptase 和TIM-1双阳性肥大细胞在正常对照组、轻度牙周炎组、重度牙周炎组中的表达逐渐增加,重度牙周炎组织中tryptase 和TIM-1双阳性肥大细胞显著高于轻度牙周炎组,提示肥大细胞上TIM-1的表达可能影响肥大细胞在慢性牙周炎的免疫调节作用。牙周炎是仅次于龋病的口腔常见疾病之一,与全身系统性疾病如动脉粥样硬化、风湿性关节炎和糖尿病等密切相关,tryptase 和TIM-1双阳性肥大细胞在牙周炎的免疫机制中的作用还有待研究,但TIM-1对炎症的双重性作用,可能为控制牙周炎甚至治疗其全身伴发疾病提供一个新的方向。
[参 考 文 献]
[1] Nakae S, Iikura M, Suto H, et al. TIM-1 and TIM-3 enhancement of Th2 cytokine production by mast cells [J]. Blood, 2007, 110(7):2565-2568.
[2] Batista AC, Rodini CO, Lara VS. Quantification of mast cells in different stages of human periodontal Dis[J]. Oral Dis, 2005, 11(4):249-254.
[3] Huang S, Lu F, Chen Y, et al. Mast cell degranulation in human periodontitis [J]. J Periodontol, 2013, 84(2):248-255.
[4] 蓝 田, 吕芳丽, 李 娟, 等. 肥大细胞Toll样受体4在人慢性牙周炎牙龈组织中的表达[J]. 中国病理生理杂志, 2013, 29(8):1476-1480.
[5] Sizing ID, Bailly V, McCoon P, et al. Epitope-dependent effect of anti-murine TIM-1 monoclonal antibodies on T cell activity and lung immune responses [J]. J Immunol, 2007, 178(4):2249-2261.
[6] Armitage GC. Development of a classification system for periodontal diseases and conditions [J]. Ann Periodontol, 1999, 4(1):1-6.
[7] Huang S, Lu F, Zhang Z, et al. The role of psychologic stress-induced hypoxia-inducible factor-1α in rat experimental periodontitis [J]. J Periodontol, 2011, 82(6):934-941.
[8] Kuchroo VK, Umetsu DT, DeKruyff RH, et al. TheTIMgene family: emerging roles in immunity and disease [J]. Nat Rev Immunol, 2003, 3(6):454-462.
[9] Freeman GJ, Casasnovas JM, Umetsu DT, et al.TIMgenes: a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity [J]. Immunol Rev, 2010, 235(1):172-189.
[10] Xiao S, Najafian N, Reddy J, et al. Differential engagement of Tim-1 during activation can positively or negatively costimulate T cell expansion and effector function [J]. J Exp Med, 2007, 204(7):1691-1702.
[11] Curtiss ML, Gorman JV, Businga TR, et al. Tim-1 regulates Th2 responses in an airway hypersensitivity model [J]. Eur J Immunol, 2012, 42(3):651-661.
[12] Umetsu SE, Lee WL, McIntire JJ, et al. TIM-1 induces T cell activation and inhibits the development of peripheral tolerance [J]. Nat Immunol, 2005, 6(5):447-454.
[13] Meyers JH, Chakravarti S, Schlesinger D, et al. TIM-4 is the ligand for TIM-1, and the TIM-1-TIM-4 interaction regulates T cell proliferation [J]. Nat Immunol, 2005, 6(5):455-464.
[14] de Souza AJ, Orisst TB, O’Malley KJ, et al. T cell Ig and mucin 1 (TIM-1) is expressed oninvivo-activated T cells and provides a costimulatory signal for T cell activation [J]. Proc Natl Acad Sci U S A, 2005, 102(47):17113-17118.
[15] Huang B, Liu M, Huang S, et al. Expression of Tim-1 and Tim-3 inPlasmodiumbergheiANKA infection [J]. Parasitol Res, 2013, 112(7):2713-2719.
[16] Deo V, Bhongade ML. Pathogenesis of periodontitis: role of cytokines in host response[J]. Dent Today, 2010, 29(9):60-62, 64-66; quiz 68-69.
[17] 黄世光, 王晓歌, 潘倩茹, 等. 慢性心理应激对大鼠实验性牙周炎及血清乳酸脱氢酶1的影响[J]. 中国病理生理杂志, 2012, 28(5): 924-928.
[18] de Pater-Huijsen FL, de Riemer MJ, Reijneke RM, et al. Products from human mast cell line cells enhance the production of interferon-gamma by CD8+and CD4+T cells [J]. Immunology, 2002, 106(1):11-19.
[19] 李 红, 赵龙凤, 郝彦琴, 等. 抗组胺治疗对实验性肝炎大鼠肥大细胞浸润及c-Kit和SCF表达的影响[J]. 中国病理生理杂志, 2013, 29(9): 1609-1614.
[20] Sun J, Sukhova GK, Wolters PJ, et al. Mast cells promote atherosclerosis by releasing proinflammatory cytokines [J]. Nat Med, 2007, 13(6):719-724.
[21] Pejler G, Ronnberg E, Waern I, et al. Mast cell proteases: multifaceted regulators of inflammatory disease [J]. Blood, 2010, 115(24):4981-4990.

