ANCA诱导中性粒细胞释放正五聚素蛋白3*
谢 京, 唐 莎, 张 莹, 尹仕伟, 高雪静, 施维维, 王 莉, 邹丽云, 吴玉章, 张静波△
(第三军医大学 1新桥医院肾内科, 2全军免疫学研究所,重庆 400037)
抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic autoantibody, ANCA)相关性血管炎(ANCA-associated vasculitis, AAV)是一种自身免疫性疾病,在我国并不少见。该病变属于慢性自身炎症状态持续进行的系统性小血管炎(systemic small-vessel vasculitis, SSV),肾脏是最常累及的器官,可导致迅速进展、不可逆转的肾功能衰竭[1]。正五聚素蛋白3 (pentraxin 3, PTX3) 作为一种新的与C反应蛋白(C-reactive protein,CRP)同为正五聚素蛋白家族的急性期反应蛋白,与CRP相比,更能迅速反映局部组织的炎症状态及损伤,有望成为临床更为敏感的血清学标志物[2]。PTX3以预存的方式存在于中性粒细胞中[3]。溶酶体膜蛋白2(lysosomal membrane protein 2,LAMP-2)抗体是最近才发现的ANCA 新亚型,新近研究显示LAMP-2抗体介导了AAV的自身免疫发病过程[4],与AAV的诊断及活动性高度相关[5]。我们前期研究发现,LAMP-2抗体可以促进中性粒细胞胞外捕网(neutrophil extracellular traps, NETs) 形成[6]。本研究旨在进一步探讨传统ANCA及新型LAMP-2抗体是否能直接诱导中性粒细胞活化,是否通过NETs形成释放PTX3,为PTX3是否参与ANCA相关性血管炎的发病机制提供依据。
材 料 和 方 法
1 主要试剂
二甲苯基碘(diphenyleneiodonium, DPI)和二甲亚砜(dimethyl sulfoxide,DMSO)购自Sigma-Aldrich;HBSS(无Ca2+、Mg2+)、PRMI-1640培养基(无酚红)和青/链霉素液购自Invitrogen;12 mm圆形盖玻片购自Fisher;PolymorphprepTM分离液购自Axis-Shield;红细胞裂解液购自Roche;免疫染色固定液、免疫染色封闭液、免疫染色Ⅰ抗稀释液、免疫染色荧光Ⅱ抗稀释液、抗荧光淬灭封片剂、DAPI等购自上海碧云天公司。TNF-α购自PeproTech;PTX3 ELISA试剂盒购自Cusabio,检测范围为0.156~10 μg/L;FITC标记的抗人CD16流式抗体购自BioLegend;抗LAMP-2 IgG(H4B4)、FITC标记小鼠抗人髓过氧化物酶(myeloperoxidase,MPO)单抗(266.6k2)和小鼠抗人PTX3 IgG抗体均购自Santa Cruz;小鼠抗人IgG2a单克隆抗体购自Abcam;所有荧光Ⅱ抗包括TRITC标记的羊抗小鼠荧光Ⅱ抗购自北京中衫金桥公司。
2 主要方法
2.1健康对照组及AAV患者全血及血清收集 选择健康志愿者9例作为对照组,来源于第三军医大学附属新桥医院体检中心;AAV患者6例,来源于第三军医大学附属新桥医院肾内科,入选标准为:2012年美国Chapel Hill会议(CHCC)关于系统性血管炎命名分类法、分型及1999年美国风湿病学会(ACR)修订的血管炎诊断标准[7-8]。排除标准为:系统性红斑狼疮、类风湿关节炎及过敏性紫癜、IgA肾病等继发性的血管炎和近期接受免疫抑制剂治疗的患者。患者平均年龄60.2岁,男性2例,女性4例。其中血清MPO-ANCA阳性5例,且平均滴度1∶68.4;PR3-ANCA阳性 1例,滴度1∶100。肾活检其中3例为新月体肾小球肾炎,1例硬化性肾小球肾炎,2例因双肾彩超提示血流信号稀少及缩小未进行肾活检。全血和血清均为在临床确诊,接受治疗前收集样本。健康志愿者和AAV患者血清收集后,经2 000 r/min离心15 min后,取上清液置于Eppendorf管,于-80 ℃冰箱保存。本研究经第三军医大学新桥医院伦理委员会批准,所有研究对象均签署知情同意书。
2.2中性粒细胞的分离、存活率鉴定及培养 采用PolymorphprepTM分离液分离健康志愿者和AAV患者EDTA抗凝全血,加入中性粒细胞分离液后离心,取出中性粒细胞层和下面的分离液层,加入HBSS(无Ca2+、Mg2+)洗涤后裂解残余红细胞,CD16标记的流式细胞术鉴定中性粒细胞纯度。细胞用无酚红RPMI- 1640培养基(1%青/链霉素)以5×(105~106)接种于加有12 mm圆形盖玻片的24孔板中,每孔500 μL,贴片1 h后,分别设立相应的刺激组进行培养。分离后0 h及培养3 h的中性粒细胞进行台盼蓝染色,取细胞悬液450 μL与0.4%台盼蓝溶液50 μL以9∶1轻轻混合混匀(终浓度0.04%);倒置显微镜下观察并拍照,死细胞染成明显的蓝色,活细胞拒染呈无色透明状。在3 min内分别计数活细胞和死细胞:细胞存活率(%)= 活细胞总数/(活细胞总数+死细胞总数)×100%。
2.3实验分组 分离健康志愿者中性粒细胞进行分组培养:(1) LAMP-2抗体刺激组:采用抗LAMP-2 IgG (20 mg/L),参照文献[6]; TNF-α组:TNF-α(20 μg/L),刺激为阳性对照,参照文献[9]。(2)血清刺激中性粒细胞组:AAV患者血清作为实验组,TNF-α+AAV患者血清作为阳性对照,健康人血清组作为阴性对照,刺激时间180 min。TNF-α组预处理60 min后,再用患者血清刺激120 min。培养条件为37 ℃、5% CO2。(3)健康志愿者及AAV患者中性粒细胞上清组:收集健康志愿者及AAV患者全血分离后的中性粒细胞上清待测。仅加培养基的中性粒细胞作为空白对照组。
2.4免疫荧光及激光共聚焦技术检测PTX3的表达 分离后的中性粒细胞经处理或未处理后固定,洗涤3次后4 ℃封闭过夜,以小鼠抗人PTX3-IgG为Ⅰ抗,以稀释好的TRITC 羊抗小鼠荧光IgG抗体(1∶200)作为Ⅱ抗标记PTX3;FITC标记的抗中性粒细胞颗粒蛋白荧光抗体,37 ℃孵育60 min,洗涤3次后,DAPI复染标记DNA,抗荧光淬灭封片剂封片后以Leica SP5激光共聚焦显微镜观察和记录荧光图像,用Image-Pro Plus图像分析软件测量荧光强度,结果以目的蛋白的平均荧光强度值表示。
2.5ELISA法测定各组细胞上清PTX3水平 中性粒细胞经分组处理培养后,收集上清液,步骤严格按照试剂盒操作说明进行检测,用酶标仪分析出波长450 nm处的A值,代入CurveExpert 1.4软件,分析ELISA标准曲线拟合方程及数据,计算出各组细胞上清液中PTX3水平。
3 统计学处理
实验每次采用3个复孔。中性粒细胞来源于9个不同的健康志愿者。用GraphPad Prism 5.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两组间比较采用非配对t检验,以P<0.05为差异有统计学意义。
结 果
1 分离的中性粒细胞纯度及存活率
分离的健康志愿者中性粒细胞经CD16标记的流式细胞术鉴定,纯度>95%。刚分离(0 h)的健康志愿者中性粒细胞平均存活率为97%,AAV患者的中性粒细胞平均存活率95.7%,2组间无显著差异(P>0.05)。健康志愿者中性粒细胞体外经过3 h的培养,单独培养基组平均存活率为94.9%,健康志愿者血清刺激组平均存活率为95.2%,LAMP-2抗体(20 mg/L)刺激组平均存活率为94.0%,AAV血清刺激组平均存活率为94.2%,TNF-α刺激组平均存活率为93.5%,AAV血清+TNF-α刺激组平均存活率为94.9%,各组间无显著差异(P>0.05),见图1。

Figure 1. The survival rate of neutrophils tested by Trypan blue exclusion assay.HC: health control.Mean±SD.n=3.
2 PTX3储存在静止状态的正常中性粒细胞中
分离的健康志愿者中性粒细胞,不予以任何刺激,在培养基中培养180 min,然后用 DAPI 进行核染色,激光共聚焦显微镜观察细胞核形态变化,绝大多数中性粒细胞保持正常的分叶核结构,间接免疫荧光染色发现PTX3储存在静止状态的中性粒细胞中,细胞外无PTX3的释放,见图2。

Figure 2. PTX3 was stored in resting normal neutrophils. Scale bars:25 μm.
3 AAV患者中性粒细胞释放PTX3增加
由健康人及AAV患者外周血分离的中性粒细胞直接离体培养180 min后,收集培养上清,经ELISA检测发现来自AAV患者中性粒细胞的体外培养上清中的PTX3水平明显高于健康人中性粒细胞培养上清中的PTX3水平,且差异具有统计学意义(P<0.05),见图3。
4 LAMP-2抗体促中性粒细胞PTX3的释放
分离健康志愿者的中性粒细胞分别经培养基(作为对照)、LAMP-2 抗体(20 mg/L)和TNF-α刺激180 min 后,收集培养上清,通过ELISA检测发现:LAMP-2抗体刺激健康人外周血中性粒细胞组,上清中PTX3水平明显高于培养基对照组(P<0.01),但低于阳性对照的TNF-α组。3组间均有显著差异(P<0.01),见图4。
5 LAMP-2抗体及AAV患者血清可通过NETs的形成释放PTX3
分离健康志愿者的中性粒细胞经LAMP-2 抗体或TNF-α分别刺激180 min 后,用DAPI 进行核染色,激光共聚焦显微镜观察细胞核形态变化。在未加任何刺激因子的培养基阴性对照组,绝大多数中性粒细胞保持正常的分叶核结构,PTX3固定在胞内,几乎无PTX3的释放;LAMP-2 抗体刺激组中性粒细胞核变形,分叶消失,染色质解聚呈网状释放出胞外,发现大量PTX3释放;TNF-α刺激组同样发现大量PTX3释放;分离的中性粒细胞经健康人血清刺激后绝大多数中性粒细胞保持正常的分叶核结构,且PTX3固定在胞内;AAV患者血清刺激组中性粒细胞核变形,分叶消失,染色质解聚呈网状释放出胞外,发现大量PTX3释放;TNF-α预刺激后加AAV患者血清组同样发现大量PTX3释放。通过图像分析软件测量PTX3免疫荧光强度显示,与单独培养基组相比,LAMP-2抗体刺激组的PTX3免疫荧光强度明显增高,2组间差别有统计学意义(P<0.01);用AAV患者血清刺激正常人中性粒细胞组明显高于健康血清刺激组,2组间差别有统计学意义(P<0.01),见图5。
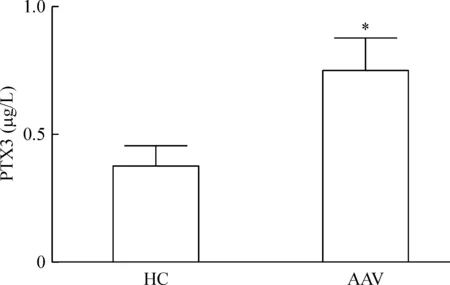
Figure 3. High supernatant PTX3 level in cultured neutrophils isolated from the AAV patients.Mean±SD.n=6.*P<0.05 vs health control (HC).

Figure 4. PTX3 was released from the neutrophils stimulated by LAMP-2 antibody (Ab). Mean±SD.n=9.**P<0.01 vs medium.

Figure 5. PTX3 was released through neutrophils extracelluar trap formation.Scale bars:25 μm. Mean±SD.n=9.**P<0.01 vs medium; ##P<0.01 vs HC serum.
6 PTX3随中性粒细胞胞内抗原MPO通过NETs形成释放
分离健康志愿者的中性粒细胞经LAMP-2抗体或TNF-α刺激180 min 后,对刺激后的中性粒细胞进行免疫荧光染色,用小鼠抗人PTX3 IgG抗体作为Ⅰ抗、TRITC羊抗小鼠IgG2a单克隆抗体及FITC标记的抗MPO荧光抗体作为Ⅱ抗,DAPI 标记DNA,激光共聚焦显微镜进行观察,结果显示,LAMP-2 抗体诱导中性粒细胞形成NETs,导致PTX3随MPO一起释放,见图6。
讨 论
AAV是进展非常迅速的系统性疾病,ANCA 不仅是诊断AAV的标准,同时也直接参与了病理损伤进程[9]。但ANCA并不与所有病人的活动性相关,提示还存在其它伴随疾病活动的生物学标志[10-11]。既往研究发现,PTX3可以作为AAV患者疾病活动性的独立预测因子[12],但具体机制依然不清。

Figure 6. PTX3 was released along with MPO through the neutrophil extracelluar trap formation. Scale bars: 25 μm.
PTX3是近年发现的,与短肽链的CRP和SAP同家族的一种新的长肽链正五聚素蛋白。PTX3可由众多炎症细胞及组织固有细胞产生。这些细胞包括:树突状细胞、巨噬细胞、纤维母细胞、激活的内皮细胞、肾脏系膜细胞、平滑肌细胞等,还以预存的方式储存于中性粒细胞的特殊颗粒里[13],作为一种可溶性模式识别受体(pattern recognition receptors,PRRs),在炎症因子及病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)刺激下可释放出胞外[14]。PTX3通过巨噬细胞调节晚期凋亡中性粒细胞的清除,参与了自身免疫[15-16];此外,还通过与C1q的结合,激活补体途径,而在补体介导的免疫反应中起到双重作用[17]。本研究首先从形态学上证实了PTX3储备在正常并处于静止状态的中性粒细胞中,然后在临床收集的AAV患者全血中分离的中性粒细胞培养上清中检测到PTX3水平明显高于健康对照组,提示AAV患者的中性粒细胞可能释放PTX3增加。有文献显示:中性粒细胞受TNF-α刺激后发生凋亡,储存在中性粒细胞特殊颗粒内的PTX3随即释放出胞外[14]。
NETs是一种不同于凋亡和坏死的中性粒细胞一种新的死亡方式,是以中性粒细胞核内或线粒体内DNA及组蛋白为骨架,负载胞内抗微生物分子组成的网状结构,作为中性粒细胞抵御外来微生物的第一道防线,以胞吐的方式释放DNA及水解酶,捕获入侵的病原微生物,形成高浓度的杀菌微环境[18]。NETs释放的组分中,经蛋白质组学测定,有24种NETs相关性蛋白[19],这些蛋白基本上都具有抗微生物活性,与宿主防御相关,PTX3即为其中之一[13]。本研究随后采用ANCA新亚型LAMP-2抗体刺激正常人中性粒细胞,同样发现其培养上清中存在高水平的PTX3蛋白,进一步采用免疫荧光方法从形态学证实了PTX3的释放,以及荧光强度定量检测到刺激后的中性粒细胞PTX3释放增加。同样,含ANCA阳性的AAV患者血清体外刺激正常人中性粒细胞,与LAMP-2抗体刺激具有相似的结果,免疫荧光及荧光强度定量检测到患者血清刺激后的中性粒细胞释放出大量的PTX3。这提示PTX3释放可能依赖于ANCA及其它微环境细胞因子, ANCA新亚型LAMP-2抗体与AAV血清中检验确定的传统ANCA(MPO-ANCA及PR3-ANCA)一样,都能诱导中性粒细胞的PTX3释放。本课题组早期研究发现:LAMP-2抗体诱导的NETs网状结构组分中含有MPO等自身抗原[6]。自身抗原的过度暴露而未及时清除,可以直接损伤机体组织,还能进一步诱导自身抗体的形成,加重AAV的发病进程[9]。我们用激光共聚焦显微镜观察,从形态学上发现中性粒细胞通过NETs形成导致PTX3随自身抗原MPO一同释放,PTX3构成NETs的组份。PTX3作为可溶性识别受体,具有类似抗体的功效,可能在NETs中通过与某种配体的结合,清除过度暴露的自身抗原,清除异常死亡的中性粒细胞,发挥出中和清除病原体的生物学效应,而起到限制自身免疫的保护性作用[20-21]。
本研究尚有以下不足之处:因本课题组在临床研究部分发现AAV患者血清PTX3水平升高,与文献报道的小血管炎患者血清中PTX3水平升高相似[12]。因此,在用AAV患者血清刺激组中,考虑到患者血清中含有PTX3,与正常人外周血中性粒细胞经其刺激后释放出的PTX3相互产生干扰,尚未设立用AAV患者血清刺激正常人外周血中性粒细胞组。仅用荧光检测从形态学上发现了与抗体刺激组相同的PTX3释放。无论是体外或动物实验中,进一步探讨PTX3在AAV中的作用是本研究需要继续关注的问题。
综上所述,本研究发现静止状态的正常中性粒细胞中储存PTX3,AAV患者外周血中性粒细胞培养上清中存在高水平PTX3,而这些PTX3可由中性粒细胞通过胞外捕网形成进行释放。该发现将为我们进一步认识这一特殊的可溶性识别受体在AAV病理生理过程中的作用及可能机制奠定基础。
[参 考 文 献]
[1] Kallenberg CG, Stegeman CA, Heeringa P. Autoantibo-dies vex the vasculature[J]. Nat Med, 2008,14(10):1018-1019.
[2] 谢 京, 张静波. 正五聚蛋白3在炎症及自身免疫中的作用[J]. 中国病理生理杂志, 2013,29(4):752-756.
[3] Jaillon S, Peri G, Delneste Y, et al. The humoral pattern recognition receptor PTX3 is stored in neutrophil granules and localizes in extracellular traps[J]. J Exp Med, 2007,204(4):793-804.
[4] Kain R, Exner M, Brandes R, et al. Molecular mimicry in pauci-immune focal necrotizing glomerulonephritis[J]. Nat Med, 2008,14(10):1088-1096.
[5] Kain R, Tadema H, McKinney EF, et al. High prevalence of autoantibodies to hLAMP-2 in anti-neutrophil cytoplasmic antibody-associated vasculitis[J]. J Am Soc Nephrol, 2012, 23(3):556-566.
[6] 唐 莎, 张 莹, 施维维, 等. 溶酶体膜蛋白-2抗体诱导中性粒细胞胞外捕网形成的实验研究[J]. 免疫学杂志, 2012, (11):968-971.
[7] Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides[J]. Arthritis Rheum, 2013, 65(1):1-11.
[8] Heller I, Isakov A, Topilsky M. American College of Rheumatology Criteria for the diagnosis of vasculitis[J]. Ann Intern Med, 1999, 130(10):861.
[9] Kessenbrock K, Krumbholz M, Schonermarck U, et al. Netting neutrophils in autoimmune small-vessel vasculitis[J]. Nat Med, 2009, 15(6):623-625.
[10] Ara J, Mirapeix E, Rodriguez R, et al. Relationship between ANCA and disease activity in small vessel vasculitis patients with anti-MPO ANCA[J]. Nephrol Dial Transplant, 1999, 14(7):1667-1672.
[11] Suzuki K, Suzuki K, Nagao T, et al. Proposal of anti-moesin as a novel biomarker for ANCA-associated vasculitis[J]. Clin Exp Nephrol, 2013, 17(5):638-641.
[12] Fazzini F, Peri G, Doni A, et al. PTX3 in small-vessel vasculitides: an independent indicator of disease activity produced at sites of inflammation[J]. Arthritis Rheum, 2001, 44(12):2841-2850.
[13] Jaillon S, Peri G, Delneste Y, et al. The humoral pattern re-cognition receptor PTX3 is stored in neutrophil granules and localizes in extracellular traps[J]. J Exp Med, 2007, 204(4):793-804.
[14] Soares AC, Souza DG, Pinho V, et al. Dual function of the long pentraxin PTX3 in resistance against pulmonary infection with Klebsiella pneumoniae in transgenic mice[J]. Microbes Infect, 2006, 8(5):1321-1329.
[15] Baruah P, Propato A, Dumitriu IE, et al. The pattern re-cognition receptor PTX3 is recruited at the synapse between dying and dendritic cells, and edits the cross-presentation of self, viral, and tumor antigens[J]. Blood, 2006, 107(1):151-158.
[16] Guo T, Ke L, Qi B, et al. PTX3 is located at the membrane of late apoptotic macrophages and mediates the phagocytosis of macrophages[J]. J Clin Immunol, 2012, 32(2):330-339.
[17] Inforzato A, Peri G, Doni A, et al. Structure and function of the long pentraxin PTX3 glycosidic moiety: fine-tuning of the interaction with C1q and complement activation[J]. Biochemistry, 2006, 45(38):11540-11551.
[18] Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria[J]. Science, 2004, 303(5663):1532-1535.
[19] Urban CF, Ermert D, Schmid M, et al. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans[J]. PLoS Pathog, 2009, 5(10):e1000639.
[20] Norata GD, Marchesi P, Pulakazhi Venu VK, et al. Deficiency of the long pentraxin PTX3 promotes vascular inflammation and atherosclerosis[J]. Circulation, 2009, 120(8):699-708.
[21] Han B, Ma X, Zhang J, et al. Protective effects of long pentraxin PTX3 on lung injury in a severe acute respiratory syndrome model in mice[J]. Lab Invest, 2012, 92(9):1285-1296.

