pEGFP-HSP70重组质粒的构建及其在大鼠神经干细胞中的表达*
舒晓明, 逯 丹, 王 珍, 张婵娟, 赵佳仪, 朱丽红, 戚仁斌, 陆大祥
(暨南大学医学院病理生理学系,国家中医药管理局重点实验室,广东 广州 510632)
随着蛋白质研究的深入,人们发现更多疾病的真正原因与蛋白质异常折叠有关,如阿尔茨海默病(Alzheimer disease,AD)、帕金森病(Parkinson disease, PD)、亨廷顿舞蹈症(Huntington disease, HD)、牛海绵状脑病(bovine spongiform encephalopathy,BSE)、家族性高胆固醇血症、某些肿瘤等称之为“蛋白折叠病”[1]。而分子伴侣在蛋白质的折叠中起至关重要的作用,热休克蛋白70(heat-shock protein 70, HSP70)与多肽之间的可逆作用在蛋白质的折叠、转运、错误折叠多肽的降解及其调控过程中有着重要的作用[2-3]。
现今对神经退行性疾病的治疗还停留在对症治疗阶段,仍不能对该类疾病进行根本性的治疗。而基因治疗极有可能为该类疾病的治疗带来根本性的突破,在其治疗中合理选择基因靶细胞又是基因治疗成败的关键因素。由于神经干细胞(neural stem cells, NSCs)具备以下特点:能自我维持更新的能力,足以提供大量细胞;具有多向分化潜能,可分化为神经元、星形胶质细胞或少突胶质细胞;有一定迁移能力,能到达损伤或疾病部位并产生新的细胞。因其来源于胎脑神经组织,与宿主脑组织能很好整合,能在脑内增殖和分化[4-5]且有较低的免疫源性而被广泛地作为神经系统基因治疗的理想载体,这样能从根本上解决退行性疾病的功能神经元变性和数量的减少。携带了HSP70基因的神经干细胞能够从多靶点、多途径上有效地干预神经退行性疾病,是较为理想的治疗方法。
材 料 和 方 法
1 材料
大肠杆菌JM109、pMD19-T Simple平滑载体及质粒pEGFP-C2为TaKaRa产品。TRIzol试剂、限制性内切酶、T4 DNA连接酶、cDNA合成试剂盒、TaqDNA聚合酶、X-Gal和IPTG为TaKaRa产品。表皮生长因子(epidermal growth factor, EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)购自PeproTech。胎鼠神经干细胞传至第4代。Nucleofector device 及转染试剂(Lonza)。 DMEM/F12细胞培养基和单克隆鼠抗nestin (Millipore)。异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗小鼠Ⅱ抗和4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)购自上海生物工程公司。Olympus IX51型荧光倒置相差显微镜。
2 方法
2.1质粒pEGFP-HSP70的构建
2.1.1引物设计 根据GenBank报道的大鼠HSP70的全长cDNA序列(L16764.1),经Primer Premier 5.0分析,设计2个引物: 正义引物5’-CGGAATTCGATGGCCAAGAAAACAGCGATCG-3’,反义引物5’-CGCGGATCCGCGTAATCCACCTCCTCGATGG-3’。正义引物为HSP70全长cDNA 5’端的序列,引入EcoRⅠ酶切位点,含启始密码子ATG。反义引物为HSP70全长cDNA 3’端序列的互补序列,引入BamHⅠ酶切位点。
2.1.2总RNA的提取 取约100 mg新鲜SD大鼠胎肝组织,按步骤提取总RNA。凝胶电泳及A260/A280值明显提示所抽提的RNA是符合实验要求的。
2.1.3HSP70 cDNA的合成与PCR扩增测序 以Total RNA为模板,使用TaKaRa RNA LA PCR Kit(AMV) Ver.1.1进行RT反应,合成cDNA。再以合成的cDNA为模板,进行PCR扩增目的片段。按常规的PCR反应条件,取2 μL反转录产物为模板,先将样品于95 ℃变性5 min,加入2 UTaqDNA聚合酶,按下列参数循环30次:95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,最后一个循环72 ℃ 10 min。若扩增片段量少,可进行2次PCR扩增反应。并切胶回收目的片段,溶于15 μL ddH2O。使用DNA连接试剂将Insert DNA与pMD19-T Simple平滑载体连接后,热转化至E.coliCompetent JM109 细胞中,涂布平板后,37 ℃过夜培养。挑选阳性菌落,提取阳性克隆并命名后进行测序。测序后编号为ZL-8标本符合要求。
2.2HSP70 cDNA真核表达载体的构建 质粒pEGFP-C2及ZL-8用EcoRⅠ和BamHⅠ双酶切,切胶回收DNA片段。将载体和Insert片段连接,构建在体转基因重组质粒pEGFP-HSP70, 热转化至E.coliCompetent DH5α中,涂布平板过夜培养。挑选菌落,提取质粒后,再行双酶切检测,确认目的片段是否插入,酶切产物进行1%琼脂糖凝胶电泳。
2.3神经干细胞转染 取孕15 d的SD胎鼠,分离脑海马组织,进行神经干细胞培养[6]。培养基采用DMEM/F12、EGF 20 μg/L、bFGF 20 μg/L和2%B27,于37 ℃、5% CO2孵箱中培养,第1次换液在4~5 d后,以后按2 d换液1次。选取传代4次的NSCs进行实验[7]。转染采用Nucleofector device 及转染试剂,程序采用A-33。转染后24 h开始进行荧光显微镜观察, 培养克隆扩增阳性的荧光细胞, 采用Image-Pro Plus 6.0 软件对阳性的神经干细胞进行计数分析。
2.4神经干细胞鉴定 采用免疫组化方法:培养在载玻片上的细胞用4%多聚甲醛固定 30 min,在通风柜里晾干,0.01 mol/L PBS 漂洗 5 min×3 次,0.5% Triton X-100+10%山羊血清封闭30 min;加入Ⅰ抗小鼠抗大鼠nestin(1∶100),转入 4 ℃过夜;0.01 mol/L PBS 漂洗 5 min×3 次;加入 FITC 标记的山羊抗小鼠Ⅱ抗(1∶100),37 ℃、2 h避光;0.01 mol/L PBS 漂洗 5min×3 次;0.5% DAPI染色避光,1 h、0.01 mol/L PBS 漂洗 5 min×3 次,晾干,中性树脂封片。
2.5Western blotting检测及荧光观察 收集神经干细胞,抽提蛋白并测定蛋白浓度,加入等体积的上样缓冲液煮沸5 min待用。配制5%浓缩胶和10%分离胶,上样后电泳,用 60 mV电压使样品跑至分离胶后,用90 mV电压电泳至溴酚蓝距离底线0.5 cm左右。 电泳后取出硝酸纤维素膜及滤纸,按次序叠放在电转槽中,根据目的蛋白的分子量决定电转时间。牛奶封闭后加Ⅰ抗、Ⅱ抗稀释液,振摇孵育,用现配制的显色液避光显色。图像处理软件进行蛋白灰度分析。
使用Olympus IX51型荧光倒置相差显微镜进行荧光观察,观察转染后的神经干细胞中绿色荧光的表达,用488 nm波长紫外光激发,发射光波长为507 nm,选取 24 h、7 d、14 d及21 d荧光强度并使用 Image-Pro Plus 6.0软件分析。
3 统计学处理
数据用均数±标准误(mean±SEM)表示。采用 SPSS 15.0 统计软件进行单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 大鼠HSP70 cDNA的克隆
我们以TRIzol试剂来提取大鼠胎肝组织的总RNA,A260/A280为2.0, 凝胶电泳分析可见28S及18S两条RNA条带,说明抽提的总RNA符合实验要求。以上述合成的cDNA为模板进行PCR扩增后得到1条约1 926 bp的清晰条带;使用DNA连接试剂将Insert DNA与pMD19-T Simple平滑载体连接后,热转化至E.coliCompetent JM109 细胞中,涂布平板后,37 ℃过夜培养。挑取阳性克隆质粒进行测序,结果提示质粒ZL-8的序列与文献报道的序列一致。
2 重组质粒的构建
真核表达载体pEGFP-C2是一个带有突变绿色荧光蛋白的cDNA报告基因 ,在荧光显微镜下能够检测到该载体的表达。将克隆在pMD19-T Simple平滑载体中的大鼠HSP70基因片段以EcoRⅠ及BamHⅠ双酶切,经凝胶电泳分离;再与真核表达载体pEGFP-C2经双酶切及连接酶作用后构建成重组pEGFP-HSP70,见图1、2。
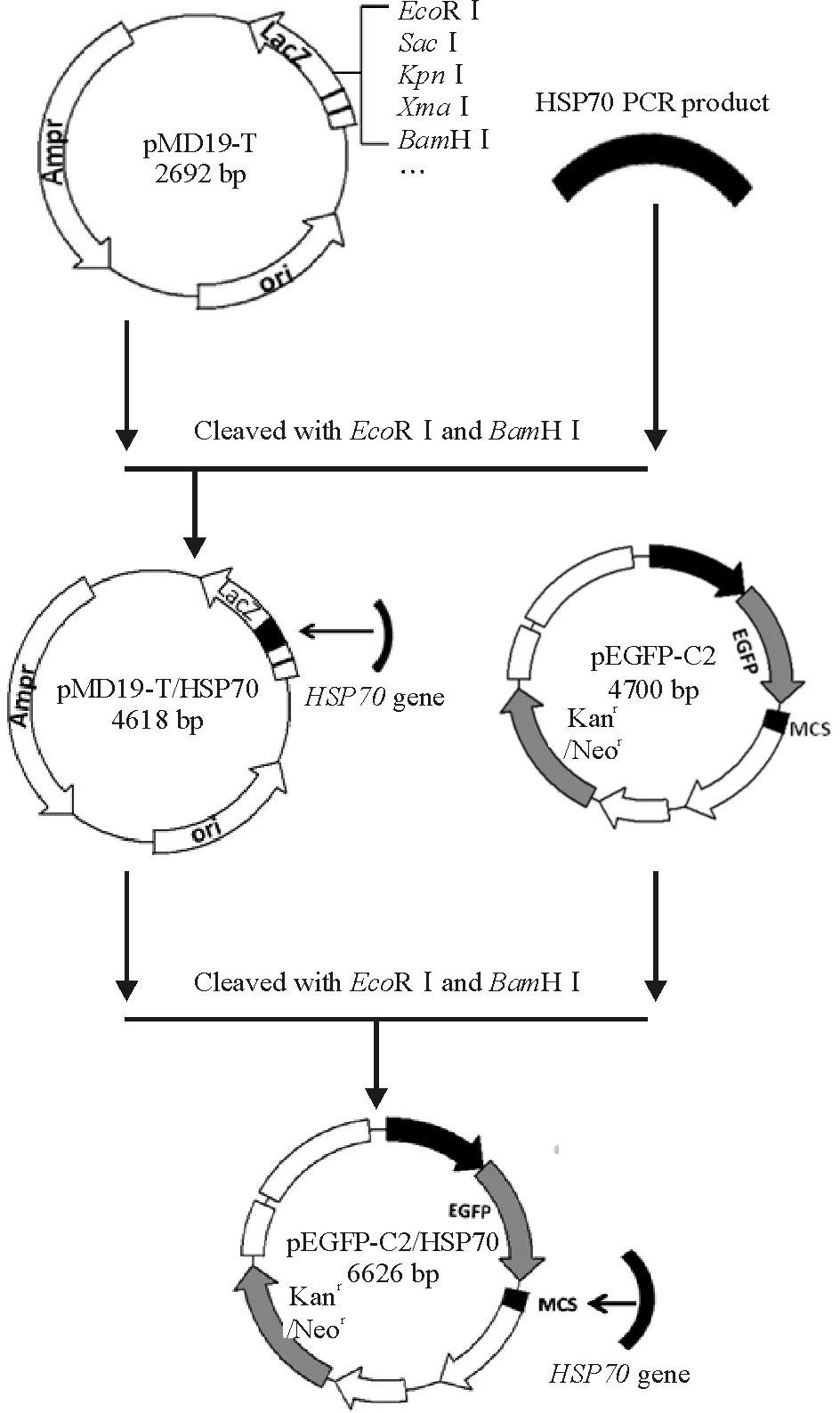
Figure 1. Construction of recombinant plasmid pEGFP-C2/HSP70.
3 神经干细胞提取及鉴定
从SD大鼠的胎鼠海马组织提取原代神经细胞干细胞。加入无血清的干细胞培养液,传至第4代用nestin抗体进行鉴定分析,鉴定后确认为神经干细胞,见图3。
4 神经干细胞的转染及表达
构建好的pEGFP-HSP70转染细胞后12 h就有荧光表达, 24 h荧光进一步增强 ,且一定时间内绿色荧光蛋白表达增多、亮度增强,2周之后荧光强度明显降低;HSP70的表达在14 d升高到最高后也逐渐降低,见图4~6。

Figure 2. Identification of PCR product (A) and recombinant pEGFP-C2/HSP70 plasmid (B) by enzyme digestion.M1: DL2000 DNA marker: M2:λ-Hind Ⅲ digest; 1: PCR product; 2: positive control; 3: negative control; 4: pEGFP-C2 digested by EcoR I and BamH I; 5: pEGFP-C2/HSP70 digested by EcoR I and BamH I; 6: pMD19-T/HSP70 digested by EcoR I and BamH I.
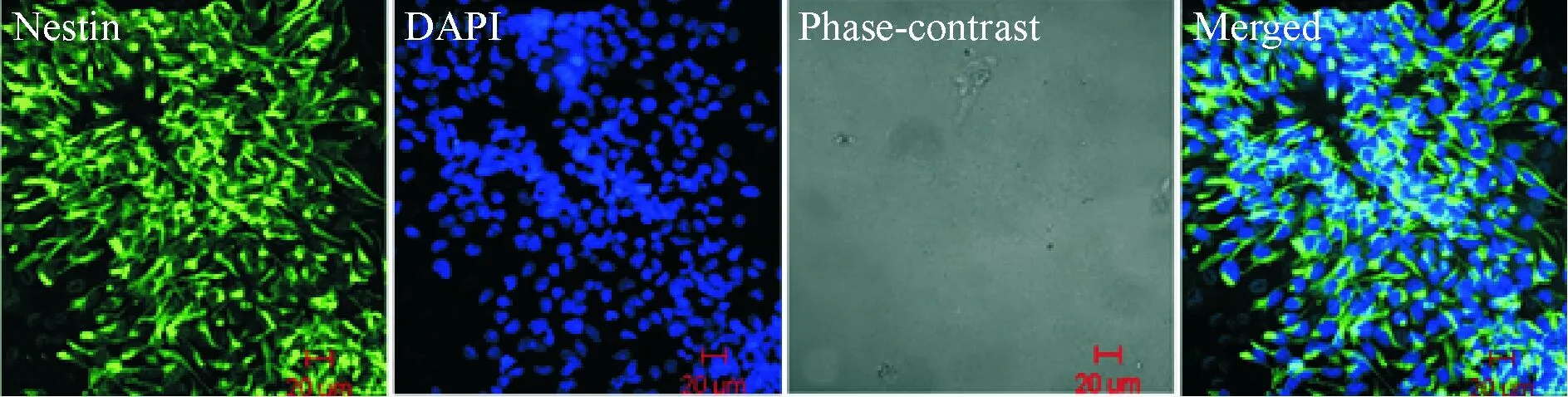
Figure 3. Identification of neural stem cells. Neurospheres were stained with nestin.Abundant fluorescent neurospheres were present. Scale bars: 20 μm.

Figure 4. Comparison of fluorescence intensity of each group 24 h after transfection (×100).Mean±SEM.n=6.**P<0.01 vs control.
讨 论
当前随着世界人口的老龄化,神经退行性疾病人数急剧上升。据统计2013年美国有520万人患有AD,100万人患有PD[8]。今年估计45万美国人会死于AD。AD已成为心脑血管疾病及肿瘤之后又一大致死病因。这给家庭和社会造成了巨大的精神和经济负担[9-10],引起了全社会的高度关注。神经干细胞具有自我复制、增殖的能力,定向分化的特征,被医学界广泛认为在神经退行性疾病的治疗中干细胞治疗占有十分重要的地位,已成为医学研究的热点。大量的研究表明:使用细胞因子或细胞因子诱导剂可以诱导神经干细胞分化成特定的功能性神经细胞,直接修复和替代受损神经细胞;另一方面移植的干细胞自身也能产生大量细胞因子参与修复损伤过程。神经干细胞及转基因神经干细胞的治疗最有可能成为该类疾病根治的希望。当神经干细胞以及携带目的基因或细胞因子的基因植入体内,既可表达外源性基因,产生相应的生长因子或细胞因子,诱导自身干细胞定向分化;又可补充神经细胞的不足,达到基因治疗和细胞替代的双重作用[11]。

Figure 5. Structural gene containing neural stem cells in fluorescence intensity at each time point(×100). Mean±SEM.n=6.*P<0.05, **P<0.01 vs 1 d.

Figure 6. HSP70 of expression in neural stem cells. Mean±SEM.n=6.*P<0.05, **P<0.01 vs control.
“分子伴侣”在生物生命活动占有极其重要的地位,HSP70是最主要的成分和最重要的功能单位,它辅助形成特定的蛋白质构象并维持蛋白质正常的构象,既可帮助新合成多肽键的生理折叠与伸展,也可使未折叠的多肽链更加稳定。当机体发生异常时,蛋白质构象发生异常变化导致蛋白质错误折叠并聚集; 可反应性引起HSP70表达的上调,识别和结合异常蛋白质,并通过ATP酶作用产生能量,改变蛋白的异常折叠,并辅助其重新折叠;保护正常蛋白质不与变性蛋白质相互结合,从而阻止蛋白质的异常聚积。而许多神经退行性疾病其发病的机制就是由于蛋白的异常折叠并聚合形成了毒性病理产物,引起了疾病的发生发展。其外,HSP70在机体应激时加快正常蛋白质合成,使应激时造成的蛋白质数量的减少得到补充,并可帮助维持蛋白的跨膜转运,保证线粒体、内质网等正常功能的发挥。
在我们选取HSP70作为目的基因,神经干细胞作为靶细胞,pEGFP-C2作为表达载体,构建重组质粒pEGFP-C2/HSP70。而pEGFP-C2为一种带增强型绿色荧光蛋白报告基因的真核表达载体,能将克隆至其中的目的片段高效表达并利于观察。转染采用Lonza公司发明的Nucleofector 转染技术,该技术是将电穿孔技术和专用的优化转染试剂结合起来,对不同的细胞类型,采用最优化的转染程序。我们观察到pEGFP-HSP70转染神经干细胞效率达 50%左右,细胞的存活率近 85%。Nucleofector 技术与脂质体及病毒转染载体相比优点明显,可以更贴近临床应用,其外,操作较为简单,转染效率较高,尤其对悬浮的、难转细胞优势明显。我们的实验发现重组质粒pEGFP-HSP70转染干细胞后,其荧光强度及HSP70的表达与时间密切相关,转染24 h至2周有较高的荧光强度及HSP70的表达,2周后衰减明显,这为转基因干细胞选择最佳移植治疗时期提供了有价值的依据。神经干细胞移植治疗因蛋白折叠所致的退行性疾病是一种较有效的方法, 特别是当神经干细胞携带有靶向治疗基因HSP70基因后,我们前期的实验已证明能明显改善了AD模型鼠的行为学指标,达到治疗目的。
[参 考 文 献]
[1] Findeis MA. The role of amyloid beta peptide 42 in Alzheimer’s disease [J]. Pharmacol Ther,2007,116(2):266-286.
[2] Sarkar M, Kuret J, Lee G. Two motifs within the tau microtubule-binding domain mediate its association with the hsc70 molecular chaperone [J]. J Neurosci Res,2008,86(12):2763-2773.
[3] Rujano MA, Kampinga HH, Salomons FA. Modulation of polyglutamine inclusion formation by the Hsp70 chaperone machine [J]. Exp Cell Res, 2007,313(16):3568-3578.
[4] Liu WG, Wang XJ, Lu GQ, et al. Retraction: Dopaminergic regeneration by neurturin overexpressing c17.2 neural stem cells in a rat model of Parkinson’s disease [J]. Mol Neurodegeneration,2009, 4:45.
[5] Wong AM, Hodges H, Horsburgh K. Neural stem cell grafts reduce the extent of neuronal damage in a mouse model of global ischaemia [J]. Brain Res, 2005, 1063 (2): 140-150.
[6] Blurton-Jones M, Kitazawa M, Martinez-Coria H, et al. Neural stem cells improve cognition via BDNF in a transgenic model of Alzheimer disease [J]. Proc Natl Acad Sci U S A, 2009, 106(32):13594-13599.
[7] Deng X, Liu R, Feng Z, et al.Invitroculture and differentiation of rat embryonic midbrain-derived neural stem cells [J]. Neural Regen Res,2008, 3(11):1241-1244.
[8] Ferri CP, Prince M, Brayne C, et al. Global prevalence of dementia: a Delphi consensus study [J]. Lancet, 2005, 366(9503): 2112-2117.
[9] Alzheimer’s Association.2013 Alzheimer’s disease facts and figures [J]. Alzheimers Dement, 2013, 9(2):208-245.
[10] Zhao R, Xuan Y, Li X, et al. Age-related changes of germline stem cell activity, niche signaling activity and egg production in Drosophila [J]. Aging Cell, 2008, 7(3): 344-354.
[11] 王 瑒,李 正,王小娜,等.雷奈酸锶通过上调骨形态发生蛋白2的表达促进骨髓间充质干细胞分化为成骨细胞[J]. 中国病理生理杂志,2012, 28(3): 404-408.

