改良右心导管法测量大鼠肺动脉压力的实验方法研究*
邹丽珍, 陈马云, 黄晓颖, 王良兴
(温州医科大学附属第一医院呼吸内科,呼吸循环重点实验室,浙江 温州 325000)
右心导管法记录肺动脉压力较之超声根据反流估计肺动脉压力,其结果准确而直接,故被广泛用于肺动脉高压领域的研究[1-3]。但该法是一种盲插法,由于大鼠解剖结构的关系,导管容易插入腋静脉、右心耳、下腔静脉,导致测压失败、出血、甚至大鼠死亡,实验数据丢失。国内外文献虽见该法测定肺动脉压的报道,多集中于介绍大鼠肺动脉压力的范围,未见详细导管推送步骤及操作技巧的介绍,未见导管进入右心室和肺动脉的详细步骤及完整的波形分析[4-7]。因该方法技术掌握需要较长时间,及需要大量动物进行预实验培训,限制了其推广。我们对聚乙烯(polyethylene,PE)管进行改造并对插管方法进行探索,通过解剖实验动物确定导管头所在位置及开口朝向,明确不同波形的意义,指导导管推送过程,总结出一套行之有效的大鼠肺动脉测压方法。本方法具有插管耗时少、成功率高、测压准确,同时具有设备及导管易得、方法易掌握的优点。
材 料 和 方 法
1 动物
健康清洁级雄性SD大鼠120只,体重300~350 g(上海斯莱克实验动物有限责任公司提供),其中20只建立肺动脉高压模型。
2 试剂
2%戊巴比妥钠(Sigma,4 mL/kg),肝素生理盐水(1∶500),75%乙醇。
3 器材
PE导管(外径0.9 mm,内径0.5 mm,长度25 cm),直尺,酒精灯,5号针头,三通管,5 mL注射器,细棉线1包,纱布2块,橡皮筋4条,解剖用器械包括(直镊2把,弯镊1把,止血钳2把,眼科剪1把,组织剪1把);PowerLab 8/35及其配套的压力换能器。
4 方法
4.1右心导管的制作 剪一段25 cm的PE导管,外径0.9 mm,内径0.5 mm,尾端连接5号针头以方便连接压力换能器。以直尺为标准,1 cm为单位做标记,从1 cm至7 cm共7个点。在8 cm处缠上胶布作为手的握持处。导管头端1 cm的位置放在酒精灯外焰上方1.5 cm的位置加热,待管子软化以1 cm处为支点维持弯曲度为90°的角,待自然冷却至室温,重复几次成型,头端2 mm处用同样的方法使其向内弯曲30°,而在3 cm处做成轻微的圆弧弯曲,见图1。注意导管尖端不可剪成尖锐锐角,以免尖端过锐损伤心血管壁。

Figure 1. Home-made PE catheter.
4.2仪器准备 将压力换能器与三通管和5号针头连接,用肝素化的生理盐水充满换能器和导管,保证换能器和导管内没有气泡,特别是在针头前端和换能器内,保留针筒插在三通管上,便于肝素生理盐水冲洗导管以抗凝。
4.3SD大鼠备用 取其中的20只建立肺动脉高压的模型,置于常压低氧舱内,充入N2使O2浓度维持在8.5%~11.0%,CO2浓度维持在1.0%~3.0%,每天8 h(8:00~16:00),每周6 d,连续4周。待模型建好后,所有大鼠称重,2%戊巴比妥钠麻醉,固定,剪去颈右半部体毛,75%医用乙醇消毒,从外上向内下剪开颈右半部皮肤2 cm至锁骨上部,钝性分离皮下组织和肌肉,暴露颈外静脉,剔除其表面脂肪组织,游离约1 cm,远心端用细棉线结扎,近心端打松结备用。
4.4插管 用弯镊提起颈外静脉,朝心室方向剪开一个2~3 mm“V”字开口,迅速插入导管,并稍稍扎紧近心端的棉线用于止血,用纱布擦去出血,用弯镊提起血管下面的结缔组织并轻轻往后拉,使颈外静脉拉直。保持导管头朝内,标记朝外1~1.5 cm的时候成功避开了腋静脉,继续前进至2 cm时接近右心耳,此时需要轻轻顺时针旋转90~180°达到导管头朝外,标记朝内避开右心耳,大约在3 cm的位置到达心房,继续保持原方向前进,多在4~4.5 cm到达房室口,具体长度根据鼠的体重多少,一般大鼠体重越重长度越长,在房室口的位置,可看见握持处的胶布震动与心跳频率类似,此时缓慢逆时针旋转,将标记旋转至外上方向,也即导管头通过逆时针转至内下方向勾住房室口进入右心室,可见到振幅较大的心室波,继续往里前进0.5 cm待心率正常,波形稳定后顺时针旋转导管至标记在下方,即导管头朝上时前进1~2 cm即进入肺动脉,可见受呼吸影响的肺动脉波,继续前进0.5~1 cm可见到较稳定的肺动脉波。
结 果
1 插管
我们对120只成年SD大鼠进行右心导管法插管,114只成功插入,成功率在95%,有1只大鼠死于麻药过量,2只死于心律失常,3只死于出血过多,可见插管者的操作手法是实验成败的关键。
2 波形分析
2.1导管进入腋静脉示意图及压力曲线分析 第1段为静脉波,第2段为右心房波,第3段为右心室波。静脉波最为平缓,刚插入导管即出现,缓慢上升后缓慢下降,升支降支不明显,此时如果导管头端朝外则容易进入腋静脉。进入右心房后,出现升支降支明显,中间的波幅较小的心房波,收缩压与舒张压相差不明显。继续进入右心室后出现第3段骤升骤降的心室波,舒张压在接近0的位置波动,但压差比较稳定,见图2。
2.2导管进入右心耳的示意图及压力曲线分析 在导管头朝内插入2 cm左右,若不改变导管头部的朝向,出现心房波后,很容易进入右心耳出现心耳波,见图3。右心耳是右心房上部向左前突出的部分,由于右心耳贴在右心室的前面,故其波形受心室收缩舒张的影响,振幅比右心房的大,但小于右心室波,波形与导管堵在下腔静脉口类似,两者的区别是插入的长度不同。
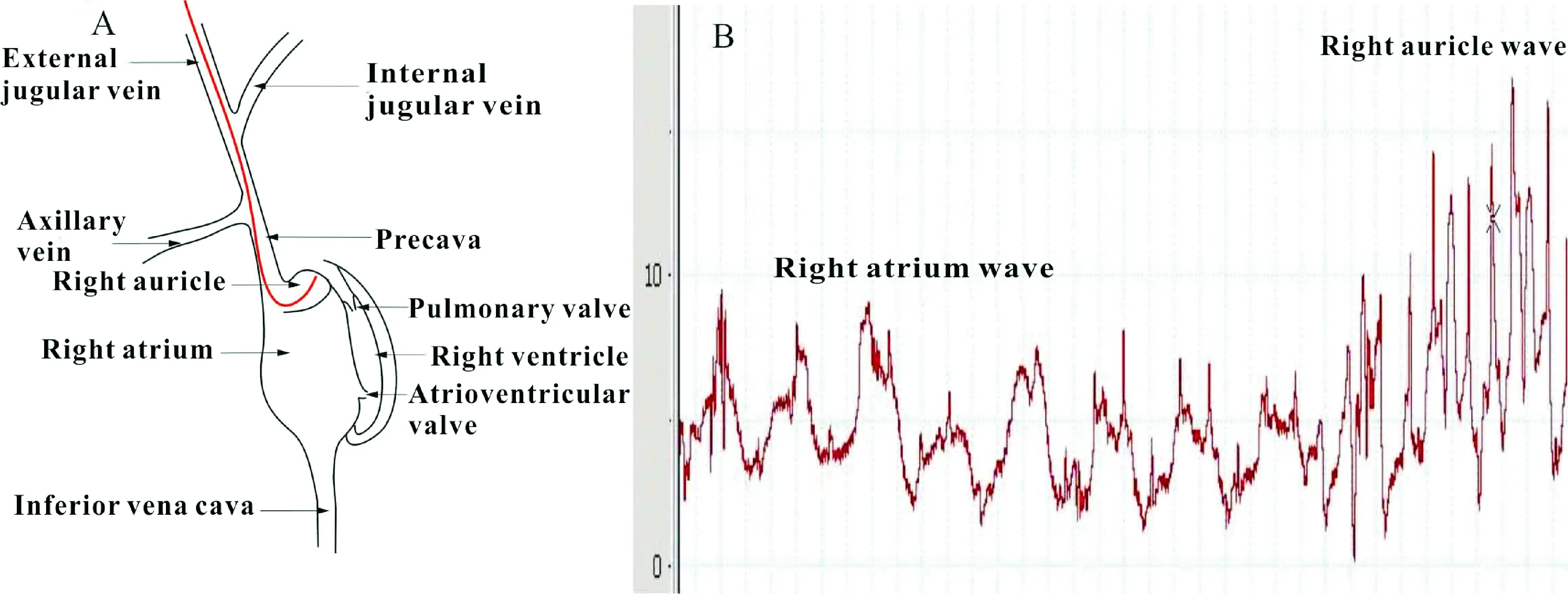
Figure 3. The anatomy diagram and pressure curve when catheter was in right auricle.A:the anatomy diagram when catheter went into right auricle; B: the waves of the right atrium and right auricle in normal SD rats.
2.3导管抵在下腔静脉示意图及压力曲线分析 不论导管是堵在下腔静脉口,还是插入右心耳,头端紧贴心室肌。故波形接近右室波,但振幅偏小,见图4。
2.4导管进入肺动脉示意图及压力曲线分析 肺动脉1段此时导管处于肺动脉口部,与右心室仅隔了一个肺动脉瓣,当右心室收缩时,肺动脉瓣开放,右心室和肺动脉的压力相等且达到最大,这里说的相等是肺动脉口的压力。所以当导管处于肺动脉口时,出现肺动脉1段波形,而由于肺动脉是一段有阻力的血管,越往里,血管的压力越小,也由于离心室越远,所以从肺动脉1到肺动脉2到肺动脉3,波形与心室的相似度减小,其中肺动脉3最稳定,一般为实验所取的肺动脉压力,此时导管处于肺动脉中后段位置,见图5。

Figure 4. The anatomy diagram and pressure curve when catheter was trapped in postcava. A: the anatomy diagram when catheter was trapped in postcava; B: the waves of the jugular vein, right atrium, inferior vena cava, atrioventricular orifice and right ventricle in normal SD rats.
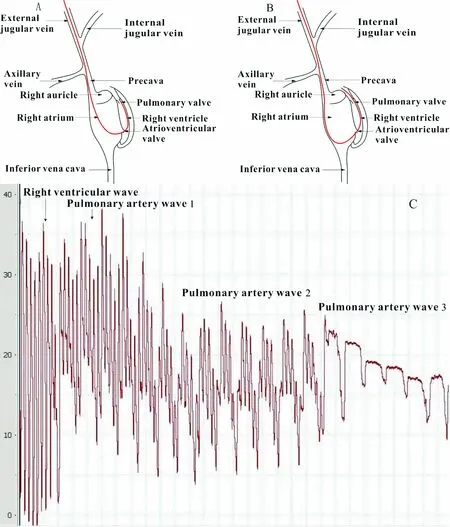
Figure 5. The anatomy diagram and pressure curve when catheter was in pulmonary artery. A: the anatomy diagram when catheter was close to pulmonary valve; B: the anatomy diagram when catheter went into pulmonary artery; C: the waves of the right ventricle and pulmonary artery (1, 2, 3) in normal SD rats.
2.5肺动脉高压压力曲线分析 肺动脉高压大鼠右室波和肺动脉波的形状与正常大鼠的类似,最主要的区别是压力的高低,见图6。
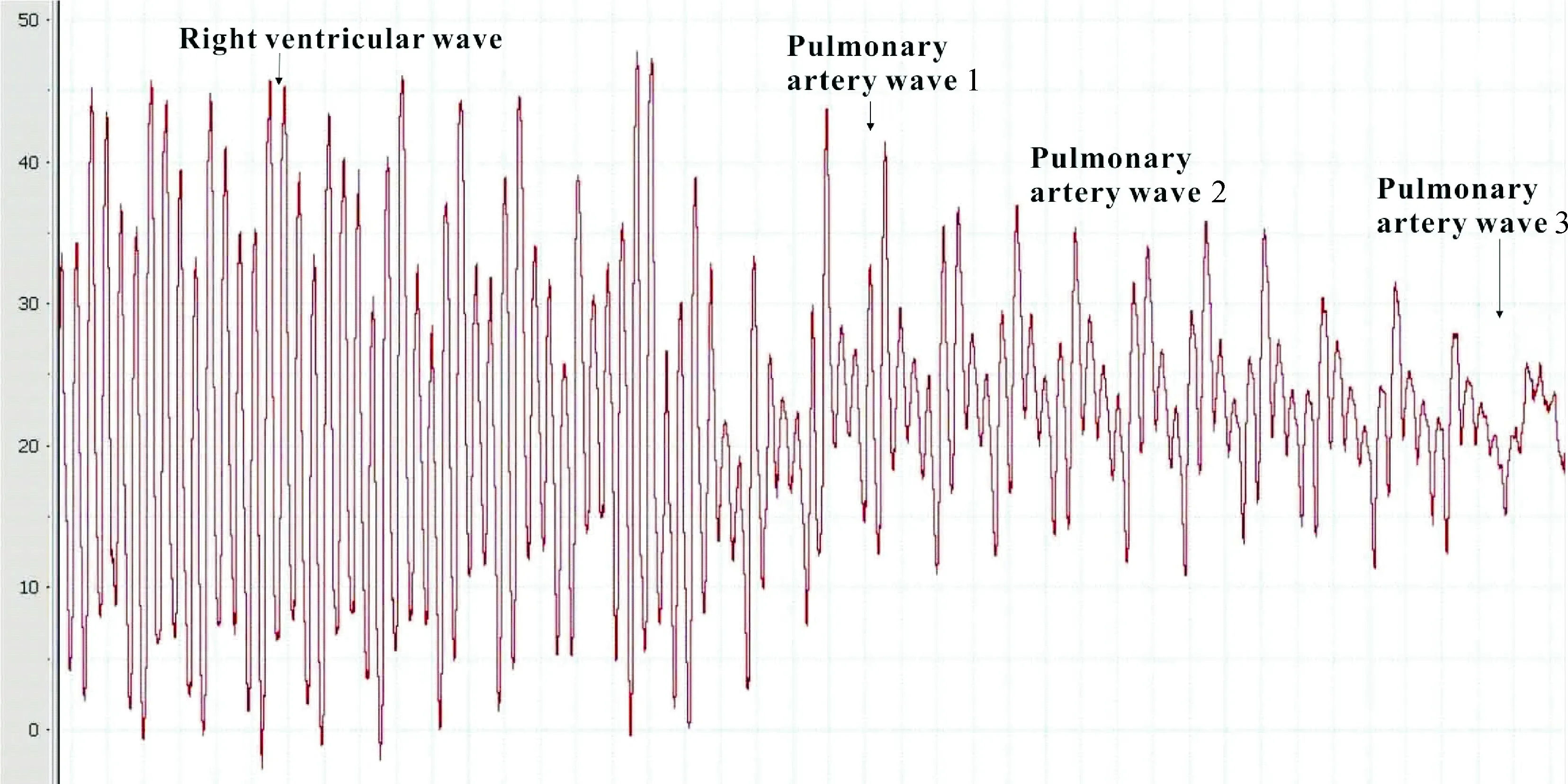
Figure 6. The waves of the right ventricle and pulmonary artery (1, 2, 3) in SD rats with pulmonary hypertension.
讨 论
我们实验室用PE导管自制右心导管进行插管,所得波形与国内外文献的报道一致[4-9]。在插管的过程中,遇到一些问题,比如盲插法无法直视导管所在位置,导管容易进入腋静脉、右心耳或下腔静脉;导管如果太硬容易搓破血管或心脏,但如果太软则进入心室不能保持头端只向肺动脉的方向,容易抵壁,出现“假”肺动脉波形等。针对这些问题,很多学者都提出了改良方案,包括用套管引导插管[10-11]和用导丝引导X线机直视下插管[6],但是这些方案仍有缺陷。套管较硬,一方面操作不当容易造成出血,另一方面进入心室抵壁后易导致心律失常,而导丝引导法则要求有X线机的协助。于是我们实验室总结右心导管法的经验,力求避免传统右心导管法的盲目性和缺陷性。
用酒精灯外焰干烤法制作的导管软硬度合适,且弯曲角度维持的时间持久。在完成解剖后,依次插入颈外静脉、锁骨下静脉、上腔静脉、右心房、右心室和肺动脉。在操作中遇到下列问题可能会造成插管失败。(1)插入腋静脉(图2A):如果刚开始插入是导管头朝外容易进入腋静脉,使得在2 cm左右仍为静脉波,导管的头端会卡在静脉,有很大的阻力,此时不能盲目用力,需要轻轻退出导管,逆时针旋转导管至标记朝外,导管头朝内前进。(2)插入右心耳(图3A):导管头朝内插入超过2 cm出现心房波后,很容易进入右心耳出现心耳波,心耳波受心室收缩舒张的影响,振幅比右心房的大,但小于右心室波,波形与导管堵在下腔静脉口类似,两者的区别是插入的长度不同。一旦插入右心耳,退出来后还是会比较容易再次进入,因此在退出导管0.5 cm后要顺时针旋转90~180°,并用手紧紧握住导管推进,保证其不再进入右心耳。(3)插入下腔静脉(图4A):插入超过4~5 cm出现类似心耳波,即可推断导管头弯曲的部分卡在下腔静脉,由于导管前端弯曲部分的直径远远大于下腔静脉,因此如果不是导管最前端的头部已经进入下腔静脉,而是弯曲的部分卡在下腔静脉口,那将会有很大的阻力,如果继续用力,很可能搓破静脉导致出血,因此需要退出0.5 cm退出下腔静脉到房室口,再逆时针旋转导管至标记在外上的部分。(4)插不进肺动脉:进入心室时导管头朝向是内下,若不调整导管的方向,继续前进则容易抵壁出现类似于波浪状的波形,有时会误认为肺动脉波,即假肺动脉波。此时需要稍退出导管头,出现规整的心室波后,将导管头调整到朝上再继续前进,见图5。此时我们制作的导管的优势就体现出来了,见图1,我们在3 cm处做了一个微小的弧度,在导管从右心室进入肺动脉的过程,可以以这个弧度为支撑,使前面的1 cm头端更贴近肺动脉口,而且在制作尖端的2 mm时是向内弯曲30°,使得在导管前进时尖端不会直接抵入心室壁,减少心律失常的发生。
肺动脉波的特点:(1)心室之后的延续波,肺动脉口的波形受心室收缩和舒张影响振幅比较大(图5B、6B的肺动脉1段和2段),继续往里面插入0.5~1 cm波幅变小,见肺动脉3段,此段波形受体循环的影响较小,最能反映出肺循环的变化;(2) 肺动脉口的收缩压与右心室的收缩压持平,而舒张压高于右心室的舒张压,越往后由于动脉阻力的关系,收缩压下降;(3)受呼吸影响,每隔4~5个波会有深降波;(4)可见肺动脉楔压。
右心导管插管法测定肺动脉压力由于是一种盲插法,掌握需要较长时间的训练及一定技巧。我们实验室总结了在插管过程中遇到的问题,采用自制的PE导管通过右颈外静脉插管,通过完整的波形分析,指导导管推送过程,采用改良右心导管法测定肺动脉压力,获得了较高的成功率。本研究有助于初学者更加快速准确地掌握该技术,较少动物损耗,节约实验成本。
[参 考 文 献]
[1] 鲁亚南, 丁文祥, 陈 恩, 等. 大鼠右室肥厚模型的制作及右心导管法测定大鼠右室压[J]. 中国比较医学杂志, 2004, 14(1): 31-34.
[2] 李 娟, 孙 新, 毕 辉, 等. 低压低氧性大鼠肺动脉高压模型的建立[J]. 临床心血管病杂志, 2008, 24(4): 297-301.
[3] 黄晓颖, 樊 荣, 卢圆圆, 等. 红景天苷对常压肺心病大鼠保护作用的研究[J]. 中华中医药学刊, 2011, 29(8): 1868-1871.
[4] 孙 波, 刘文利. 右心导管测定大鼠肺动脉压的实验方法[J]. 中国医学科学院学报, 1984, 6(6): 465-467.
[5] Deten A, Millar H, Zimmer HG. Catheterization of pulmonary artery in rats with an ultraminiature catheter pressure transducer[J]. Am J Physiol Heart Circ Physiol, 2003, 285(5): H2212-H2217.
[6] 杨杰章, 黄石安, 陈 灿, 等. 大鼠经颈外静脉导丝引导插管测肺动脉压与传统方法的比较[J]. 中国比较医学杂志, 2010, 20(9): 44-50 .
[7] 袁 平, 吴文汇, 刘 岽, 等. 改良心导管测定大鼠肺血管阻力的方法[J]. 中华心血管病杂志, 2011, 39(10): 901-904.
[8] 狄 枫, 王良兴, 沈巨信, 等. CX3CL1/fractalkine在肺动脉高压过程中的表达变化及葛根素的干预作用[J]. 中国病理生理杂志, 2011, 27(3): 581-584, 588.
[9] 黄晓颖, 樊 荣, 蔡学定, 等. 腺苷A2a受体在红景天苷调节大鼠低氧性肺动脉高压中的作用[J].中国病理生理杂志, 2012, 28(12):2135-2140.
[10] Herget J, Palecek F. Pulmonary arterial blood pressure in closed chest rats. Changes after catecholamines, histamine and serotonin[J]. Arch Int Pharmacodyn Ther,1972, 198(1): 107-117.
[11] Hayes BE, Will JA. Pulmonary artery catheterization in the rat[J]. Am J Physiol,1978, 235(4): H452-H454.

