血管紧张素Ⅱ对人单核细胞源树突状细胞免疫功能的影响*
黄 东, 陆 浩, 姚 康, 孙爱军, 邹云增, 葛均波
(复旦大学附属中山医院心内科,上海市心血管病研究所,上海 200032)
血管紧张素II(angiotensin II, Ang II)是肾素-血管紧张素系统(renin-angiotensin system,RAS)激活后产生的主要血管活性物质,在多种心血管疾病,如高血压、心力衰竭和冠心病的发生发展中起重要作用[1]。近来的研究发现,Ang II还与很多炎症性疾病,如免疫介导的肾小球肾炎、移植物排斥、关节炎等的发生发展有关[2]。另一方面,在免疫过程中起重要抗原递呈作用及免疫调节作用的树突状细胞(dendritic cells,DCs)在动脉粥样硬化发病中的作用受到广泛关注[3]。然而,Ang II对树突状细胞分化及免疫功能的影响仍不清楚。本研究拟通过体外观察Ang II对人单核细胞源树突状细胞免疫成熟进程及其摄取氧化低密度脂蛋白(oxidized low-density lipoprotein,Ox-LDL)功能的影响,以初步探讨Ang II参与动脉粥样硬化发生发展的新机制。
材 料 和 方 法
1 主要试剂
浓缩白细胞由上海市血液中心提供。CD14+免疫磁珠及相关产品购自Milteny Biotech。白细胞介素(interleukin, IL)-12和干扰素(interferon, IFN)-γ的酶联免疫吸附试验(ELISA)检测试剂盒购自R&D。淋巴细胞分离液(Histopaque-1077)购自Sigma。RPMI-1640培养基和胎牛血清购自Gibco。重组人粒细胞-巨噬细胞集落刺激因子(recombinant human granulocyte-macrophage colony-stimulating factor,rhGM-CSF)和重组人IL-4(recombinant human interleukin-4, rhIL-4)购自R&D。Ang II和血管紧张素II受体1拮抗剂(angiotensin II receptor 1 antagonist, ARB)洛沙坦购自Sigma。FITC荧光标记的抗人单克隆抗体CD83和人类白细胞抗原DR(human leukocyte antigen DR, HLA-DR)购自BD。Trizol试剂和SuperScript III逆转录酶购自Invitrogen。GoTaq qPCR Master Mix购自Promega。荧光DiI标记的氧化低密度脂蛋白(DiI-labelled oxidized low-density lipoprotein, DiI-Ox-LDL)购自北京协生生物科技有限责任公司。
2 DCs的培养及分组[1]
取正常人外周血单采白细胞,经淋巴细胞分离液密度梯度离心分离出单个核细胞,PBS重悬后加入Fc拮抗剂和CD14+免疫磁珠,4 ℃孵育20 min,经分离柱流洗,分选出纯度大于98%的CD14+单核细胞,加入含有10%胎牛血清、100 μg/L rhGM-CSF和50 μg/L rhIL-4的RPMI-1640培养液,隔天换液。在细胞培养的第6天分别加入不同终浓度的Ang II(1、10、100 nmol/L)干预24 h,以PBS作为阴性对照。在细胞培养的第5天加入10 μmol/L洛沙坦预干预24 h,然后加入100 nmol/L Ang II干预24 h,以PBS作为阴性对照。每日观察细胞生长情况,干预结束后收集悬浮细胞和上清。
3 DCs免疫表型和细胞因子的检测
收集干预的DCs,用PBS清洗后重悬,调整细胞浓度为5×108/L,分别加入FITC荧光标记的抗人单克隆抗体CD83和HLA-DR,4 ℃孵育30 min,PBS洗2次后,加2%多聚甲醛固定,置4 ℃避光保存,24 h内用FACSCalibur流式细胞仪检测,CellQuest软件分析检测结果。
收集细胞培养上清,储存于-70 ℃冰箱,按照说明书用ELISA检测试剂盒测定各组细胞培养上清液中细胞因子IL-12和IFN-γ的浓度。
4 Real-time PCR检测清道夫受体mRNA的表达
收集干预的DCs,采用Trizol试剂常规方法抽提总RNA,分光光度法测定计算提取的总RNA含量及浓度。取5 μg总RNA以oligo-dT为引物,SuperScript III RT为逆转录酶进行逆转录反应。将上述逆转录产物稀释后作为模板进行3种清道夫受体[清道夫受体A(scavenger receptor A,SR-A)、CD36和凝集素样Ox-LDL受体1(lectin-like Ox-LDL receptor 1, LOX-1)]的PCR扩增,其引物序列分别为:SR-A上游引物5’-TCCTCGTGTTTGCAGTTCTC-3’,下游引物5’-GCAATTCTTCGTTTCCCACT-3’;CD36上游引物5’-CGCTGAGGACAACACAGTCT-3’,下游引物5’-GTTGTCAGCCTCTGTTCCAA-3’;LOX-1上游引物5’-GGGCTCATTTAACTGGGAAA-3’,下游引物 5’-GAAATTGCTTGCTGGATGAA-3’。采用ABI 7500实时荧光定量PCR仪进行PCR 反应,mRNA的表达采用标准曲线法分析。
5 Ox-LDL的摄取
为了检测DCs对Ox-LDL的摄取,收集干预的DCs,用PBS清洗后重悬,各组细胞加入10 mg/L的荧光标记的DiI-Ox-LDL,37 ℃孵育60 min,PBS洗3次后,用流式细胞仪检测DiI-Ox-LDL的摄取分数。
6 统计学处理
数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,LSD法进行两两比较,以P<0.05为差异有统计学意义。
结 果
1 AngⅡ和洛沙坦对DCs免疫表型和分泌细胞因子的影响
收集干预24 h的悬浮细胞,经流式细胞术进行表型分析显示,与阴性对照PBS组相比,Ang II干预后细胞表达CD83和HLA-DR明显增加,且呈浓度依赖性升高。与浓度为100 nmol/L Ang II干预的DCs相比,10 μmol/L洛沙坦预处理可明显抑制Ang II诱导的CD83、HLA-DR表面分子的表达,见图1A、B。通过ELISA法对细胞培养上清液定量检测表明,与PBS组相比,Ang II干预后DCs分泌IL-12和IFN-γ水平明显升高,且呈浓度依赖性,同样10 μmol/L洛沙坦预处理可明显减弱Ang II诱导的DCs分泌IL-12和IFN-γ,见图1C、D。
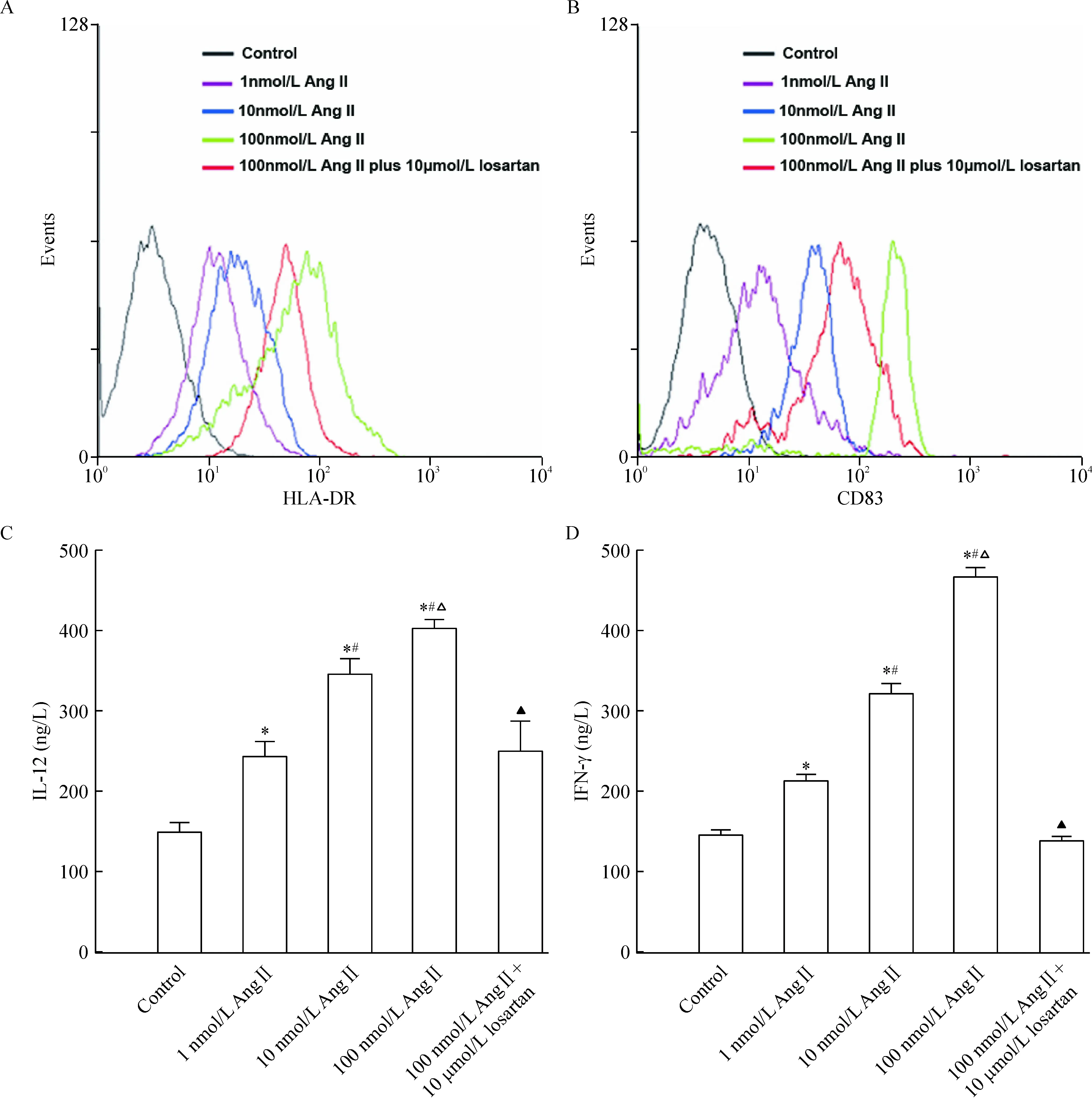
Figure 1. Immunophenotypic expression and cytokine secretion in DCs exposed to Ang II and losartan. Flow cytometric analysis was performed for surface HLA-DR (A) and CD83 (B) expression examinations. The concentrations of IL-12 (C) and IFN-γ (D) in the supernatants of the culture were measured by ELISA.Mean±SD.n=3.*P<0.05 vs control; #P<0.05 vs 1 nmol/L Ang II;△P<0.05 vs 10 nmol/L Ang II;▲P<0.05 vs 100 nmol/L Ang II.
2 AngⅡ和洛沙坦对DCs摄取Ox-LDL的影响
与对照组相比,Ang II干预可呈浓度依赖性促进DCs对DiI-Ox-LDL的摄取。而在100 nmol/L Ang II基础上,10 μmol/L洛沙坦预处理可部分抑制DCs对DiI-Ox-LDL的摄取,见图2。
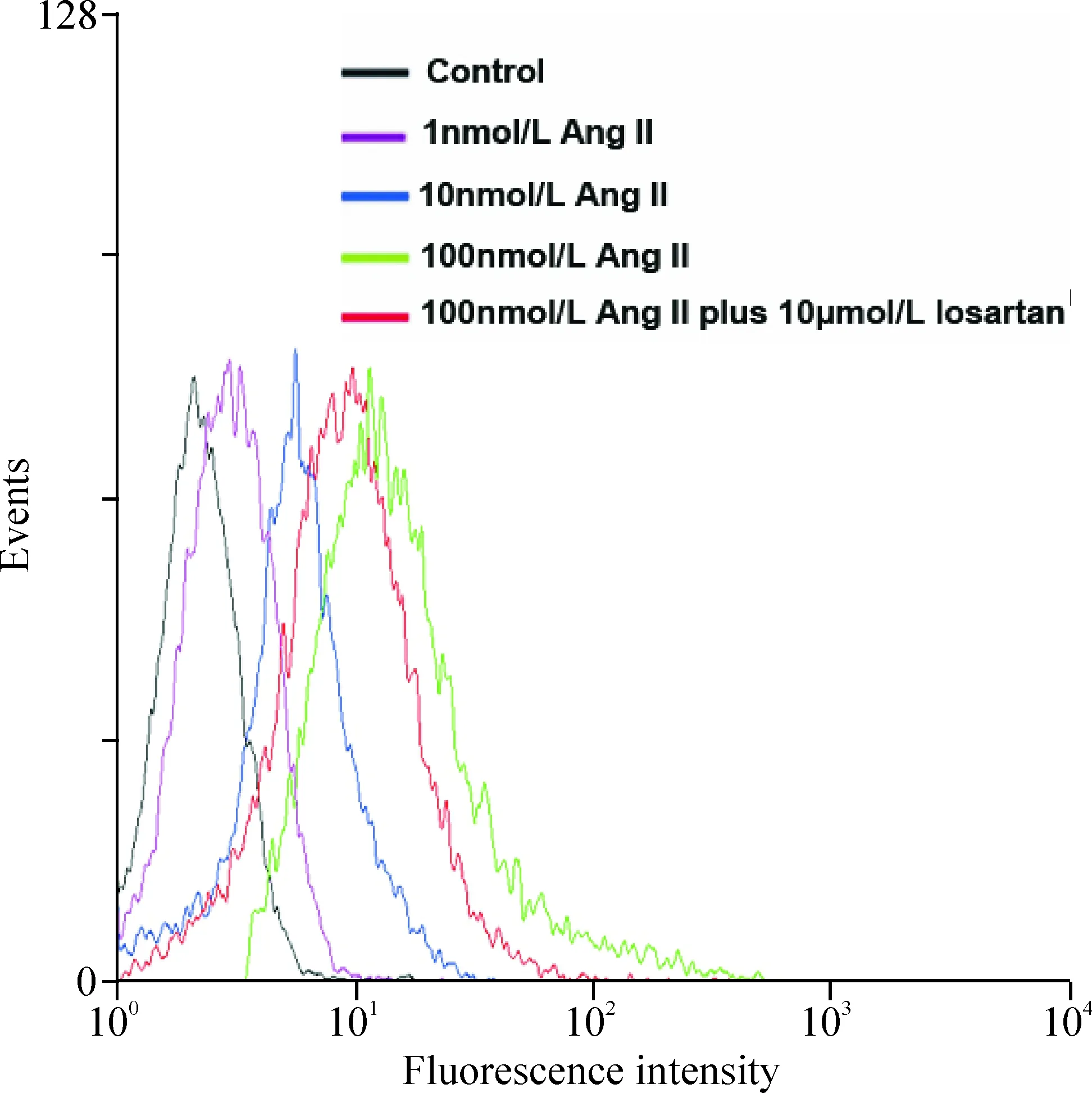
Figure 2. Effects of Ang II and losartan on the uptake of DiI-Ox-LDL by DCs.
3 AngⅡ和洛沙坦对DCs清道夫受体mRNA表达的影响
Ang II干预可呈浓度依赖性上调LOX-1的表达,但对SR-A和CD36的表达无明显影响,见图3。与100 nmol/L Ang II干预相比,10 μmol/L洛沙坦预处理可明显抑制LOX-1的表达,但对SR-A和CD36的表达无明显影响,见图3。
讨 论
1 Ang II参与动脉粥样硬化发生发展的新机制
目前已有大量研究表明RAS参与了动脉粥样硬化的发生发展过程,动物实验也发现血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor, ACEI)及ARB类药物有抗动脉粥样硬化的作用[4]。Ang II是RAS激活后产生的主要血管活性物质,主要通过其2种受体,即1型受体(angiotensin II type 1 receptor, AT1)和2型受体(angiotensin II type 2 receptor, AT2),发挥其生物学效应。目前已知的大部分Ang II的作用,包括血管收缩、醛固酮释放、心肌和血管壁细胞的生长和增殖等促动脉粥样硬化的绝大部分作用,都是通过与AT1受体结合而实现的[2]。近来的研究发现Ang II除可引起血管收缩,导致高血压,继发性引起动脉粥样硬化以外,还具有致炎症作用,可引起内皮细胞产生黏附分子和趋化因子升高,促进单核/巨噬细胞浸润,能刺激平滑肌细胞产生IL-6等细胞因子[5],从而提出了Ang II致炎症作用参与动脉粥样硬化发病机制的新观点。
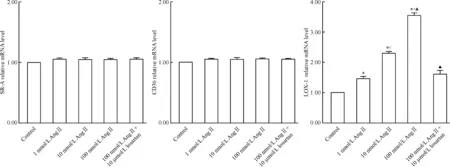
Figure 3. Effects of Ang II and losartan on the mRNA expression of SR-A, CD36 and LOX-1 analyzed by real-time PCR.Mean±SD.n=3.*P<0.05 vs control;#P<0.05 vs 1 nmol/L Ang II;△P<0.05 vs 10 nmol/L Ang II;▲P<0.05 vs 100 nmol/L Ang II.
近年来的研究已证实在免疫过程中起重要抗原递呈作用及免疫调节作用的DCs参与了动脉粥样硬化的发生和发展[3]。多种致动脉粥样硬化的危险因素,如Ox-LDL、尼古丁和晚期糖基化终产物(advanced glycosylation end products,AGEs)等都可通过促使DCs免疫功能成熟,参与并放大动脉粥样硬化炎症免疫反应[6-7]。其中DCs的成熟是其发挥免疫作用的关键。成熟DCs表达高水平的HLA-DR、CD80、CD83和CD86,还可通过分泌细胞因子,如IL-12、IFN-γ和IL-10等调节T辅助细胞的分化,从而调节细胞免疫和体液免疫的发生。本研究发现Ang II可浓度依赖性活化DCs,促进其免疫成熟,表现在其细胞表面成熟标志(HLA-DR和CD83)的表达增加,分泌多种细胞因子增加,从而使其介导的免疫反应增强,这可能是Ang II致炎症促动脉粥样硬化的一种新机制。而这些作用可被ARB类药物洛沙坦所抑制,提示AT1的激活是Ang II发挥作用的主要受体。
2 Ang II与Ox-LDL在动脉粥样硬化发生发展中的新联系
我们既往的研究发现在动脉粥样硬化发生发展中起核心作用的危险因素——Ox-LDL除了可以促进DCs的活化和免疫成熟外,DCs还可吞噬Ox-LDL形成泡沫细胞,可能是除单核-巨噬细胞和平滑肌细胞以外泡沫细胞的一个新来源[6]。而本研究发现Ang II可促进DCs对Ox-LDL的摄取,从而可能促进泡沫细胞的形成,这也是Ang II促动脉粥样硬化的另一新机制,并且提供了Ang II与Ox-LDL这2种危险因素在动脉粥样硬化发生中相互促进、存在密切联系的新证据。
由于DCs摄取Ox-LDL依赖其与细胞表面的清道夫受体结合,因此为进一步探讨Ang II促进DCs摄取Ox-LDL的机制,我们检测了DCs表面清道夫受体(scavenger receptor,SR)的表达。传统的SR包括SR-A、CD36、CD68和SR-EC等,它们主要表达于巨噬细胞和平滑肌细胞表面,是这些细胞摄取Ox-LDL的主要受体,参与泡沫细胞的形成。近年来一种新型的Ox-LDL的特异性受体——LOX-1越来越受到人们的重视。其结构不同于传统的SR,表达于参与动脉粥样硬化的多种细胞表面(如内皮细胞、平滑肌细胞和巨噬细胞),是内皮细胞摄取Ox-LDL的主要受体[8]。最近的研究发现在DCs表面存在多种清道夫受体的表达,其中LOX-1参与了抗原和脂质提呈的过程[9-10]。本研究发现Ang II可上调DCs表面LOX-1的表达,且可被洛沙坦阻断,但Ang II和洛沙坦对SR-A和CD36的表达无影响。这提示LOX-1,而不是传统的清道夫受体SR-A和CD36,可能在Ang II促进DCs摄取Ox-LDL中起重要作用。Ang II可通过活化AT1受体,上调LOX-1的表达,促进DCs对Ox-LDL的摄取,这可能是Ang II除直接促进DCs的免疫成熟以外,通过DCs发挥促动脉粥样硬化作用的另一新机制,也是提供RAS活化与血脂异常之间联系的新证据。
综上所述,Ang II是DCs免疫成熟的重要刺激因素,并且可能通过上调LOX-1的表达,促进DCs对Ox-LDL的摄取,这可能是Ang II促动脉粥样硬化的新机制。
[参 考 文 献]
[1] Huang D, Lu H, Liu H, et al. Losartan attenuates human monocyte-derived dendritic cells immune maturation via downregulation of lectin-like oxidized low density lipoprotein receptor-1[J]. J Cardiovasc Pharmacol, 2012, 60(2):133-139.
[2] Luft FC, Dechend R, Müller DN. Immune mechanisms in angiotensin II-induced target-organ damage[J]. Ann Med, 2012, 44(S1):S49-S54.
[3] Bobryshev YV. Dendritic cells and their role in atherogenesis[J]. Lab Invest, 2010, 90(7): 970-984.
[4] Takai S, Jin D, Sakaguchi M, et al.The regressive effect of an angiotensin II receptor blocker on formed fatty streaks in monkeys fed a high-cholesterol diet[J]. J Hypertens, 2005, 23(10):1879-1886.
[5] Schieffer B, Schieffer E, Hilfiker-Kleiner D, et al. Expression of angiotensin II and interleukin 6 in human coronary atherosclerotic plaques: potential implications for inflammation and plaque instability[J]. Circulation, 2000, 101(12):1372-1378.
[6] 梁 春, 罗育坤, 黄 东, 等. 氧化修饰低密度脂蛋白可诱导人单核细胞源树突状细胞形成泡沫细胞[J]. 中国病理生理杂志, 2006, 22(10):1931-1934.
[7] Ge J, Jia Q, Liang C, et al. Advanced glycosylation end products might promote atherosclerosis through inducing the immune maturation of dendritic cells[J]. Arterioscler Thromb Vasc Biol, 2005, 25(10): 2157-2165.
[8] Sawamura T, Kakino A, Fujita Y. LOX-1: a multiligand receptor at the crossroads of response to danger signals[J]. Curr Opin Lipidol, 2012, 23(5):439-445.
[9] Delneste Y, Magistrelli G, Gauchat J, et al. Involvement of LOX-1 in dendritic cell-mediated antigen cross-presentation[J]. Immunity, 2002, 17(3): 353-362.
[10] Nakano A, Inoue N, Sato Y, et al. LOX-1 mediates vascular lipid retention under hypertensive state[J]. J Hypertens, 2010, 28(6):1273-1280.

