小鼠胚胎干细胞钙敏感受体的表达和其对细胞增殖的影响*
孙 健, 于金凤, 栾海荣, 李 爽, 许晓义, 何志鹏, 魏 韬, 李 丽, 徐长庆
(1牡丹江医学院,黑龙江,牡丹江 157011; 2哈尔滨医科大学病理生理教研室,黑龙江 哈尔滨 150081)
钙是人体内最重要的元素之一,在生理状态下,Ca2+通过钙通道、交换体和泵等引起细胞内游离钙浓度([Ca2+]i)的变化而发挥作用,因此将Ca2+称为“第二信使”。 随着钙敏感受体(calcium-sensing receptor, CaSR)的克隆,人们逐渐发现细胞外Ca2+可以通过 CaSR发挥第一信使的作用[1]。CaSR是G蛋白偶联受体超家族中C家族的一名成员,由Brown 等[2]于1993年首先在牛甲状旁腺主细胞中成功克隆,在调节钙稳态中发挥决定性的作用,并参与调节细胞生长、分化、凋亡、基因表达、离子通道激活、激素分泌等。
胚胎干细胞(embryonic stem cells, ESCs)是由着床前囊胚期内细胞团(inner cell mass, ICM)早期胚胎分离出来的全能干细胞,在体外可长期保持未分化状态并无限增殖,且保持分化为全身各种细胞和组织的潜能[3]。ESCs是1981年由Evans等[4]首次从延迟植入小鼠囊胚中分离出来的多能性细胞,从此以后便引起各国学者的关注,是研究ESCs功能和调控的常用工具。目前关于CaSR在ESCs中的表达,对ESCs内钙和细胞的增殖是否有影响,国内外尚未见报道。因此,本文以小鼠ESCs (mouse ESCs,mESCs)为观察对象,对上述尚未解决的问题开展如下的研究。
材 料 和 方 法
1 材料
129小鼠ES-D3细胞株(CRL-11632)购于美国菌种保藏中心;胎牛血清购自Gibco;小鼠白血病抑制因子(leukemia inhibitory factor, LIF)购自Chemicon;CaSR购自Alomone Labs; NPS2390、NiCl2、CdCl2、U73122、U73343、毒胡萝卜素(thapsigargin,TG)和caffeine购自Sigma;Cycle TEST试剂盒(BDIS);Fluo-3/AM购自Invitrogen;FITC荧光标记Ⅱ抗购自Sigma-Aldrich。
2 方法
2.1小鼠胚胎干细胞的培养 mESCs培养于DMEM培养液中,添加1%青-链霉素、1.7 mmol/L L-谷氨酰胺、0.1 mmol/L β-巯基乙醇、1%非必需氨基酸和LIF(1×106U/L)、15%胎牛血清。细胞滴入在直径35 mm或60 mm的培养皿,放入37 ℃、5% CO2的培养箱中培养,1~3 d换液,磷酸盐缓冲液(PBS)洗2次后,继续无血清培养液培养24 h后用于后续实验。
2.2免疫荧光分析 mESCs用预冷0.1 mol/L PBS冲洗,4%多聚甲醛固定30 min,1%山羊血清封闭30 min;分别用抗CaSR(1∶100)孵育,4 ℃过夜,阴性对照用0.1 mol/L PBS代替Ⅰ抗;0.1 mol/L PBS冲洗3次;FITC标记的IgG (1∶50)37 ℃孵育1 h;PBS冲洗3次,核用DAPI复染。立即在荧光显微镜(Leica)下观察并照相。
2.3免疫印迹分析CaSR的表达 mESCs随机分为正常对照组,实验组分别用0.4 mmol/L 新霉素和10 μmol/L NPS2390作用24 h。RIPA缓冲液冰上裂解30 mim后,4 ℃离心(12 000 r/mim)15 mim,提取细胞总蛋白。取20 μg蛋白上样,10%SDS-PAGE电泳,300 mA转移2 h至硝酸纤维素膜,封闭液中封闭1 h。Ⅰ抗分别为anti-CaSR (1∶1 000)和anti-GAPDH (1∶500),4 ℃过夜。同时,以CaSR抗原-抗体复合物代替Ⅰ抗,作为阴性对照。洗膜后,碱性磷酸酶标记的抗 IgG抗体(1∶1 000)孵育1 h。显色液(Promega) 显色, 吸光度扫描半定量分析显影条带。
2.4[Ca2+]i的测量 各组细胞弃培养液,用 [140 mmol/L NaCl,5 mmol/L KCl,1.8 mmol/L CaCl2,0.5 mmol/L MgCl2,10 mmol/L glucose,5.5 mmol/L HEPES(pH 7.4)[5]] 洗涤3次。Fluo-3/AM (5 μmol/L) 37 ℃恒温箱中避光孵育40 min,去除负载液,含钙Krebs溶液洗涤3次后,保存于含钙Krebs溶液中备用。在镜下选取细胞状态好,质膜完整,无颗粒的细胞进行实验。激发波长为488 nm。
2.5流式细胞术检测细胞增殖周期 分别取各组培养的mESCs,经0.25%胰蛋白酶-0.02 EDTA消化后,PBS洗涤2次,调整细胞密度为1×109/L,制成单细胞悬液,2 000 r/min离心 5 min,PBS洗涤1次,2 000 r/min离心 5 min,加3 mL预冷的乙醇固定,4 ℃过夜,200 r/min离心 5 min,加入缓冲液3 mL洗涤1次,2 000 r/min离心 5 min,加A液250 μL,室温作用10 min,加B液200 μL,室温作用10 min,加预冷的C液200 μL,室温避光10 min,上机检测。
2.6MTT比色法分析细胞存活率的变化 96孔板中培养的细胞进行相应处理后(每组重复12孔),每孔加入MTT溶液20 μL(5 g/L), 37 ℃继续孵育 4 h, 弃上清,每孔加入100 μL二甲基亚砜 (DMSO),振荡10 min 使结晶物完全溶解。选择490 nm波长,自动酶联仪检测各孔吸光度A值 (A490),反复3次取平均值。每孔A值减去空白孔A值为测试孔A真值,活细胞数与A490成正比。
3 统计学处理
数据用均数±标准差(mean±SD)表示。用SPSS 13.0软件进行单因素方差分析。各组间比较采用单因素方差分析和LSD-t检验。以P<0.05为差异有统计学意义。
根据矿体围岩及铁矿中的硫同位素δ34S值均介于-9.7~+2.2之间[11],具未分异的陨石流的特点,说明这些物质都来看自地幔。
结 果
1 mESCs的形态特征
倒置显微镜下观察,mESCs在条索状小鼠胚胎成纤维细胞饲养层(feeder layer,FL)上的形态特征为细胞圆形或椭圆形,呈集落生长,边缘清晰、光滑,其所形成的生长集落和饲养层有明显的界限,见图1A。在脱离饲养层,生长在明胶上时,mESCs首先由集落样生长逐渐过渡到单层生长,见图1B。mESCs增殖旺盛,一般2~3 d传代。

Figure 1. Morphology of the mouse embryonic stem cells (×200). A: embryonic stem cells on feeder layer (↑); B: embryonic stem cells on gelatin (↑).
2 CaSR在mESCs的表达
2.1免疫荧光检测CaSR在mESCs的表达 在mESCs的细胞膜和细胞质中可见特异性绿色荧光,见图2B,DAPI将核染为蓝色;无CaSR 抗体组仅见核蓝染,见图2A。这说明CaSR在mESCs的胞膜与胞浆均有表达。

Figure 2. Detection of CaSR expression in mESCs by immuno-fluorescence with FITC-conjugated IgG in the absence (A) or presence (B) of the primary antibody against CaSR (×200).
2.2Western blotting检测CaSR在mESCs的表达 结果显示,在160 kD检测出特异性蛋白条带,阴性对照组未见任何条带出现;给予0.4 mmol/L neomycin(钙敏感受体激动剂)后CaSR蛋白表达明显增多(与对照组相比,P<0.05);用0.01 mmol/L NPS2390(CaSR 抑制剂)处理后这种效应被抑制(与激动剂组比较,P<0.05),见图3。
3 不同处理因素对mESCs[Ca2+]i变化的影响
3.1Neomycin、NPS2390、CdCl2和NiCl2对mESCs内钙浓度的影响 1.8~5.8 mmol/L的细胞外钙可以引起细胞内钙的增加(我们选用5.8 mmol/L的CaCl2进行后续的实验)。0.1~0.4mmol/Lneomycin可呈浓度依赖性地引起细胞内钙的增加,0.4 mmol/L时达到平台期,细胞内钙浓度不再增加(我们选用0.4 mmol/L的neomycin进行后续的实验)。NiCl2(0.5 mmol/L)和L-型钙通道阻断剂CdCl2(0.01 mmol/L)预先孵育0.5 h可以明显抑制CaCl2引起的细胞内钙的增加,应用0.5 mmol/L NiCl2、0.01 mmol/L CdCl2和0.01 mmol/L NPS2390预先孵育0.5 h可以完全消除CaCl2引起的细胞内钙增加,见图4、5。同时,0.01 mmol/L NPS2390预先孵育0.5 h可以完全消除neomycin引起的细胞内钙的增加。
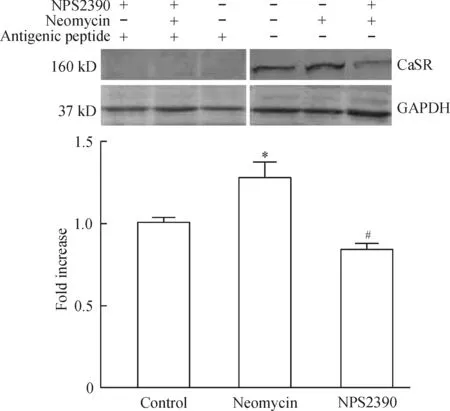
Figure 3. The effects of neomycin and NPS2390 on CaSR expression in mESCs.Mean±SD.n=4. *P< 0.05 vs control group; #P<0.05 vs neomycin group.

Figure 4. Effects of different concentrations of CaCl2 (A) or neomycin (B) on [Ca2+]i in mESCs.Mean±SD.n=6.
3.2细胞外钙或neomycin诱导细胞内钙增加的信号转导通路 TG(内质网钙库的阻断剂,10 μmol/L)、U73122(PLC的阻断剂,10 μmol/L)、咖啡因(肌浆网钙库耗竭剂,10 μmol/L)或者2-APB(IP3的阻断剂,10 μmol/L)预处理后都可以减弱甚至消除5.8 mmol/L CaCl2或0.4 mmol/L neomycin所引起的细胞内钙的增加 (与control比较,P>0.05),而U73343(U73122无活性的同型体,10 μmol/L)预处理后对这种细胞内钙的增加没有影响,见图5。这些结果提示,CaSR的活化引起细胞内钙增加是通过G蛋白-PLC-IP3信号转导通路实现的。

Figure 5. The effects of different agents on the increase in [Ca2+]i induced by extracellular Ca2+ or neomycin in mESCs. A: the cells in the experimental groups were pretreated with NiCl2 and CdCl2 in the absence or presence of NPS2390, U73122, U73343, caffeine, 2-aminoethyldiphenyl broate (2-APB) or thapsigargin (TG) for 30 min, then exposed consecutively to CaCl2; B: the cells in experimental groups were exposed to neomycin with or without pre-treatment with NPS2390, U73122, U73343, coffeine, 2-APB or TG for 30 min.
4 CaSR活化对胚胎干细胞增殖的影响
4.1MTT分析胚胎干细胞的存活率 我们首先观察了不同浓度新霉素对mESCs细胞增殖的影响,结果显示,0.4 mmol/L 新霉素对细胞的增殖影响最为显著,见图6,因此后续实验采用0.4 mmol/L 新霉素。以正常对照组细胞的存活率为 100% 计算,新霉素组存活率为149%±7%,明显高于正常组(P<0.05);新霉素+NPS2390 组mESCs存活率为97%±9%,明显低于新霉素组(P<0.05);ERK的特异性抑制剂PD98059的增殖率为109%±8%(和对照组比,P>0.05),见图7。

Figure 6. The effects of different concentrations of neomycin on proliferation of mESCs.Mean±SD.n=6. *P<0.05,**P<0.01 vs control group.

Figure 7. Cell viability determined by MTT assay in mESCs.Mean±SD.n=6.*P<0.05 vs control group; ##P<0.01 vs neomycin group.
4.2细胞周期分析检测胚胎干细胞的增殖指数 流式细胞术测定结果显示(图8),新霉素组与正常对照组相比,G0/G1期细胞比例显著降低,S和G2/M期细胞比例均显著增加。细胞增殖指数 (proliferation index,PI)=(S+G2/M)/ (S+G2/M+G0/G1) ,结果显示,新霉素能显著增加细胞S期比例和PI,约为正常对照组的1.16倍(P<0.05);而新霉素+NPS2390可抑制胚胎干细胞增殖,PI回落至约为1;PD98059的作用和NPS2390类似。

Figure 8. Detection of proliferation index by analysis of cell cycle.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs neomycin group.
4.3Western blotting检测各组mESCs中CaSR和p-ERK2/t-ERK的蛋白水平 mESCs表达p-ERK2蛋白,其分子量为44 kD。与正常组相比,新霉素组细胞CaSR(图9)和p-ERK2蛋白(图10)表达增加(P<0.05);与激动剂组相比,NPS2390(CaSR抑制剂)组CaSR和p-ERK2蛋白表达均减少(P<0.05);ERK 的特异性抑制剂PD98059对CaSR蛋白表达增加则没有显著影响(和对照组相比,P>0.05),p-ERK2蛋白表达与对照组相比有所减少,但不明显(P>0.05)。
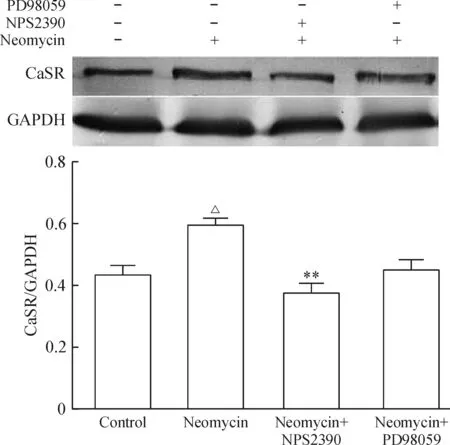
Figure 9. Protein expression of CaSR in the mESCs with different treatments determined by Western blotting.Mean±SD.n=4. △P<0.05 vs control group;**P<0.01 vs neomycin group.
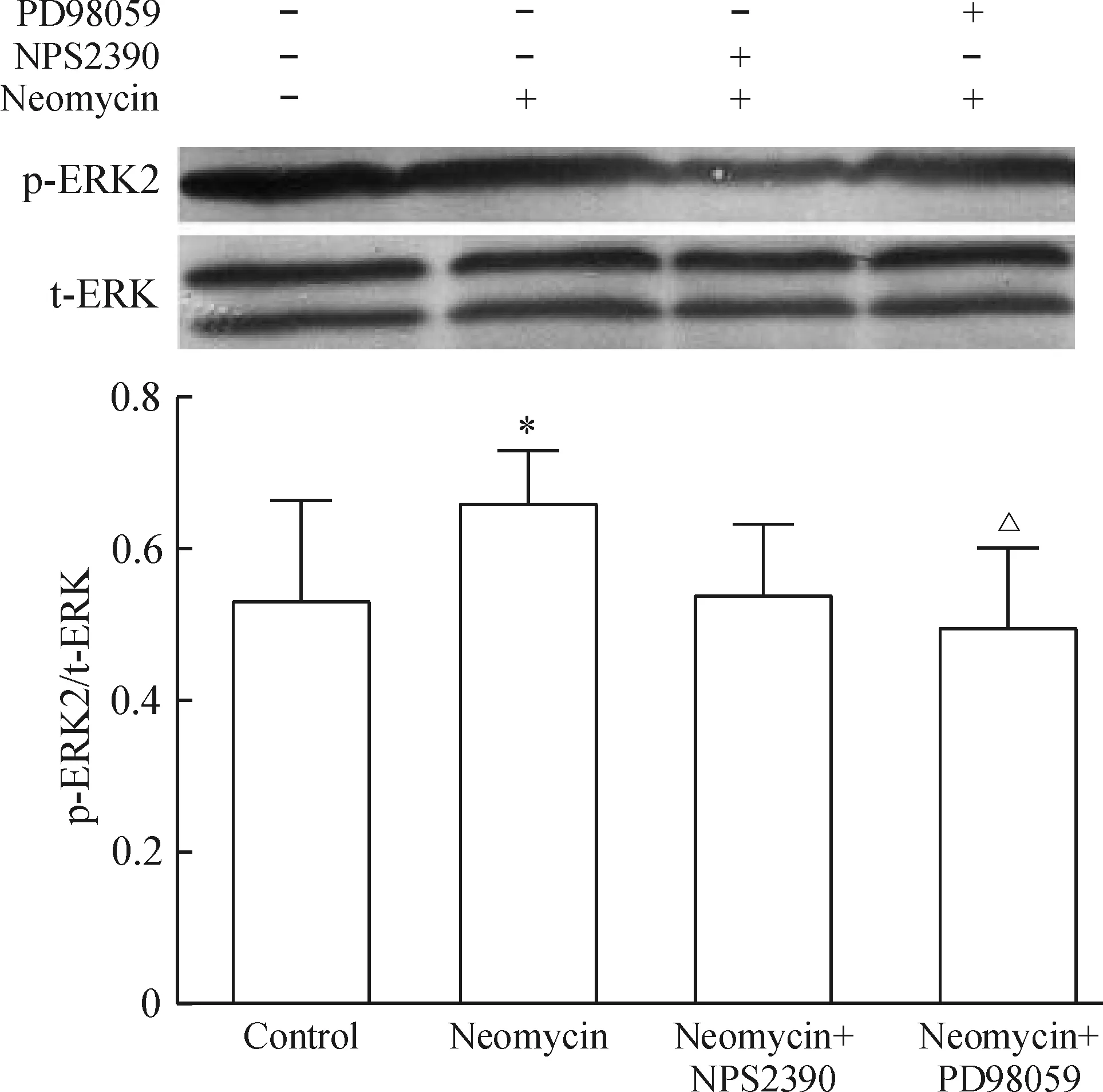
Figure 10. The protein expression of p-ERK2 in the mESCs with different treatments determined by Western blotting. Mean±SD.n=4.*P<0.05 vs control group;△P<0.05 vs neomycin group.
讨 论
最近研究表明CaSR在某些干细胞也有表达,Lam等[6]发现在体外CaSR激活能增强原始造血干细胞的增殖、迁移,促进归巢。Xu等[7]发现CaSR活化促进大鼠骨髓基质干细胞的增殖作用是由于增加增殖指数,减少细胞凋亡,且能够增加p-ERK1/2的蛋白表达。CaSR与mESCs增殖的关系至今国内外尚未见报道。
我们在mESCs的蛋白免疫印记实验中, 用抗CaSR的特异性抗体检测出分子量为160 kD的条带, 而阴性对照组未出现任何条带。这与Xu等[7]在大鼠骨髓间充质干细胞的发现一致,实验中还发现CaSR的激动剂新霉素可以使CaSR蛋白的表达明显增加,而且这种增加可以被CaSR抑制剂NPS2390所取消,并具有统计学意义。
免疫荧光结果显示,CaSR蛋白存在于小鼠胚胎干细胞内,主要定位于细胞膜和细胞浆,该结果与在其它类型细胞中CaSR定位的报道一致[8-9]。基于上述实验结果,我们认为在小鼠胚胎干细胞有CaSR蛋白的表达。
CaSR如同应答多种细胞刺激的整合器,对[Ca2+]o微小波动及其它阳离子均可发生反应[9]。Ca2+、Gd3+、Mg2+、新霉素和精胺等都是CaSR的激动剂。为了证实[Ca2+]o增加引起[Ca2+]i的增加是否与CaSR的激活有关,我们测定了mESCs中[Ca2+]i的变化,发现4 mmol/L CaCl2和0.4 mmol/L新霉素(CaSR激动剂)都可以引起[Ca2+]i升高。NiCl2(Na+-Ca2+交换抑制剂)和CdCl2(L-型钙通道阻滞剂)预处理后,[Ca2+]i的荧光强度降低,但仍比对照组高。而NiCl2+CdCl2+NPS2390(CaSR抑制剂)同时存在时,[Ca2+]i的荧光强度明显降低,与对照组无显著差异。这些结果提示,CaSR和L型钙通道及Na+-Ca2+交换蛋白一起,共同参与了[Ca2+]o增加导致mESCs [Ca2+]i增加这一过程。
在ESCs存在2个功能不同的钙离子释放通道,即1,4,5 -三磷酸肌醇受体(IP3R)和ryanodine受体(RyR)已经确定。咖啡因(coffeine)是细胞内钙库耗竭剂(可促进RyR受体开放),而TG是肌质网Ca2+-ATP酶的阻断剂。本研究发现,用TG和coffeine预处理30 mim,能显著抑制4 mmol/L CaCl2和0.4 mmol/L新霉素诱导的[Ca2+]i的升高。这表明CaSR激活诱导的[Ca2+]i增加主要源于细胞内钙库释放Ca2+。
Wang等[10]证实,[Ca2+]o增加、Gd3+及精胺引起大鼠心肌细胞[Ca2+]i增加是通过G-PLC-IP3信号转导通路。本实验中发现:U73122(PLC抑制剂)和2-APB(IP3R抑制剂)均可以显著地减弱Ca2+及新霉素诱导的[Ca2+]i增加,而U73122的失活类似物U73343则无显著作用。这些结果提示,在mESCs由CaSR活化诱导的[Ca2+]i增加也可通过G蛋白-PLC-IP3信号转导通路实现的。
CaSR可以调节很多细胞内信号途径,包括磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、MAPK信号通路等,参与细胞增殖、凋亡和分化。MAPK途径包括p38、JNK和ERK,调控多种细胞功能,特别是在细胞的增殖、分化和凋亡中起着关键的作用,其中ERK参与了MAPK超家族中对细胞生长和凋亡的调控[11]。本实验通过MTT法和流式细胞术2种方法观察了CaSR的活化对细胞增殖的影响。结果发现,钙敏感受体激动剂新霉素使细胞存活率增加,而NPS2390减弱这种作用。ERK的特异性抑制剂PD98059对细胞的更新并没有太大的影响。我们通过Western blotting检测mESCs中CaSR和p-ERK2蛋白的表达,新霉素处理后二者表达皆增加,NPS2390则可减弱这种作用,PD98059组和正常对照组相比,对p-ERK2蛋白的表达没有明显影响,这可能还与上游信号通路的调节有关。这些结果提示CaSR激活对mESCs的增殖具有一定的促进作用,这与其它研究结果类似[7, 11-13],但具体信号通路有待进一步的研究。
总之,我们的研究首次证明了CaSR在mESCs存在表达。CaSR活化引起细胞内钙增加是通过G-PLC-IP3信号转导通路实现的;CaSR活化能够促进mESCs的增殖,具体作用机制和信号途径有待于进一步研究。
[参 考 文 献]
[1] Smajilovic S, Tfelt-Hansen J. Calcium acts as a first messenger through the calcium-sensing receptor in the cardiovascular system[J]. Cardiovasc Res, 2007, 75 (3):457-467.
[2] Brown EM, Gamba G, Riccardi D, et al. Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid[J]. Nature, 1993, 366(6455): 575-580.
[3] Pera MF, Reubinoff B, Trounson A. Human embryonic stem cells[J]. J Cell Sci, 2000,113(Pt 1):5-10.
[4] Evans MJ, Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos[J]. Nature, 1981, 292(5819):154-160.
[5] Kim MH, Kim MO, Kim YH, et al. Linoleic acid induces mouse embryonic stem cell proliferation via Ca2+/PKC, PI3K/Akt, and MAPKs[J]. Cell Physiol Biochem, 2009, 23(1-3):53-64.
[6] Lam BS, Cunningham C, Adams GB. Pharmacologic modulation of the calcium-sensing receptor enhances hematopoietic stem cell lodgment in the adult bone marrow [J]. Blood, 2011, 117(4):1167-1175.
[7] Xu Z, Yan L, Ge Y, et al. Effect of calcium sensing receptor on the proliferation in rat bone marrow derived mesenchymal stem cells through ERK1/2 pathway[J]. Mol Biol Rep, 2012, 39(7):7271-7279.
[8] 李光伟,邢文婧,郝静辉,等.钙敏感受体在缺氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用[J]. 中国病理生理杂志, 2010,26(12):2433-2437.
[9] Breitwieser GE, Miedlich SU, Zhang ML. Calcium sen-sing receptors as integrators of multiple metabolic signals[J]. Cell Calcium, 2004, 35(3):209-216.
[10] Wang R, Xu CQ, Zhao WM, et al. Calcium and polyamine regulated calcium-sensing receptors in cardiac tissues[J]. Eur J Biochem, 2003, 270(12):2680-2688.
[11] Smajilovic S, Hansen JL, Christoffersen TE, et al. Extracellular calcium sensing in rat aortic vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2006, 348(4):1215-1223.
[12] Hoff AO, Cote GJ, Fritsche HA, et al. Calcium-induced activation of a mutant G-protein-coupled receptor causesinvitrotransformation of NIH/3T3 cells[J]. Neoplasia, 1999, 1(6):485-491.
[13] Molostvov G, Fletcher S, Bland R, et al. Extracellular calcium-sensing receptor mediated signaling is involved in human vascular smooth muscle cell proliferation and apoptosis[J]. Cell Physiol Biochem, 2008, 22(5-6):413-422.

