稀土金属元素标记行为考察
张爱红,林虹君,黄顺祥,周学志
(1. 中国人民解放军防化学院,北京 102205;2. 空军防化大队,北京 102206)
随着蛋白质组学研究的不断深入,其研究方向由定性表达谱向定量研究发展,而新的定量方法的研究是生物标志物发现、验证和确认的重要支撑。蛋白质组学定量方法包括基于标记和非标记结合生物质谱的方法,而基于非标记的质谱是半定量方法,限制了其在定量研究中的应用,因此研究工作仍然侧重于基于标记的质谱定量方法。蛋白质标记方法主要有化学标记和生物标记。化学标记包括:乙酰化标记、同位素标记[1]和ITRAQ标记[2-3]等;生物标记包括:SILAC标记[4]等。另外,酶促标记(如18O[5]标记)也是常用的标记方法,但其稳定性和标记的完全性还存在问题,因此寻求其它标记方法仍是定量研究的重要内容。
Meares研究组[6]在2004年以化学性质很相近的稀土金属元素为质量标签,提出了针对蛋白质巯基标记的新方法“元素标记亲和标签”(element-coded affinity tags, ECAT)。Liu等[7]在2006年将稀土金属通过双功能试剂与标准肽段结合,实现了基于质谱技术的蛋白质相对定量。可用于标记的金属很多,而且很多蛋白质本身就含有金属,如铁、铝等。由于有些金属在检测本底中容易产生干扰,且不易与蛋白质自身所带的金属区分开[8-15],所以,在作为标签使用时,一般采用稀土金属元素。稀土金属元素用于蛋白质标记具有以下优点:各金属元素的物理化学性质非常相近,可以组成多种组合;与同位素试剂相比,稀土金属价格便宜[16];稀土金属元素之间的分子质量相差较大,可以有效避免同位素质谱峰重叠;与无机质谱结合对蛋白质进行定量分析,具有检测灵敏度高、定量动态范围大等特点[17]。该方法的缺点是标记效率低,对于2种以上不同金属标记的可能性尚未研究。
本研究选用稀土金属铽(Tb)、钇(Y)[18]、铥(Tm)、钬(Ho)和镥(Lu)[19]作为质量标签,首先对标记条件进行优化,然后分别对标记效率、色谱行为、稳定性以及离子交换等指标进行考察。
1 实验部分
1.1 仪器与装置
4800 MALDI TOF/TOF Analyzer基质辅助激光解吸电离-飞行时间串联质谱仪:美国AB Sciex公司产品;SC100A Speedvac Plus MODULYOD-230真空离心干燥机:美国Thermo Savant公司产品;P230高效液相色谱仪:大连依利特分析仪器有限公司产品;Milli-Q纯水系统:美国Merck Millipore公司产品。
1.2 主要材料与试剂
二乙三胺五乙酸双酸酐(diethylenetriamine-N,N,N',N'',N'''-pentaacetic acid dianhydride,DTPA双酸酐),四氮杂环十二烷四乙酸(DOTA):日本Dojindo公司产品;三乙二胺碳酸盐(Triethylammonium bicarbonate, TEAB):美国Sigma公司产品;乙腈(HPLC级):美国J.T.Baker公司产品;乙酸、醋酸铵(分析纯):北京化工厂产品;TbCl3、YCl3、TmCl3、HoCl3、LuCl3(分析纯):由中国计量科学研究院提供。
1.3 样品溶液
TEAB:物质的量浓度0.05 mol/L,pH 7.0;醋酸铵:物质的量浓度0.1 mol/L,pH 6.0。
1.4 质谱分析条件
对样品分析时,取5 μL处理好的样本溶液与饱和基质溶液(将5 g/Lα-氰基-4-羟基肉桂酸(CHCA)溶于含0.1% 三氟乙酸(TFA)的50%乙腈中),按照体积比1∶9混合,取0.6 μL点靶,空气中挥发干燥,用基质辅助激光解析电离-飞行时间串联质谱仪分析。
数据采集条件:正离子反射模式;加速电压20 kV;质量扫描范围m/z700~1 600;4 000 series谱图采集软件,累计采集1 500~2 000次。
根据同一肽段与金属元素标记后和标记前质谱峰峰高的比值来评估反应进行的程度,从而确定标记反应的最佳条件。用标准多肽混合物进行质谱仪的外标校正。
2 结果与讨论
2.1 标记元素的选择
选择金属元素时,首先考虑单同位素金属作为标记元素,目的是降低样品质谱图的复杂程度,便于分子质量相差较小的质谱峰之间的比较,提高解图的准确率。稀土金属元素中有8种是单同位素,列于表1。按照两两配对,能够形成28种组合,质量差从1~86 u不等,按照差值不小于4 u的原则,共有25种有效组合。其次考虑金属元素的螯合常数要足够大。将金属元素和肽段连接起来的双功能试剂DTPA双酸酐与各金属的螯合常数列于表2,如此大的螯合常数可以确保金属质量标签的稳定性。再次,不同金属元素的螯合常数相差不宜过大。差值过大则意味着两者在同一体系时,容易发生金属离子的交换,因此所选元素的螯合常数相差以不超过1为宜。据此条件,选择89Y、159Tb、165Ho、169Tm、175Lu作为研究对象,对质量标签的稳定性、色谱和质谱等行为进行考察[20]。
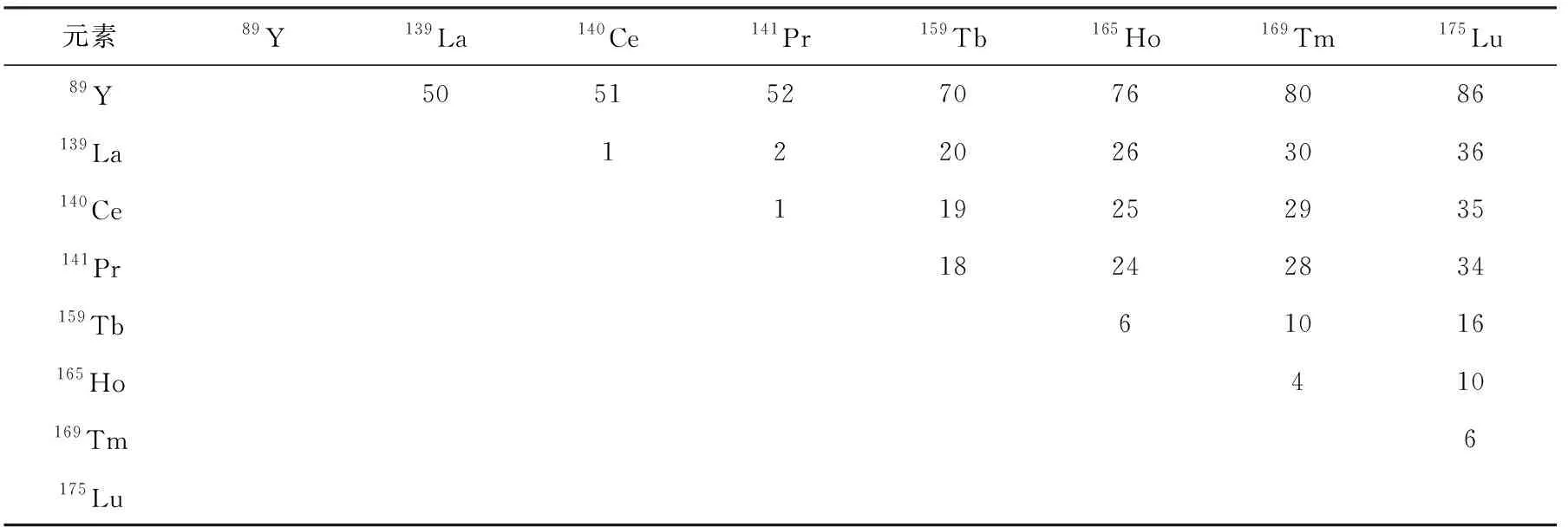
表1 稀土元素中的单同位素元素
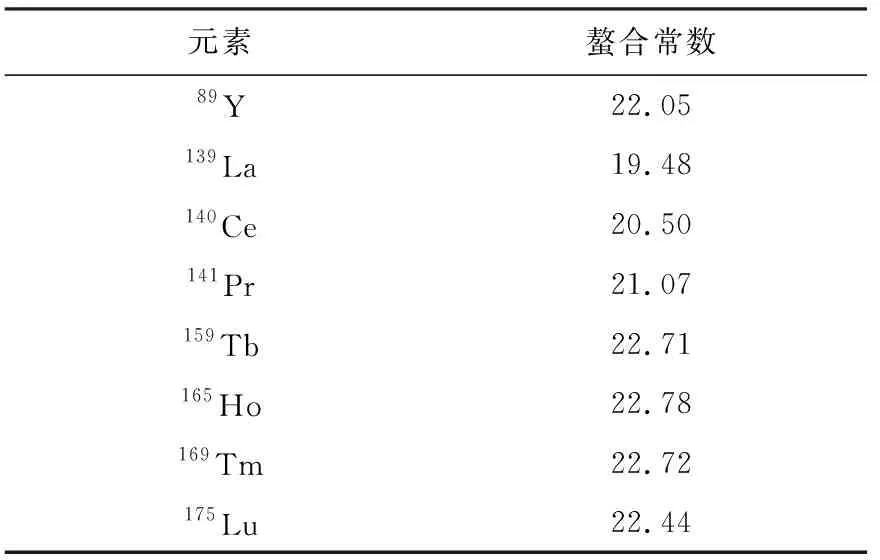
表2 8种单同位素元素与DTPA双酸酐的螯合常数
2.2 标记条件优化
稀土金属标记方法是经由双功能试剂将稀土金属元素与目标肽段连接起来,通过对该质量标签标记肽段定量测定达到对蛋白质定量检测的目的。由于双酸酐在水溶液中极易水解,所以标记时要严格遵循一定的反应顺序,且迅速完成。首先选用标准肽段Kemptide进行标记条件优化,具体步骤为:将0.14 mg标准肽段Kemptide和3.26 mg DTPA双酸酐固体加入到320 μL TEAB溶液中,剧烈涡振1 min,离心样品至管底,室温放置0.5 h,真空离心干燥;然后用醋酸铵缓冲液重新溶解冻干的样品,再加入金属元素,于37 ℃水浴2 h,为了提高金属元素的标记效率,加入金属离子的物质的量为DTPA双酸酐的5倍,将反应产物按体积比1∶9与基质混合,取0.6 μL点靶,进行MALDI-TOF MS分析。在肽段与DTPA双酸酐结合后的谱图中未出现标准肽段LRRASLG的质谱峰(m/z771.910 6),而出现较强的肽段与DTPA双酸酐结合后的质谱峰(m/z1 147.455 8),表明肽段与DTPA双酸酐结合效率达到了100%,示于图1。
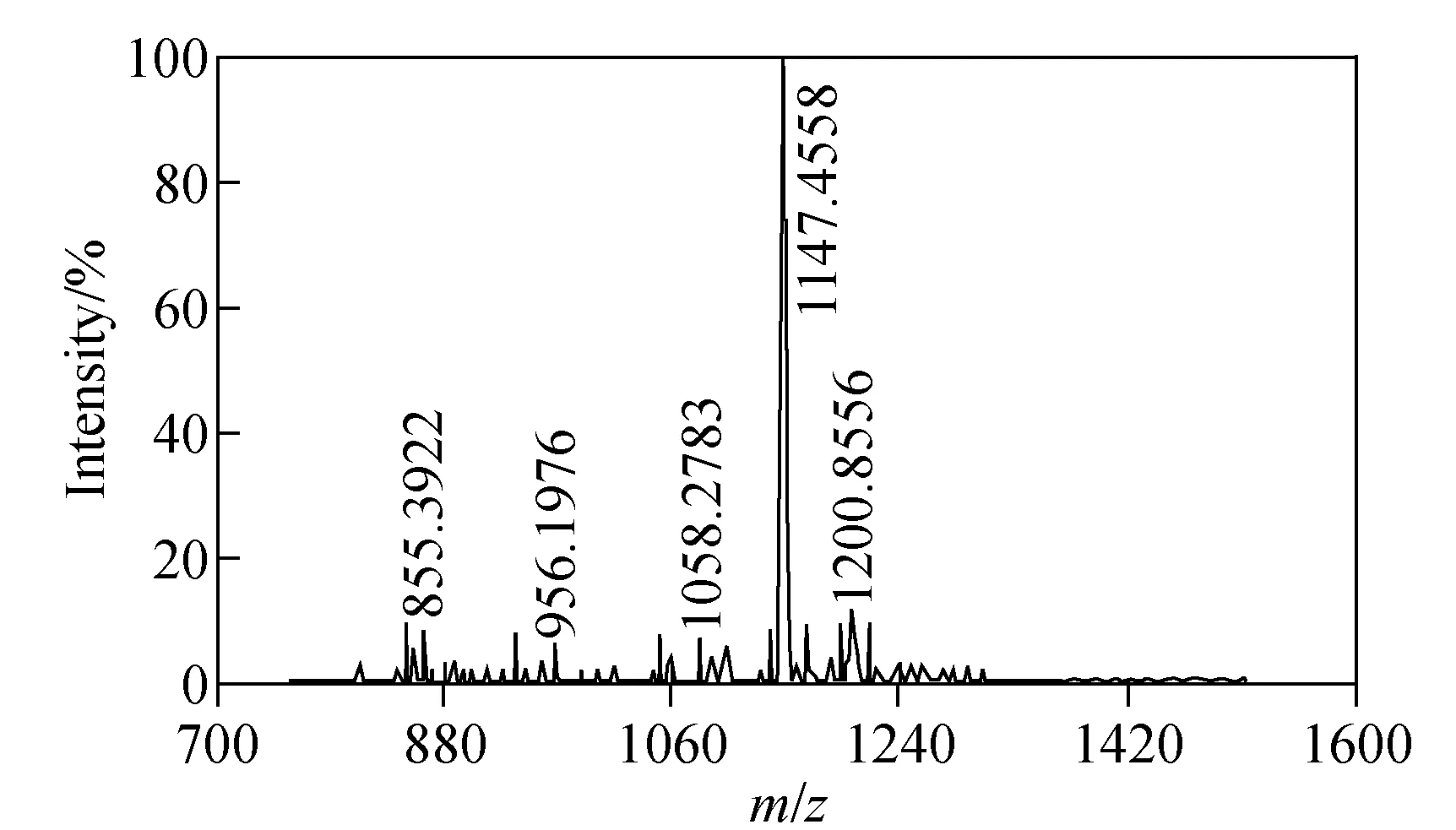
图1 标准肽段(LRRASLG)与DTPA双酸酐结合的质谱图Fig.1 The MS spectra of standard peptide (LRRASLG) combined with DTPA dianhydride
在此基础上,考察了双酸酐试剂与金属元素的标记效率。由于双酸酐试剂与金属元素的络和效率不仅与螯合常数有关,还与体系温度、反应时间、缓冲液pH和金属过量倍数有关,因此,为了得到最佳的螯合率,选择金属铥和钬对以上影响因素进行考察。通过对反应温度分别为25、37、60、80 ℃的情况进行考察,发现在37 ℃时的标记效率最高,达到71%,示于图2a;通过对pH 5.0、5.5、6.0、6.5、7.0、7.5的情况进行考察,发现在pH 6时的螯合率最高,达到76%,示于图2b;通过对反应时间0.5、1、2、3、5 h和过
夜的情况进行考察,发现在反应2 h时的螯合率最高,达到86%,示于图2c;通过对金属离子与DTPA双酸酐的物质的量比例为1倍、2倍、3倍、5倍、10倍的情况进行考察,发现在两者比例为5倍时的螯合率最高,达到90%,示于图2d。
从图2可以看出,优化后的最佳条件为:温度37 ℃、pH 6、反应时间2 h、金属离子浓度是肽段的5倍,此条件也同样适用于其它稀土金属元素。在此条件下得到的Y、Tb、Ho、Tm和Lu质谱图示于图3,其标记率列于表3。
图3表明,不同金属元素与同一肽段的结合率不同,其中Y和Tb的标记率较为相近,Ho和Tm的标记率较为相近,具体数据列于表3。接下来的实验,将Y和Tb,Ho和Tm分别作为一组用于双金属标签标记,只有Lu标记率较低,且杂峰较多,不宜与其它元素配对,因此,将主要对Y、Tb、Ho和Tm四种元素进行研究。
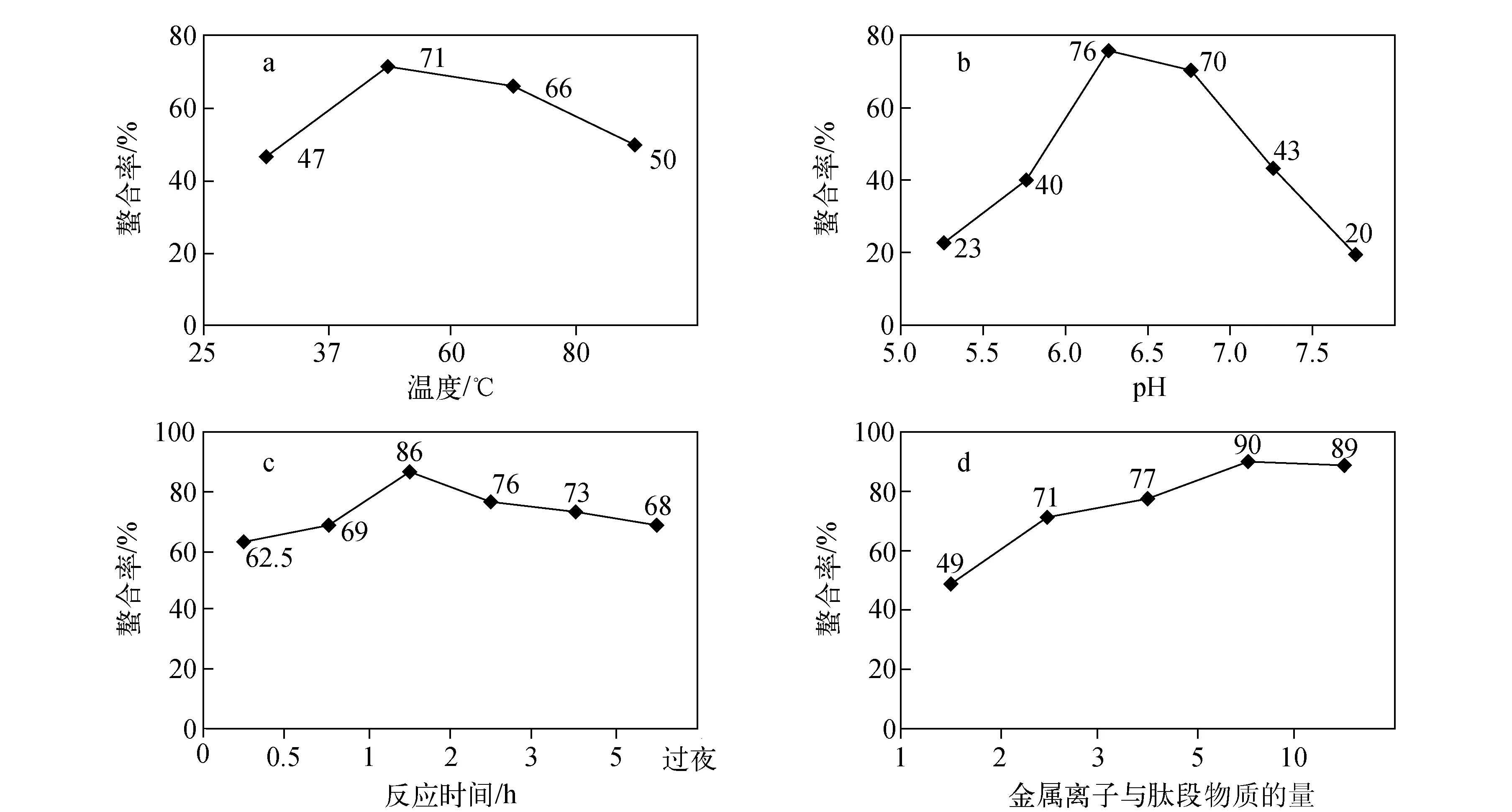
图2 反应温度(a)、pH值(b)、反应时间(c)和金属离子与DTPA双酸酐物质的量之比(d)对螯合效率的影响Fig.2 The effect of temperature (a), pH (b), time (c) and mole ratio of metal ion to DTPA dianhydride (d) on chelation rate
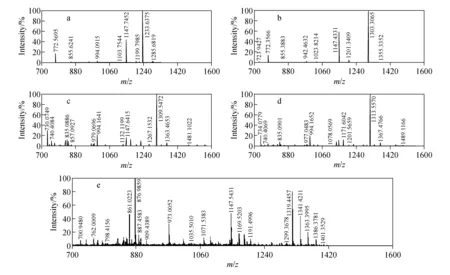
图3 标准肽段(LRRASLG)与稀土金属Y(a)、Tb(b)、Ho(c)、Tm(d)和Lu(e)标记的质谱图Fig.3 The MS spectra of standard peptide (LRRASLG) chelated with rare earth metal Y(a),Tb(b),Ho(c),Tm(d) and Lu(e)

金属元素名称LRRASLG-DTPA (m/z, 1+)LRRASLG-DTPA-M (m/z, 1+)标记率/%标准偏差/%Y1 147.745 21 233.637 575.66.7Tb1 147.433 11 303.306 572.85.6Ho1 147.641 51 309.547 289.94.9Tm1 147.561 81 313.557 092.57.3Lu1 147.543 11 319.445 768.96.8
各金属元素的标记反应式相同,以金属Y为例,标记反应式如下:
LRRASLG-DTPA+Y=LRRASLG-DTPA-Y
2.3 金属标记物的稳定性考察
金属标签的稳定性对其在实际样品中的应用至关重要,因此该质量标签要具备一定的稳定性。Tb和Y的稳定性已在Liu等[7]研究中考察,下面仅对Tm和Ho进行研究。将标记好的样品于4 ℃放置1周后进行质谱检测,仍有95%(峰强度)的标记产物被检测到。放置2周、3周、4周后再分别检测,发现质谱峰强度逐渐下降,金属离子标记的目标峰比例逐渐下降,肽段的质谱峰和第一步反应产物的质谱峰逐渐增强。Tm和Ho在4 ℃放置的质谱图示于图4。
从图4可以看出,将标记有金属的质量标签在4 ℃放置一段时间后,由于温度的降低,质量标签会有部分降解,且随着放置时间的进一步延长,尤其是超过2周,质量标签的分解逐渐增强,标签的峰强度逐渐降低,生成中间产物的峰强度逐渐增强。因此,若将标记好的标签用于定量研究,则放置时间不宜超过2周。
2.4 金属交换现象的考察
当质量标签含有两种或更多不同金属元素的标签时,除考虑各个络合物的稳定性外,还要考虑各金属元素之间的交换标记问题。由于不同金属元素与DTPA双酸酐的结合常数不完全相同,当该常数相差较大的两种金属络合物在同一体系时,螯合常数大的金属离子可能将螯合常数小的金属离子从其络合物中置换出来,影响标记。
为此,分别将金属钬的盐酸盐加入到标记好的铥-肽溶液中,将金属铥的盐酸盐加入到钬-肽溶液中,两者均放置24 h,Ho和Tm的交换结果表明,只有很少(小于3%)的金属发生了置换(标签m/z1 309.132 6置换m/z1 313.133 1,标签m/z1 313.132 7置换m/z1 309.131 1)。同样,将金属Y的盐酸盐加入到标记好的Tb-肽溶液中,将金属Tb的盐酸盐加入到Y-肽溶液中,置换24 h,Tb和Y的交换结果表明,只有很少(小于3%)的金属发生了置换(标签m/z1 233.432 6置换m/z1 303.417 5,标签m/z1 303.483 5置换m/z1 233.467 0)。金属交换实验的质谱图示于图5。
置换反应式如下:
LRRASLG-DTPA-Tm+Ho=
LRRASLG-DTPA-Ho+Tm
LRRASLG-DTPA-Ho+Tm=
LRRASLG-DTPA-Tm+Ho
LRRASLG-DTPA-Tb+Y=LRRASLG-DTPA-Y+Tb
LRRASLG-DTPA-Y+Tb=LRRASLG-DTPA-Tb+Y
以上结果表明,结合常数是选择金属元素的一个重要指标,既要保证该常数足够大(有足够稳定性),又要保证金属元素相互之间相差不能太大(避免交换标记)。
2.5 金属标记物的色谱行为考察
Liu等[7]已对Y和Tb的共洗脱进行过考察,发现两种金属对同一肽段标记的质量标签是共洗脱。本研究考察了金属Tb、Ho、Tm、Lu与肌红蛋白(myoglobin, MYO)酶切肽段的洗脱行为,首先对肌红蛋白酶切肽段进行标记,然后将标记有不同稀土金属的肽段1、2、3、4经LC/MS分析,质谱图示于图6。
图6表明,标记有金属Tb、Ho、Tm和Lu的同一肽段为共洗脱,除Lu的洗脱时间为22.14 min外,其余均为21.90 min,这再次说明,稀土元素Lu不适合与其他元素配对用于标记。实验结果表明,基于稀土元素标记可以用于蛋白质组的定量分析,将标记有不同稀土金属离子的肽段混合物通过LC/MS分析鉴定,标记有不同稀土金属离子的同一肽段在液相分离中能够被共洗脱。
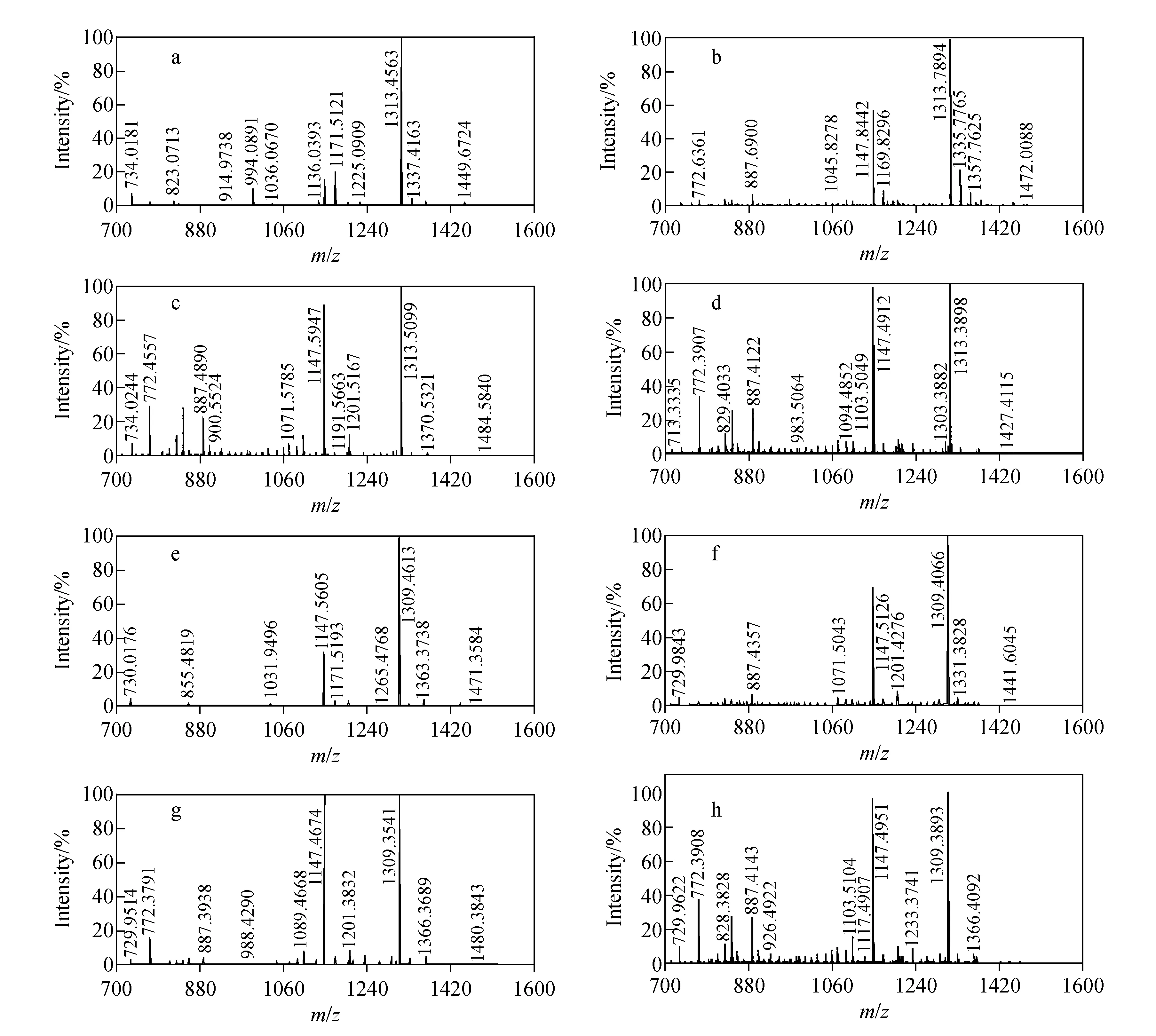
图4 稀土金属铥(Tm)标记产物放置1周(a)、2周(b)、3周(c)、4周(d)和钬(Ho)标记产物放置1周(e)、2周(f)、3周(g)和4周(h)的质谱图Fig.4 The MS spectra of thulium (Tm) labeled after one week (a), two weeks (b), three weeks (c), four weeks (d) and holmium (Ho) labeled after one week (e), two weeks (f), three weeks (g) and four weeks (h)
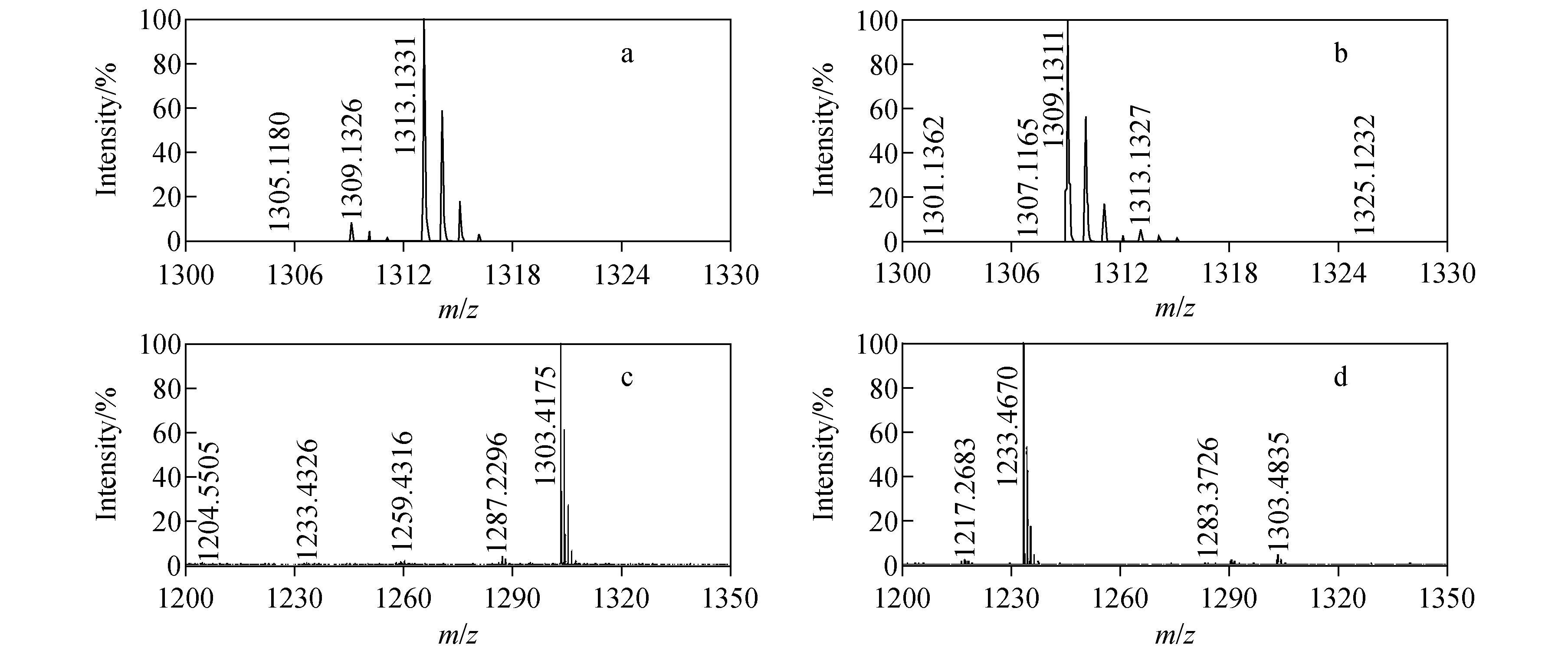
注:a.将钬元素加入到铥标签;b.将铥元素加入到钬标签;c.将钇元素加入到铽标签;d.将铽元素加入到钇标签图5 稀土金属钬和铥、钇和铽交换实验质谱图Fig.5 The MS spectra of rare earth metal holmium and thulium, terbium and yttrium after cross labeled
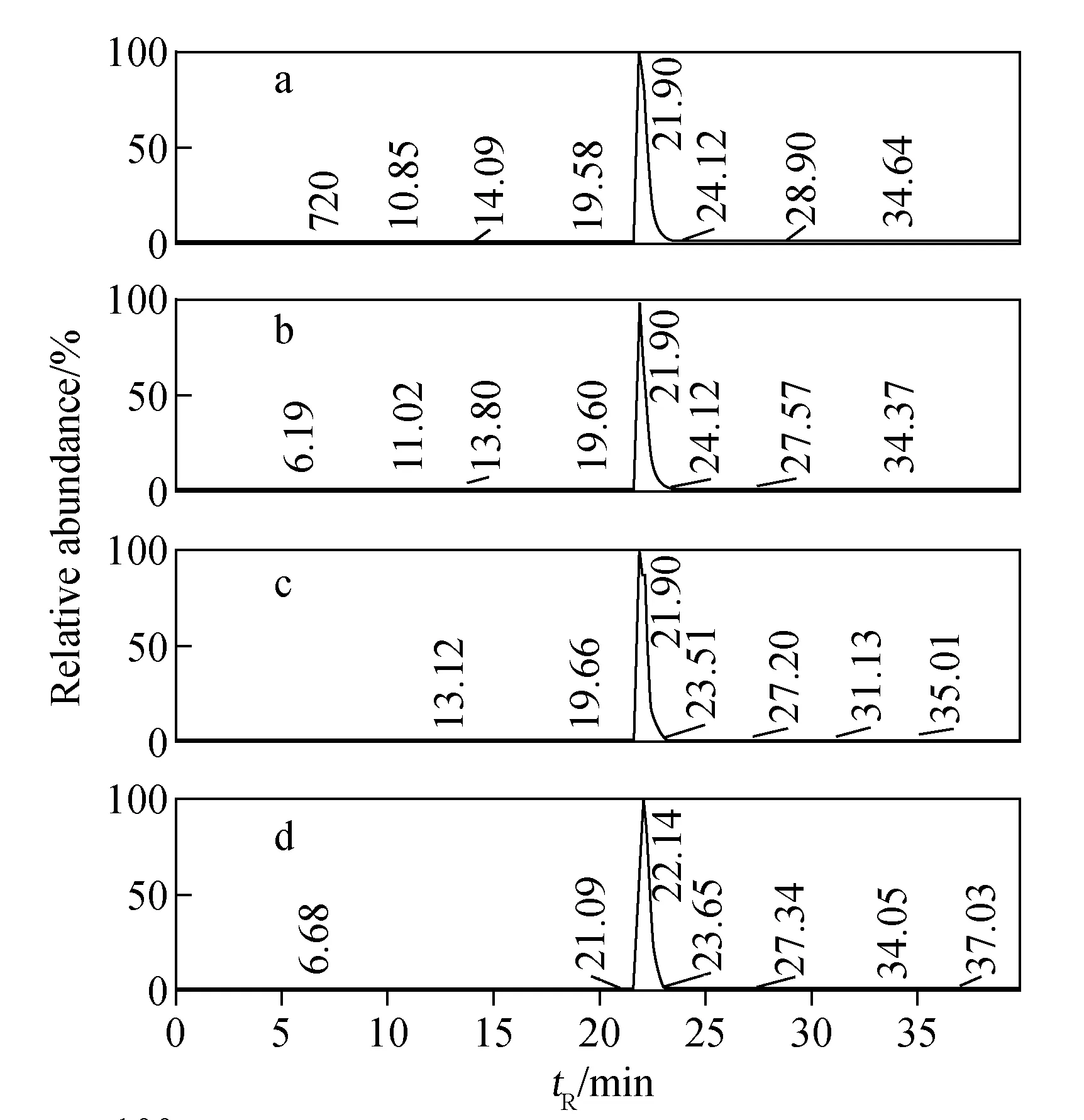
注:a. Tb; b. Ho; c. Tm; d. Lu图6 不同金属离子标记的肌红蛋白酶切肽段LC/MS的共洗脱质谱图Fig.6 The analysis of the labeled peptide mixture of MYO by LC/MS
2.6 检测限
为了考察稀土元素标记后肽段的检测限,本实验将Tm和Ho标记样品分别稀释为不同的浓度梯度,列于表4,然后进行MALDI源质谱分析,结果示于图7和图8。
将Tm和Ho两元素质量标签的浓度分别从432 μmol/L和398 μmol/L稀释到1.08 μmol/L和1.00 μmol/L,从对应的质谱图可以看出,在稀释不同倍数后,质谱峰强度逐渐减弱,当浓度分别达到1.08 μmol/L和1.00 μmol/L时,目标峰变得很弱,而此时噪音峰强度已明显增强。因此,可以得出MALDI源质谱对稀土金属标签的检测限可达近1 μmol/L。
表4 铥和钬稀释后的浓度梯度
2.7 动态范围
不同金属元素与肽段标记后在质谱中的响应程度不同,同时该响应程度随样品浓度的变化而变化。而且,当两种不同金属标记的样本在同一体系中时,相互之间会有离子抑制效应。诸多因素共同作用,使得多元素标记时,理论比例与实测比例有较大差别。为了考察稀土金属的离子抑制效应,将两种元素分别标记的肌红蛋白的酶切肽段溶液按不同比例(物质的量之比)混合,进行质谱分析。
Liu等[7]已对稀土金属元素Tb和Y的动态范围进行研究,因此本研究仅对Ho和Tm进行考察。首先将Ho和Tm与MYO酶切肽段进行标记,然后将标记好的肽段分别按比例(Tb/Y)1∶10、1∶6、1∶3、1∶1、3∶1、6∶1、10∶1(物质的量之比)混合,进行MALDI-TOF MS分析,测定两金属标签的实际比例,实验结果列于表5。
结果表明,随着两金属浓度差的变化,两对金属的实测比例与理论加入比例差异会增大,而且两者比例相差越大,由此带来的差异也越大。由于一般在定量蛋白质组学研究中,当差异比值大于2时,即认为是显著差异,所以,该结论并不影响差异较大的蛋白质组的比较分析。
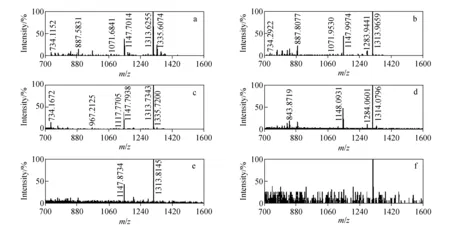
注:a. 432 μmol/L; b. 43.2 μmol/L; c. 21.6 μmol/L; d. 4.32 μmol/L; e. 2.16 μmol/L; f. 1.08 μmol/L 图7 不同浓度时稀土金属铥(Tm)标记产物的质谱图Fig.7 The MS spectra of rare earth metal thulium(Tm) labeled at different concentration
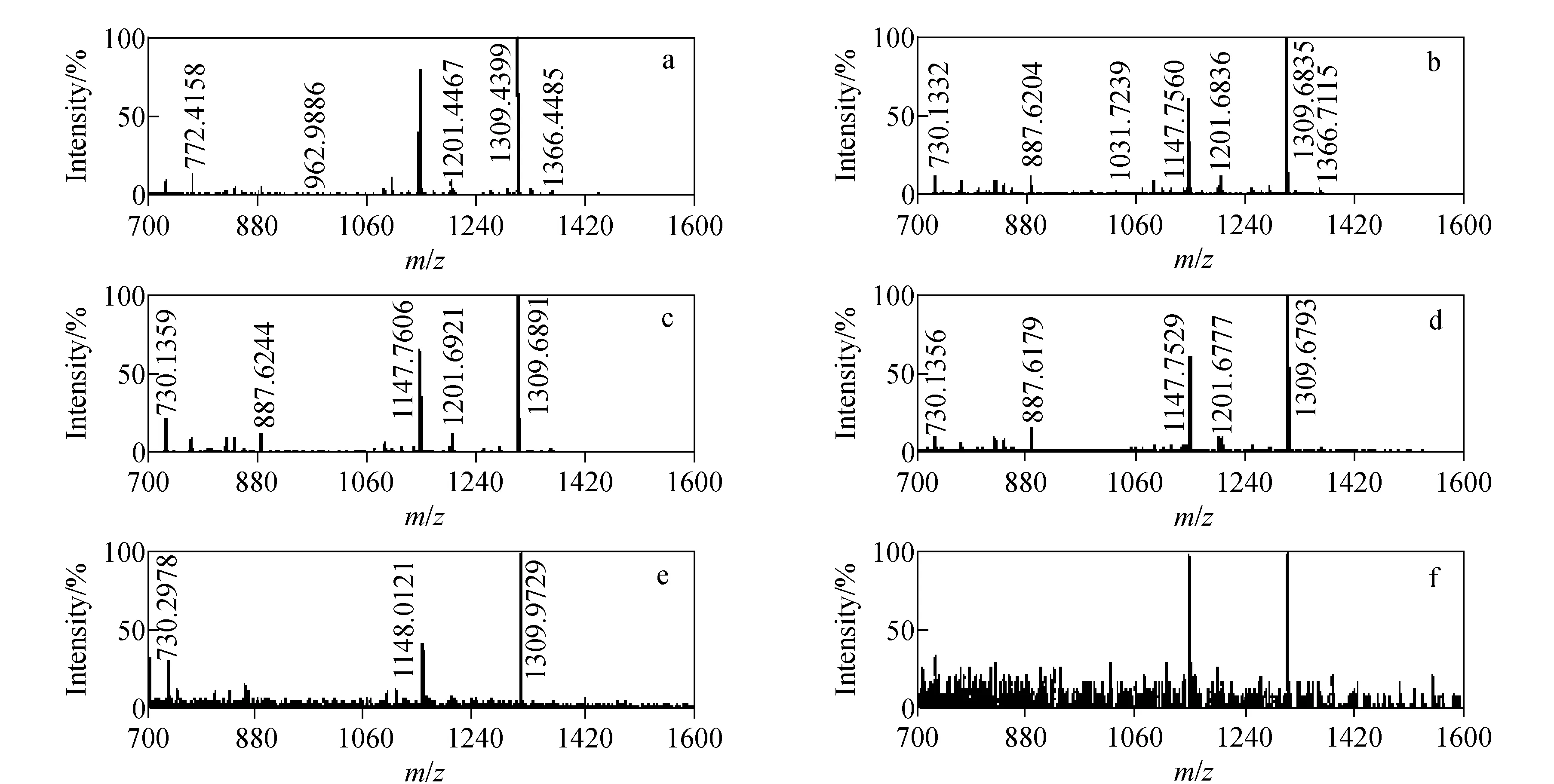
注:a. 398 μmol/L; b. 39.8 μmol/L; c. 19.9 μmol/L; d. 3.98 μmol/L; e. 1.99 μmol/L; f. 1.00 μmol/L图8 不同浓度时稀土金属钬(Ho)标记产物的质谱图Fig.8 The MS spectra of rare earth metal holmium(Ho) labeled at different concentration
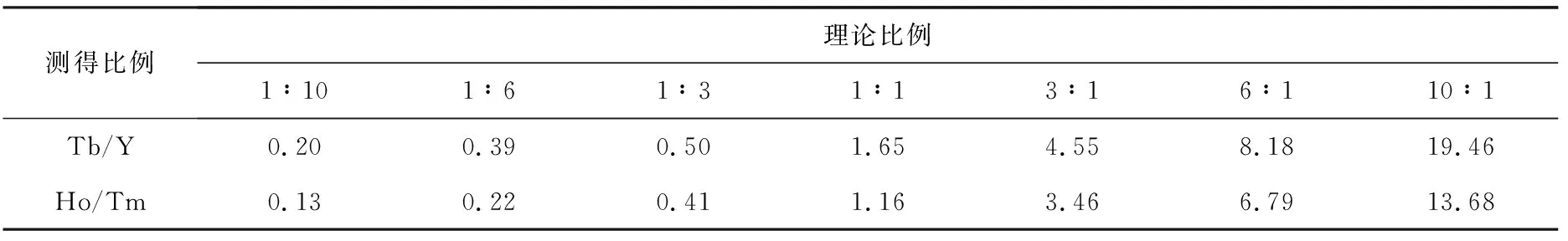
测得比例理论比例1∶101∶61∶31∶13∶16∶110∶1Tb/Y0.200.390.501.654.558.1819.46 Ho/Tm0.130.220.411.163.466.7913.68
2.8 ε-氨基封闭
金属元素与标准肽段LRRASLG标记,不存在侧链氨基的干扰问题,但对于蛋白质酶切肽段,因含有ε-氨基,而DTPA双酸酐易与ε-氨基反应,又由于位阻等因素的影响,该反应进行不完全,因此会使定量结果误差显著增大。所以,在进行金属离子螯合之前,必须将ε-氨基进行封闭[21]。 胍基化反应封闭赖氨酸的ε-氨基有两个优点:一是反应完全;二是由于高精氨酸的胍基(pKa=12.48)比赖氨酸的氨基(pKa=10.48)有更强的碱性,所以更容易结合质子带上正电荷,能提高以K结尾肽段在MALDI源质谱分析中的信号强度。因此,选择胍基化反应封闭赖氨酸的ε-氨基。其反应条件为:pH 11.0,胍基化试剂浓度100 mmol/L,反应温度37 ℃,反应时间4 h。实验结果示于图9。
由图9可知,在此条件下,含有赖氨酸的肽段完全被封闭。另外,马心肌红蛋白酶切肽段在胍基化修饰前,只有m/z1 606.769 4和m/z1 884.913 6丰度较强;而胍基化修饰后,高丰度峰个数和峰整体强度都有明显提高;因不含ε-氨基,没有胍基化修饰的m/z1 606.769 4峰强度没有发生明显变化。
另外,还选择α-乳白蛋白和β-乳白蛋白酶切肽段进行胍基化修饰,结果列于表6。
从表6可知,除肽段YDNSLK、YIPGTK和GAAQNIIPASTGAAK胍基化率相对较低外(仍大于95%),其余肽段的胍基化效率均达到100%。因此,胍基化反应封闭肽段中赖氨酸的ε-氨基方法,可用于稀土元素标记前样本处理。
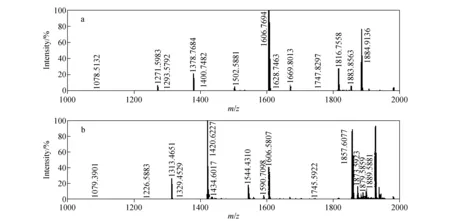
图9 马心肌红蛋白酶切肽段胍基化修饰前(a)和修饰后(b)的质谱图Fig.9 The MS spectra of peptides from MYG before guanidination(a) and after guanidination(b)
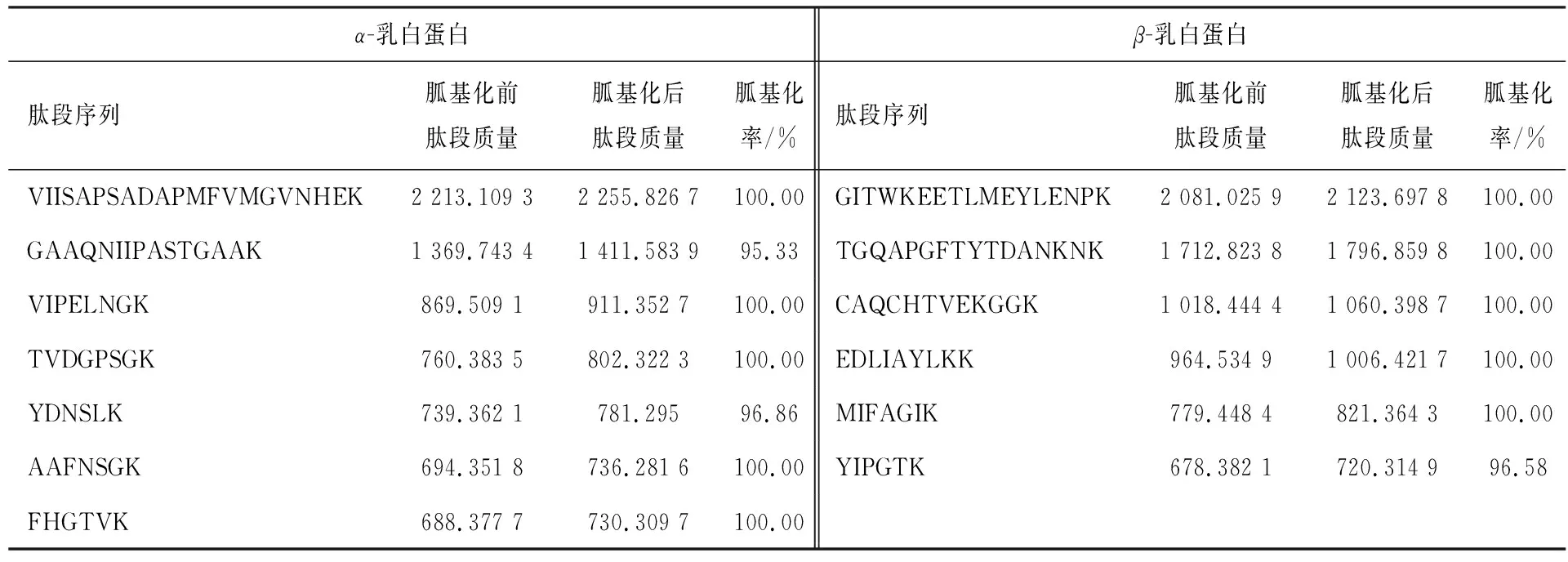
α-乳白蛋白β-乳白蛋白肽段序列胍基化前肽段质量胍基化后肽段质量胍基化率/%肽段序列胍基化前肽段质量胍基化后肽段质量胍基化率/%VIISAPSADAPMFVMGVNHEK2 213.109 32 255.826 7100.00GITWKEETLMEYLENPK2 081.025 92 123.697 8100.00GAAQNIIPASTGAAK1 369.743 41 411.583 995.33TGQAPGFTYTDANKNK1 712.823 81 796.859 8100.00VIPELNGK869.509 1911.352 7100.00CAQCHTVEKGGK1 018.444 41 060.398 7100.00TVDGPSGK760.383 5802.322 3100.00EDLIAYLKK964.534 91 006.421 7100.00YDNSLK739.362 1781.29596.86MIFAGIK779.448 4821.364 3100.00AAFNSGK694.351 8736.281 6100.00YIPGTK678.382 1720.314 996.58FHGTVK688.377 7730.309 7100.00
3 结论
本研究通过选择稀土金属Tb、Y、Tm、Ho和Lu对标记标准肽段的反应条件进行优化,对标记效率、色谱行为、标记稳定性和离子交换等现象进行考察。结果表明:金属元素标记效率较高,而且在4 ℃放置一周后,仍可检测到95%;标有不同金属元素的肽段可以在色谱分离时共洗脱;在结合常数相差不大(差值小于1)的情况下,金属交换标记现象可以忽略,不会对标记产生影响;标记有金属元素的肽段在MALDI源质谱中的响应度可达1 μmol/L;在两种金属浓度差不超过6倍时,由离子抑制带来的影响较小,不影响差异较大的蛋白质组的比较分析;对于ε-氨基的干扰问题,通过胍基化修饰可以进行有效的封闭。这些为目前金属标记应用于蛋白质相对定量提供了新的选择。另外,该标记方法若与电感耦合等离子体质谱法(ICP-MS)结合,可对蛋白质进行绝对定量,ICP-MS[22]具有对极低含量元素实施精确定量的优势(可达10-15),这使得该方法在蛋白质绝对定量研究中显示出巨大的潜力。
参考文献:
[1] GEVAERT K, IMPENS F, GHESQUIÉRE B, et al.Stable isotopic labeling in proteomics [J]. J Proteomics, 2008, 8(23/24): 4 873-4 885.
[2] 李 伟. iTRAQ多重化学标记串联质谱技术在比较蛋白质组学中的应用[J]. 生命的化学, 2006, 26 (5): 453-456.
LI Wei. The application of iTRAQ Multiple chemical labeling tandem mass spectrometry technology in comparative proteomics[J]. Chemistry of Life, 2006, 26 (5): 453-456(in Chinese).
[3] DESOUZA L, DIEHL G, RODRIGUES M J, et al.
Search for cancer markers from endometrial tissues using differentially labeled tags iTRAQ and cICAT with multidimensional liquid chromatography and tandem mass spectrometry[J]. Journal of Proteome Research, 2005, 4(2): 377-386.
[4] ZHANG G A, SPELLMAN D S, SKOLNIK E Y,et al. Quantitative phosphotyrosine proteomics of EphB2 signaling by stable isotope labeling with amino acids in cell culture (SILAC) [J]. Journal of Proteome Research, 2006,5(3): 581-588.
[5] 钱林艺, 应万涛, 刘 新, 等. 稳定同位素标记定量蛋白质组研究技术的建立与优化[J].分析化学, 2007, 35(2): 161-165.
QIAN Linyi, YING Wantao, LIU Xin, et al. Establishment and optim ization of stable isotope18O2labeling strategy for quantitative proteomics research[J]. Chinese Journal of Analytical Chemistry, 2007, 35( 2): 161-165(in Chinese).
[6] WHETSTONE P A, BUTLIN N G, CORNEILLIE T M, et al. Element-coded affinity tags for peptides and proteins[J]. Bioconjugate Chem, 2004, 15(1): 3-6.
[7] LIU H L, ZHANG Y J, WANG J L, et al. Me-thod for quantitative proteomics research by using metal element chelated tags coupled with mass spectrometry[J]. Anal Chem, 2006, 78(18): 6 614-6 621.
[8] AN N, MEHDI M. Analysis of major protein-protein and protein-metal complexes of erythrocytes directly from cell lysate utilizing capillary electrophoresis mass spectrometry[J]. Anal Chem, 2008, 80(18): 7 169-7 173.
[9] LOO J A. Probing protein-metal ion interactions by electrospray ionization mass spectrometry: Enolase and nucleocapsid protein[J]. International Journal of Mass Spectrometry, 2001, 204(1/2/3): 113-123.
[10] CHRISTOPHER A B, JOE S, SEUNG G K, et al.
Directing noble metal ion chemistry within a designed ferritin protein[J]. Biochemistry, 2008, 47(48): 12 729-12 739.
[11] ALFREDO S M, JOSE I G A, ELISA B G. Me-tal chelate fluorescence enhancement in micellar media and its applications to niobium and tantalum ultratrace determinations[J]. Anal Chem, 1985, 57(8): 1 681-1 687.
[12] ROBERT A, STEFAN P, BORIS N, et al. Metal-coded affinity tag labeling: A demonstration of analytical robustness and suitability for biological applications[J]. Anal Chem, 2009, 81(6): 2 176-2 184.
[13] YOUNG S K, BRUCE C, KRISTI L K, et al. Molecular rearrangement of metal-chelating lipid monolayers upon protein adsorption[J]. Langmuir, 2010, 26 (1): 336-343.
[14] PAN J X, XU K, YANG X D, et al. Solution-phase chelators for suppressing nonspecific protein-metal interactions in electrospray mass spectrometry[J]. Anal Chem, 2009, 81(12): 5 008-5 015.
[15] CHRISTINE M P, SCHREITER E R, GUO Y Y, et al. Structural basis of the metal specificity for nickel regulatory protein nikR[J]. Biochemistry, 2008, 47(7): 1 938-1 946.
[16] CORNEILLIE T M, WHETSTONE P A, FISH-ER A J, et al. A rare earth-DOTA-binding antibody probe properties and binding affinity across the Lanthanide series[J]. J Am Chem Soc, 2003, 125(12): 3 436-3 437.
[17] 圣 锋, 贺巍巍, 刘昭飞, 等.177Lu-DOTADTPA-Bz-Cys-RGD dimer的制备及正常鼠体内生物分布[J]. 核化学与放射化学, 2008, 30(2): 70-74.
SHENG Feng, HE Weiwei, LIU Zhaofei, et al. Preparation of177Lu-DTPA-Bz-Cys-RGD dimer and biodistribution evaluation in normal mice[J]. Journal of Nuclear and Radiochemistry, 2008, 30 (2): 70-74(in Chinese).
[18] 林虹君, 卫军营, 张养军, 等. 胍基化修饰结合稀土金属标记应用于蛋白质相对定量研究[J]. 质谱学报, 2010, 31(5): 283-290.
LIN Hongjun, WEI Junying, ZHANG Yangjun, et al. Improved method for protein quantification by using rare earth metal-chelated tags after guanidiation[J]. Journal of Chinese Mass Spectrometry Society, 2010, 31(5): 283-290(in Chinese).
[19] AHRENDS R, PIEPER S, ANDREAS K, et al. A metal-coded affinity tag approach to quantitative proteomics[J]. Molecular & Cellular Proteomics, 2007, 6(11): 1 907-1 916.
[20] EUGENIO C R, ZOLTAN S, ANTONIO M, et al. Influence of winemaking practices on the concentration of rare earth elements in white wines studied by inductively coupled plasma mass spectrometry[J]. J Agric Food Chem, 2007,55(2):311-317.
[21] RICHARD L, BEARDSLEY, JAMES P R. Optimization of guanidination procedures for MALDI mass mapping[J]. Anal Chem, 2002, 74(8):1 884-1 890.
[22] WANG M, FENG W Y, ZHAO Y L, et al. ICP-MS-Based strategies for protein quantification[J]. Mass Spectrom Rev, 2010, 29(2): 326-348.

