皮质醇纯物质中杂质分析与定值
王孜一,戴新华,张 伟,李红梅,王绍利,许 靓
(1.中国计量科学研究院,北京 100013;2. 江苏省环境监测仪器计量中心,江苏 常州 213164)
皮质醇(hydrocortisone,HC)的化学名称是11β,17α,21-三羟基孕甾-4-烯-3,20-二酮,属于甾体类化合物,其结构示于图1。皮质醇是肾上腺皮质激素的一种,也是主要的应激性激素,在脑垂体分泌的促皮质素(ACTH)的调节下,由肾上腺束状带合成、分泌,是人体最主要的、内源性的、具有生物活性的糖皮质激素。

图1 皮质醇的化学结构Fig.1 Structural of hydrocortisone
皮质醇的合成方法分为全合成法和半合成法。全合成法即全化学合成法,步骤多、转化率
低[1-4]、价格昂贵。目前生产的皮质醇几乎全部采用半合成法,以含甾体母核的生物质作为原料[5-10],其中薯蓣皂素是使用最为广泛的生产原料。薯蓣皂素经开环裂解去掉E、F环后,能获得理想的HC关键中间体——双烯醇酮醋酸酯;将双烯醇酮醋酸酯C3羟基转化为羰基,C5、C6双键移至C4、C5位,再引入C11、C17、C21三个位置的羟基,可得到HC,其流程图示于图2。
在当前临床医学和药物学研究中,测定皮质醇的水平是一项重要的指标。皮质醇不仅对调节人体的脂肪和蛋白质的代谢有重要作用,对免疫系统和其他内分泌系统也有影响。激素类纯物质中结构类似物较多,杂质结构分析和定量测定难度大,这是临床检验量值溯源亟待解决的问题。本工作将对皮质醇纯品中的杂质进行定性定量以及纯度测量,旨为激素类及其他有机纯物质的定性和定量提供方法参考。

图2 皮质醇制备流程图Fig.2 Flow Chart of hydrocortisone fabrication
1 实验部分
1.1 主要仪器与试剂
液相色谱-离子阱飞行时间串联质谱仪(HPLC-IT-TOF),液相色谱二极管阵列检测器(HPLC-DAD):日本岛津公司产品;Agilent 6410 QQQ三重四极杆质谱仪,Agilent 6890N气相色谱仪,Agilent G1888顶空进样器:美国Agilent公司产品;XP205电子天平(最小分度值0.01 mg),UMX2电子天平(最小分度值0.1 μg),DL-39卡尔费休库仑法水分测定仪:瑞士梅特勒公司产品;TGA-1热重分析仪:美国Perkin-Elmer公司产品;电感耦合等离子体质谱仪(ICP-MS):美国Thermo公司产品;Bruker AVANCE IIITM 800核磁共振仪:德国Burker公司产品,配四共振超低温探头。
皮质醇纯品(标示纯度99.5%),醋酸氢化可的松纯品(标示纯度99.5%):德国Dr. Ehrenstorfer公司产品;可的松纯品(标示纯度98%):美国Sigma公司产品;乙腈,甲醇(色谱级):德国Merck公司产品;氘代丙酮:北京汉威士波谱公司产品;尼泊金乙酯(GBW(E)100064):由中国计量科学研究院提供;高纯三次水,过0.22 μm滤膜。
1.2 样品制备
皮质醇纯度标准物质的候选物为德国Dr. Ehrenstorfer公司产品,初步分析纯度达99%以上。将其分装至棕色玻璃瓶中,单元数为300瓶,每瓶约100 mg,避光密封,于-20 ℃下保存,作为皮质醇纯度标准物质的原料。
1.3 样品溶液和标准溶液的配制
待测样品溶液和标准溶液均采用重量法配制,以甲醇为溶剂,所有样品及标准储备溶液均于4 ℃下熔融,密封保存于棕色安瓿瓶中。
1.4 实验条件
1.4.1HPLC-IT-TOF条件 色谱条件:ZORBAX Eclipse Plus C18色谱柱(2.1 mm×150 mm×3.5 μm);流动相为0.1%甲酸水溶液(A)和甲醇(B);流速0.2 mL/min;等度洗脱(A/B=58/42),洗脱时间90 min;进样量2 μL。
质谱条件:ESI离子源,正离子方式;扫描范围m/z50~500;离子源温度200 ℃;曲型脱溶剂管温度200 ℃;雾化气流速(N2)1.5 L/min;检测器电压1.58 kV;碰撞能量:50%,70%;碰撞气流速(Ar)45 mL/min。
1.4.2HPLC-MS/MS条件 色谱条件同HPLC-IT-TOF。
质谱条件:ESI离子源,正离子方式;脱溶剂气温度350 ℃;脱溶剂气流速9 L/min;雾化器压力2.76×105Pa;毛细管电压3 500 V。碎裂电压、SIM离子采集参数列于表1。
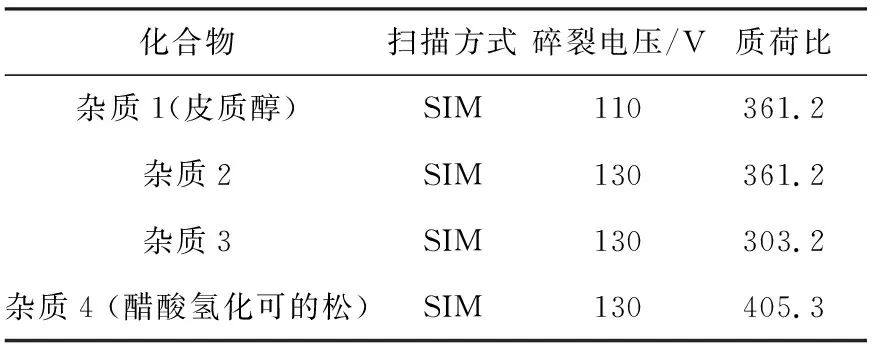
表1 不同化合物的扫描模式、碎裂电压和母离子
1.4.3顶空进样及色谱条件 顶空进样条件:顶空进样瓶体积10 mL,炉温60 ℃,定量圈温度80 ℃,传输线温度100 ℃,平衡时间20 min。
气相色谱条件:DB-624色谱柱(30 m×0.32 mm×1.8 μm);进样口温度150 ℃;检测器温度250 ℃;进样体积100 μL;分流比为5∶1;载气(N2)流速1.4 mL/min;升温程序:初始温度为45 ℃,保持5 min,以7 ℃/min升至120 ℃,然后以15 ℃/min升至220 ℃,保持8 min。
1.5 定性分析
采用HPLC-IT-TOF法对与主成分结构类似的杂质进行定性分析,借助质谱仪的高分辨率和精确质量数优势,由杂质化合物各级质谱碎片的测量值、化学式和理论值,推测杂质的分子式和结构。
1.6 定量分析
采用液相色谱-质谱(HPLC-MS/MS)外标单点法对皮质醇纯品中与主成分结构类似的杂质进行定量分析,并采用卡尔费休库仑法测定皮质醇纯品中的水含量,顶空-气相色谱法测定皮质醇纯品中挥发性杂质含量,电感耦合等离子体质谱法测定无机元素。
2 结果与讨论
2.1 皮质醇纯品中与主成分结构类似的杂质定性
近年来各种串联质谱得到了广泛应用,如三重四极杆质谱、四极杆飞行时间质谱、离子阱飞行时间串联质谱等。其中,离子阱飞行时间串联质谱既具备高分辨率和高准确度,又具备多级质谱功能(最多到10级),因此对化合物分子式的预测能力强,对复杂裂解规律的推导准确性高,特别适合同时对多种微量成分进行准确定性和定量的分析[11-14]。
皮质醇纯品中主成分和杂质分离的液相色谱图和总离子流图分别示于图3、图4。
从两张图的对比可见,杂质1、2、3、4的含量较高,根据图3中归一化结果分析,杂质1、3、4的含量都大于或等于千分之一,图4中杂质2的含量也较高,通常在纯物质的定值方法中,大于千分之一的杂质需要分别定值,因此,需要对杂质1、2、3、4分别定值。根据质量平衡法,含量小于千分之一的杂质对最终纯物质的纯度值影响很小,一般可以忽略。图3中,杂质3、4之间的两个峰在归一化计算的结果中均小于千分之一,而且在图4中的响应也很小,含量较小,可忽略不计。

图3 皮质醇纯品中主成分和杂质分离的液相色谱图 Fig.3 Chromatogram of main component and impurities in hydrocortisone

图4 皮质醇纯品中主成分和杂质分离的总离子流色谱图 Fig.4 TIC diagram of main component and impurities in hydrocortisone
为了能够准确定值,先对需要定值的4种杂质进行定性分析。通过HPLC-IT-TOF获得4种杂质的母离子及精确分子质量。参照文献[15],并结合所测定的4种杂质的精确分子质量,初步认定,杂质1为可的松,杂质2为可的松的异构体,杂质3未知,但是一种与皮质醇结构类似的激素,杂质4为醋酸氢化可的松。
向皮质醇样品中加入可的松和醋酸氢化可的松样品,用HPLC进行测试,通过保留时间来验证杂质1、4是否为可的松和醋酸氢化可的松,结果示于图5和图6。与图3相比较,杂质1和杂质4的峰高明显增加,但保留时间完全一致,从而可以确定杂质1与杂质4分别为可的松和醋酸氢化可的松。
采用HPLC-IT-TOF法对样品中的杂质进行分子质量测定和1级、2级、3级碎片分析,并预测其分子式,结果列于表2。然后再采用HPLC-IT-TOF法对可的松、醋酸氢化可的松的纯品进行1级、2级、3级碎片分析,得到杂质及纯品的分子式和碎片信息,并根据精确分子质量和碎片离子质荷比进行分子式的预测,结果列于表3。

图5 添加可的松的皮质醇样品液相色谱图 Fig.5 Chromatogram of hydrocortisone with addition of cortisone

图6 添加醋酸氢化可的松的皮质醇样品液相色谱图 Fig.6 Chromatogram of hydrocortisone with addition of hydrocortisone acetate
通过比较样品中杂质及纯品的保留时间、分子质量、预测分子式及碎片信息,表明杂质1与可
的松完全一致,杂质4与醋酸氢化可的松完全一致。杂质2的分子质量以及预测分子式与可的松相同,结合相关报道[16]初步预测杂质2可能是泼尼松龙,但杂质2与泼尼松龙的保留时间不一致,说明杂质2不是泼尼松龙。杂质3的预测分子式为C19H26O3,根据皮质醇合成路线,可能为甲睾酮,但杂质3与甲睾酮的保留时间不一致,说明杂质3不是甲睾酮。
2.2 皮质醇纯品中杂质的定量
2.2.1与主成分结构类似的杂质定量 与主成分结构类似的杂质用HPLC-MS/MS单点外标法测定含量,计算公式为:
(1)
式中,mim为皮质醇中杂质的质量;mc为皮质醇样品的质量;Aim为皮质醇样品溶液中杂质的峰面积;Astd为杂质标准溶液的峰面积;cstd为杂质标准溶液的浓度;cim为皮质醇样品的浓度;Ps为配制杂质标准溶液所用纯品的纯度。
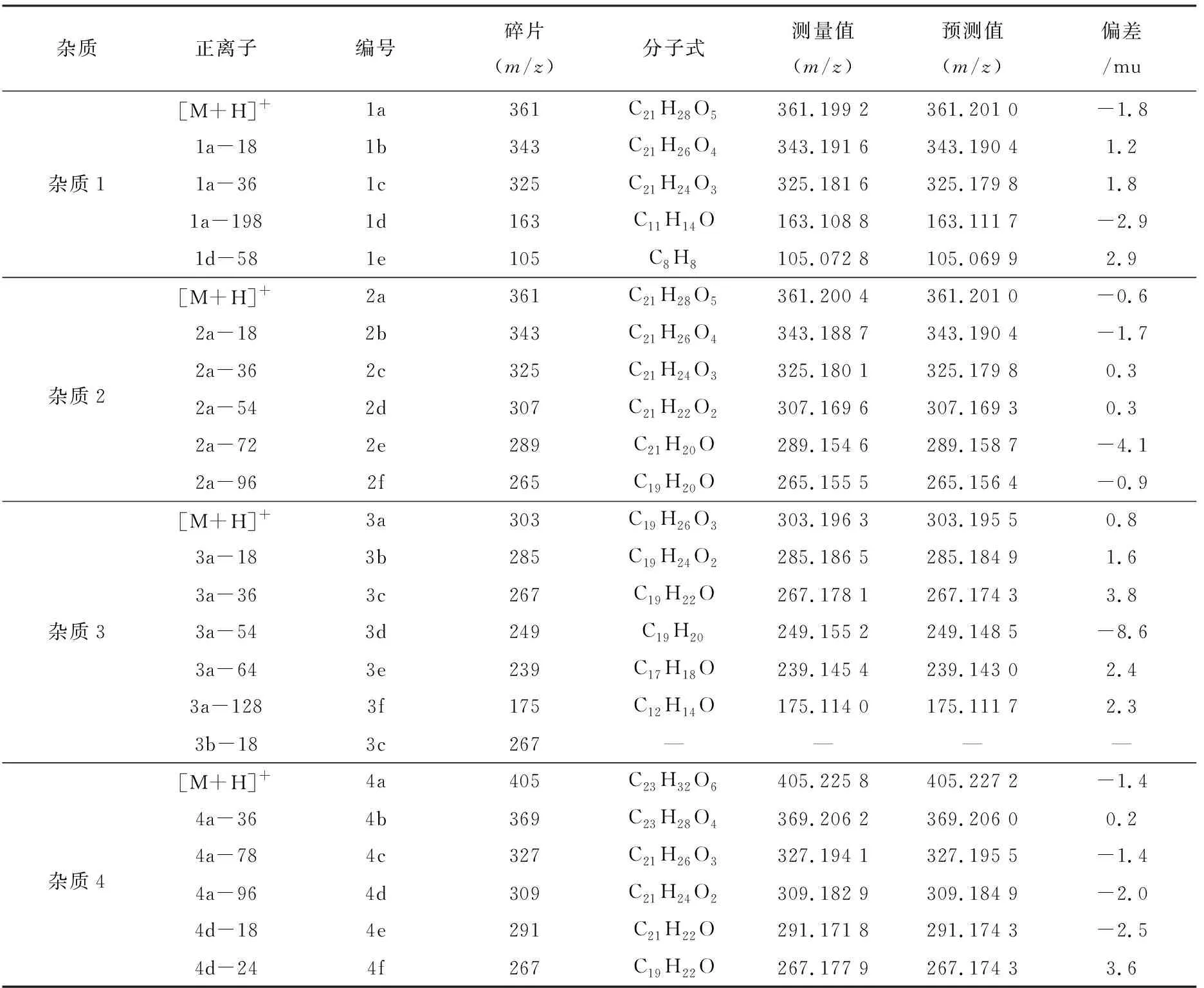
表2 4种杂质的一级、二级及三级碎片,离子精确质量数和预测分子式

表3 可的松、醋酸氢化可的松的一级、二级及三级碎片,离子精确质量数和预测分子式
其中,杂质1和 4已经定性,可选取相应纯品作为标准;杂质2和3未最终确定,但从碎片信息中可以推断出,杂质2是一种分子式与可的松相同,且结构类似的甾体类化合物,即可的松的异构体,而杂质3也是一种甾体类化合物,因此可以选取结构类似的化合物纯品作为标准进行定量分析。初步选定可的松和皮质醇作为标准替代物,分别采用HPLC-MS/MS和HPLC-UV两种方法对杂质2和3的含量进行测定。结果表明,用皮质醇作为标准替代物测得的结果略高,两种方法的定量结果偏差仅为0.1%。根据测量结果可适当放大不确定度的原则,最终使用HPLC-MS/MS方法,同时采用皮质醇作为标准替代物对杂质2和3进行定值。4种杂质的测量结果列于表4。
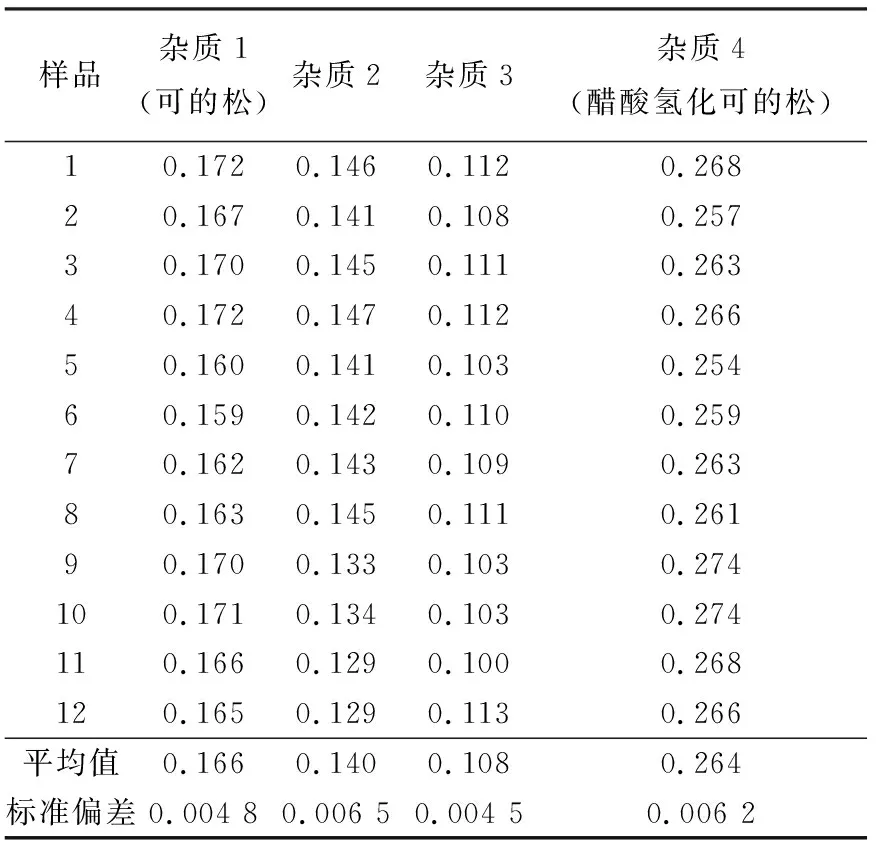
表4 皮质醇中与主成分结构类似杂质的含量测定结果
2.2.2水分及挥发性杂质定量 样品中水分含量由卡尔费休库仑法水分测定仪测量,结果列于表5。挥发性杂质主要是挥发性有机溶剂,如甲醇、乙醇、乙腈、甲苯残留,含量由顶空气相色谱法测定,皮质醇纯品制备时,大部分挥发性物质已被除去,测量结果小于0.01%(100 μg/g)。
2.2.3不挥发性杂质定量 采用ICP-MS法对样品中不挥发性杂质进行分析,得到无机类杂质的总含量为0.008 9%。
2.3 皮质醇纯度定值及不确定度计算
2.3.1纯度定值 目前国际上对有机纯物质的定值大多采用质量平衡法[17],这种方法的定值准确度高,计算公式为:
WA=100%-(WRS+WW+WOS+WNV)
(2)
式中,WA为待测样品纯度;WRS为与主成分结构类似的杂质含量;WW为水分含量;WOS为挥发性杂质含量;WNV为不挥发性杂质含量。
计算得到皮质醇纯度值为99.18%。
采用定量核磁法对定值结果进行验证,以尼泊金乙酯为内标,核磁定量结果列于表6。

表5 皮质醇中水分含量测定结果
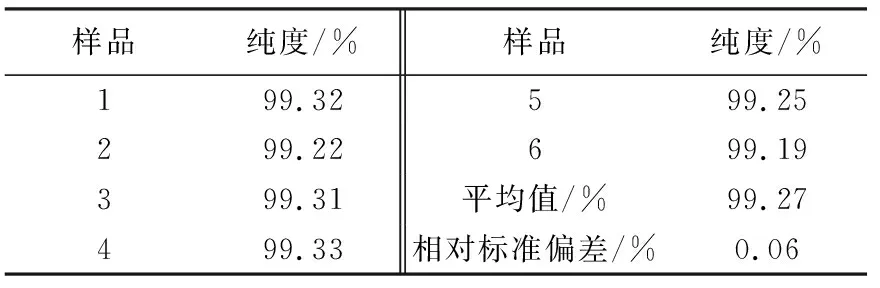
表6 皮质醇核磁定量结果
质量平衡法与核磁法定量结果的相对偏差仅为0.09%,说明质量平衡法定值结果准确、可靠。
2.3.2不确定度计算 皮质醇纯度定值的不确定度是由每类杂质所引入的不确定度合成而来[18],其计算公式为[19]:
u(WA)=
(3)
式中,u(WA)为皮质醇纯度测定值的合成不确定度;u(WRS)为与主成分结构类似杂质所引入的不确定度;u(WW)为水分引入的不确定度;u(WOS)为挥发性杂质引入的不确定度;u(WNV)为不挥发性杂质引入的不确定度。
质量平衡法计算得到皮质醇定值的合成不确定度为0.09%,扩展不确定度为0.18%(k=2,置信度为95%)。
3 结论
本工作采用HPLC-IT-TOF法对皮质醇纯品中与主成分结构类似的杂质进行了测定和分析,建立了有机纯物质中与主成分结构类似杂质的定性方法。采用HPLC-MS/MS外标法对与主成分结构类似的杂质进行了定量分析,并采用卡尔费休库仑法、顶空-气相色谱法以及电感耦合等离子体质谱法对水分、挥发性杂质以及不挥发性杂质的含量进行了测定,通过质量平衡法计算皮质醇纯品的纯度值,同时采用定量核磁进行验证。结果表明,两种方法定值结果的一致性较好,说明所建立的定性及定量方法准确可靠,对激素类及其他有机纯物质的定性和定量有较好的指导作用。
参考文献:
[1] WOODWARD R B, SONDHERMER F, TAULE D, et al. The total synthesis of steroids[J]. J Am Chem Soc, 1952, 74(17): 4 223-4 251.
[2] HORIGUCHI Y, NAKAMURA E, KUWAJIMA I. Total synthesis of (.+-.)-cortisone. Double hydroxylation reaction for the construction of corticoid side chain [J]. J Org Chem, 1986, 51(22): 4 323-4 325.
[3] OLIVETO E P, RUSSER R, WEBER L, et al. 11-Oxygenated Steroids. XVI. The preparation of hydrocortisone from cortisone acetate[J]. J Am Chem Soc, 1956, 78(8):1 736-1 738.
[4] MINAGAWA K, FURUTA T, KASUYAY, et al.
Total synthesis of cortisol: Application to selective deuteriation at C-1 and C-19[J]. J Chem Soc Perkin Trans 1, 1988,(3): 587-591.
[5] 段长强,王兰芬. 药物生产工艺及中间体手册[M]. 北京:化学工业出版社,2002:405-408.
[6] SHUVALOVA S D, GABINSKAYA K N. Microbiological transformation of cortexolone into hydrocortisone[J]. Pharmaceutical Chemistry Journal, 2002, 36(12): 664-666.
[7] STILOV Y H, LANIN D V, SHIRSHEV S V. Effect of HC on the functions of the circulating pool of phagocytizing cells under the conditions ofβ- adrenergic blockade [J]. Doklady Biochemistry and Biophysics, 2001, 379(1-6): 284-286.
[8] SINGH O N. Improved process for manufacturing compositions containing ciprofloxacin and HC[P]. WIPO: WO0207704, 2002-01-31.
[9] HANNA C, ROCK L. Aqueous solvent for corticosteroids: US, US6777401B2[P]. 2002-5-6.
[10] WANG J, CHEN C, LI B, et al. Production of HC from cortexalone-2-acetate by immobilized Absidia orchidis in cosolvent-containing media-side-chain degradation of cholesterol byMycobacteriumsp.[J]. Enzyme Microb Technol, 1998, 22(5): 368-373.
[11] HAO H P, CUI N, WANG G J, et al. Global Detection and Identification of nontarget components from herbal preparations by liquid chromatography hybrid ion trap time-of-flight mass spectrometry and a strategy[J]. Anal Chem, 2008, 80(21): 8 187-8 194.
[12] DAMSTEN M C, van VUGT-LUSSENBURG B,
ZELDENTHUIS T, et al. Application of drug metabolising mutants of cytochrome P450 BM3 (CYP102A1) as biocatalysts for the generation of reactive metabolites [J]. Chemico-Biological Interactions, 2008, 171(1): 96-107.
[13] YOSHINAGA N, ABOSHI T, ISHIKAWA C, et al. Fatty acid amides, previously identified in caterpillars, found in the cricket teleogryllus taiwanemma and fruit fly drosophila melanogaster larvae [J]. J Chem Ecol, 2007, 33(7): 1 376-1 381.
[14] ZUCKSCHWERDT J B, NIXON C E, CINER F L, et al. Liquid chromatography/quadrupole ion trap/time-of-flight determination of the efficacy of drug test kits for rapid screening of food[J]. Journal of Food Protection, 2008, 71(5): 1 007-1 014.
[15] 赵临襄. 化学制药工艺学[M].北京:中国医药科技出版社, 2003: 323-344.
[16] 张 芳, 耿 昱, 郭寅龙. 液相色谱/大气压化学电力飞行时间质谱分析氢化可的松中微量杂质[J]. 有机化学, 2002, 22:123-126.
ZHANG Fang, GENG Yu, GUO Yinlong. Trace impurities analysis of hydrocortisone by LC/APCI MS[J]. Chinese Journal of Organic Chemistry, 2002, 22:123-126(in Chinese).
[17] WESTWOOD S, CHOTEAU T, DAIREAUX A, et al. Mass balance method for the SI value assignment of the purity of organic compounds[J]. Analytical Chemistry, 2013, 85(6): 3 118-3 126.
[18] JJF 1059—1999测量不确定度评定与表示[S]. 北京:中国质检出版社,1999.
[19] ISO/IEC Guide 98-3—2008 Guide to the expression of uncertainty in measurement[S]. Switzerland: ISO, 2008.

