尼莫司汀和卡莫司汀导致细胞中DNA股间交联的高效液相色谱-电喷雾质谱联用研究
李莉莉,陈薛钗,赵丽娇,钟儒刚
(北京工业大学生命科学与生物工程学院,环境与病毒肿瘤学北京市重点实验室,北京 100124)
氯乙基亚硝基脲(CENUs)是双官能团烷化剂类抗癌药物,临床上常用的CENUs有卡莫司汀(BCNU)、尼莫司汀(ACNU)、司莫司汀(Me-CCNU)和福莫司汀(FTMS)等,已被广泛用于治疗脑瘤、何杰金氏病、恶性黑色素瘤以及各种实体瘤,其结构式示于图1。CENUs发挥抗癌作用与其导致DNA股间交联有关[1-3]。在生理条件下,CENUs能够分解产生氯乙基碳正离子,并与鸟嘌呤O6位发生亲电取代反应生成O6-氯乙基鸟嘌呤(O6-ClEtG),进一步经过重排反应,在鸟嘌呤的N1和胞嘧啶的N3连接形成1-[N-(2’-脱氧胞基)]-2-[N-(2’-脱氧鸟基)]乙烷(dG-dC)股间交联产物,阻碍肿瘤细胞DNA的转录和复制,最终诱导细胞凋亡[4-5]。然而,CENUs的致癌副作用和耐药性限制了其进一步开发和临床应用。CENUs在发挥抗癌活性的同时,还能够作用于正常细胞导致DNA损伤,进而诱发二次肿瘤[6],国际癌症研究所(IARC)已将BCNU列为2A组致癌物质。此外,肿瘤细胞对CENUs的耐药性也大大降低了该类药物的化疗效果。O6-烷基鸟嘌呤-DNA-烷基转移酶(AGT)能够修复CENUs引起的DNA股间交联,导致癌细胞对CENUs产生耐药性[7-9]。Ueda-Kawamitsu等[10]采用荧光分析法测定经BCNU处理后L1210细胞中的dG-dC交联,发现反应6 h后交联浓度达到最高;然后随着DNA的修复,交联物浓度开始降低。CENUs产生耐药性的作用机制是,AGT将烷化产物O6-ClEtG上的氯乙基转移到AGT第145位半胱氨酸残基上,从而阻断O6-ClEtG进一步与胞嘧啶反应形成dG-dC交联[11-14]。因此,CENUs导致细胞内DNA股间交联的研究,对于评价药物抗癌活性和开发高效低毒的亚硝基脲类抗癌药物具有重要意义。
高效液相色谱-电喷雾串联质谱(HPLC-ESI-MS/MS)联用技术是检测DNA损伤的有效手段。张俊杰等[15]使用HPLC-ESI-MS/MS法对人结肠癌肿瘤组织中全基因组的DNA甲基化进行研究。Fischhaber等[16]使用HPLC-ESI-MS/MS法对BCNU导致不同序列DNA的股间交联进行研究,发现交联作用没有明显的DNA序列选择性。Rahman等[17]对一种新型CENU类烷化剂SJG-136导致的DNA交联进行定量分析,结果表明,Pu-GAATG-Py序列产生交联的速度最快,而Pu-GATG-Py序列与SJG-136的结合最为稳定。Baskerville-Abraham等[18]测定经不同浓度顺铂处理后卵巢癌细胞A2780和CP70中交联物1,2-guanine-guanine [CP-d(GpG)]的含量,结果表明,对顺铂较为敏感的A2780细胞中,CP-d(GpG)的含量高于具有耐药性的CP70细胞。Malayappan等[19]对人血样中环磷酰胺(CPA)导致的DNA交联产物G-NOR-G进行动力学研究,结果表明,在血样中G-NOR-G交联率在8 h达到最大值,之后的16 h内呈下降趋势。本工作对ACNU和BCNU导致细胞中的DNA股间交联进行研究,建立细胞水平上dG-dC交联物的检测方法,比较不同细胞在不同CENUs作用下交联率的差异,以期为双官能团烷化剂类抗癌药物的抗癌活性评价以及细胞耐药机制的研究提供实验依据。
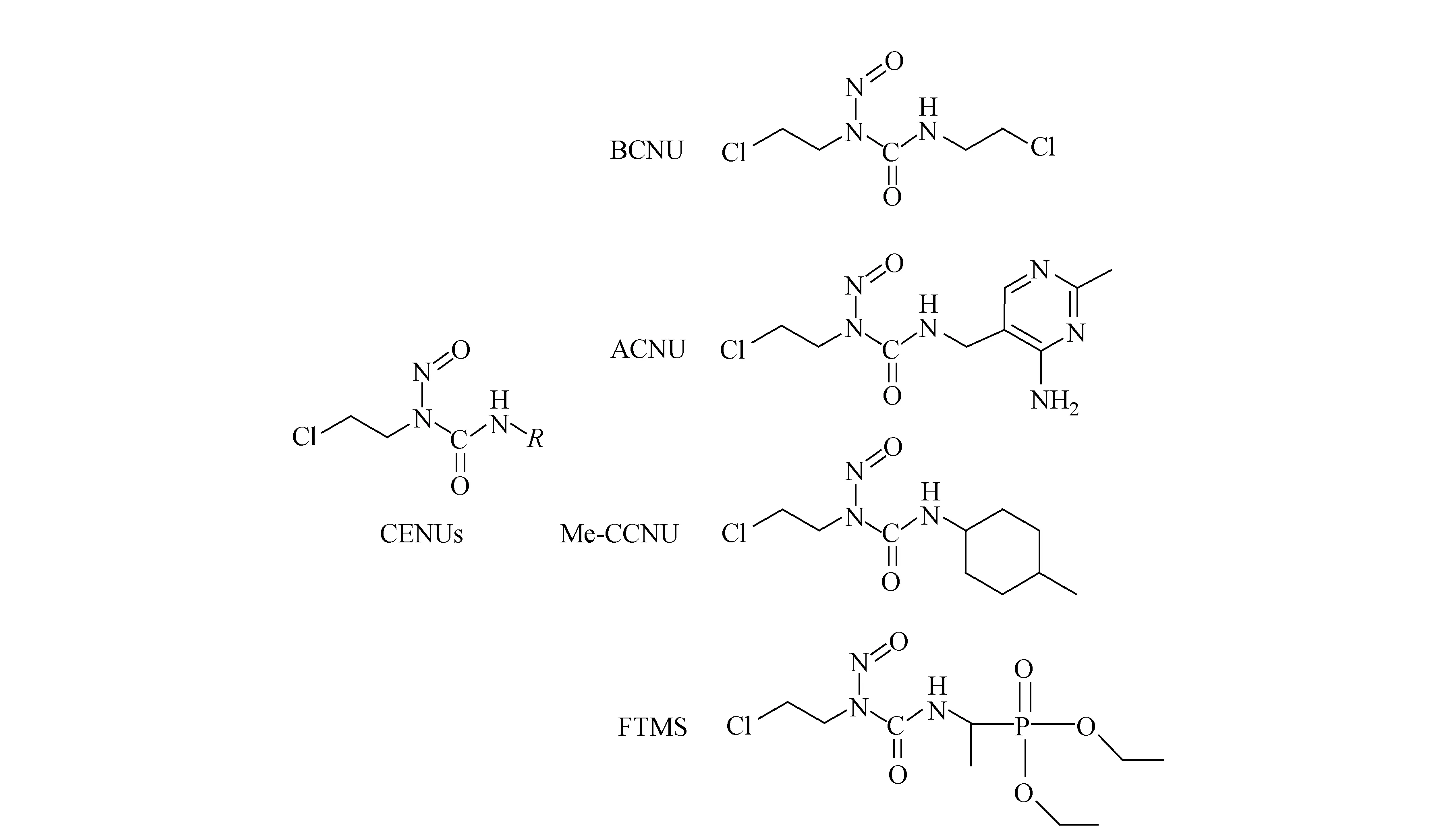
图1 氯乙基亚硝基脲类化合物的结构图Fig.1 Structures of chloroethylnitrosoureas (CENUs)
1 实验部分
1.1 主要仪器
TSQ Quantum高效液相色谱-电喷雾质谱联用仪:美国Thermo-Fisher公司产品,配有电喷雾电离源和Surveyor Plus液相色谱系统;Eppendorf 5355恒温振荡反应器:德国Eppendorf公司产品;Z-323K型台式离心机:德国Hermle公司产品;U-3010紫外可见分光光度计:日本Hitachi公司产品;Microcon YM-30微孔离心过滤器:美国Millipore公司产品。
1.2 主要材料与试剂
小鼠白血病细胞L1210:由北京协和细胞资源中心提供;小鼠胚胎成纤维细胞NIH/3T3:由中国疾病预防控制中心病毒病预防控制所提供;dG-dC和15N3-dG-dC标准品:由本实验室合成[20];尼莫司汀、卡莫司汀、蛇毒磷酸二酯酶、甲醇、乙腈、异戊醇:美国Sigma公司产品;脱氧核糖核酸酶I (DNase I)、牛肠碱性磷酸酶(CIAP)、核糖核酸酶A (RNase A)、S1核酸酶:TaKaRa宝生物工程(大连)有限公司产品;蛋白酶K:美国Genview公司产品;三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(EDTA)(分析纯):北京赛百盛生物技术有限公司产品;十二烷基硫酸钠(SDS)(分析纯):北京鼎国生物技术有限公司产品;无水乙醇、苯酚、氯仿(分析纯):天津市福晨化学试剂厂产品;水:由美国Pall公司超纯水系统制得。
1.3 实验条件
1.3.1色谱条件 Agilent Zorbax SB C18反相色谱柱(150 mm×2.1 mm×5 μm),柱温25 ℃;流动相为去离子水(含0.01%乙酸,溶剂A)和乙腈(溶剂B);梯度洗脱程序:0 min,95% A,5% B;0~20 min,95%~90% A,5%~10% B;20~23 min,90%~95% A,10%~5% B;23~35 min,95% A,5% B;流速0.2 mL/min;进样量25 μL。
1.3.2质谱条件 电喷雾离子源(ESI)正离子检测模式;喷雾电压4 kV;鞘气(N2)压力3.45×105Pa;辅气(N2)压力1.03×105Pa;离子传输毛细管温度300 ℃;碰撞能量20 V;源内碰撞诱导解离能8 V;定量分析采用选择反应扫描(SRM)模式,对m/z521→m/z289和m/z524→m/z292离子通道进行扫描。
1.4 实验步骤
1.4.1细胞培养 选取2种具有不同AGT活性的细胞进行药物处理,分别是小鼠胚胎成纤维细胞NIH/3T3 (AGT高表达)和小鼠白血病细胞L1210 (AGT低表达)。NIH/3T3细胞使用DMEM高糖培养基(含4 mmol/LL-谷氨酰胺、4.5 g/L葡萄糖、1.5 g/L碳酸氢钠),10%胎牛血清,置于37 ℃,5% CO2培养箱中传代培养,每2~3 d传代1次。L1210细胞使用DMEM高糖培养基,10%马血清,置于37 ℃,5% CO2培养箱中传代培养,每2~3 d传代1次。
1.4.2细胞处理 将细胞样品设置为空白对照组和加药处理组。空白对照组细胞未做任何药物处理,只加入等量的药物溶剂。药物处理组分别使用ACNU和BCNU进行处理:配制浓度为0.2 mol/L ACNU水溶液和0.2 mol/L BCNU乙醇溶液,将药物溶液分别加入NIH/3T3和L1210细胞培养基中,使培养基中的药物浓度为0.3 mmol/L和0.45 mmol/L;将加药后的NIH/3T3和L1210细胞置于5% CO2培养箱中,37 ℃培养6 h。
1.4.3DNA的提取 细胞经药物处理完毕后,立即进行DNA提取。向20 mL反应体系中加入4 mL胰酶(NIH/3T3为贴壁细胞,需将其从培养瓶内壁上吹打下来),再以磷酸盐缓冲液(PBS)漂洗,3 000 r/min离心10 min以沉淀细胞。弃去培养基,将细胞转移至50 mL离心管中,加入7 mL细胞裂解缓冲液(10 mmol/L Tris-HCl,100 mmol/L EDTA,0.5% SDS,pH 8.0)、40 μL 20 g/L蛋白酶K溶液和150 μL 5 g/L RNaseA溶液,置于37 ℃水浴,恒温12 h。然后,加入7 mLV(酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1的混合溶液,振荡抽提DNA,以12 000 r/min离心5 min后,将含有DNA的上清液转移至另一离心管中。向上清液中加入15 mL冷异丙醇,倒转混匀后,静置于-20 ℃,可见丝状DNA析出;以12 000 r/min离心5 min,弃上清液,将DNA沉淀转移至1.5 mL离心管中。以70%乙醇/水溶液和100%乙醇洗涤沉淀,然后用氮气吹干,得到细胞DNA。用 10 mmol/L Tris-HCl溶液溶解DNA样品至1 mL,待酶解反应。
1.4.4DNA样品的酶解 各取200 μL上述DNA样品于1.5 mL离心管中,加入15N3-dG-dC内标溶液(浓度为9.6 nmol/L),将其置于98 ℃水浴中热变性5 min,然后迅速放入冰浴中冷却10 min,使DNA双链变成单链。加入20 μL脱氧核糖核酸酶I (2.5 U/μL)和30 μL核酶S1(5 U/μL),37 ℃酸性酶解6 h;然后加入40 μL碱性磷酸酶(0.2 U/μL)和10 μL蛇毒磷酸二酯酶(0.002 U/μL),37 ℃碱性酶解过夜;将酶解液转入YM-30离心过滤器,以15 000 r/min离心30 min,除去蛋白,所得滤液转移至1.5 mL离心管中,待HPLC-MS定量分析。
1.4.5标准溶液的配制 配制浓度分别为0.08、0.2、0.32、0.8、1.6、4、8、16、32、60 nmol/L dG-dC标准溶液,加入15N3-dG-dC内标物。以dG-dC与15N3-dG-dC的浓度比为横坐标,dG-dC与15N3-dG-dC的峰面积比为纵坐标,绘制标准曲线。
1.4.6方法学验证 配制浓度分别为2、4、8、16 nmol/L dG-dC溶液,加入15N3-dG-dC内标物。在拟定的分析条件下,一天内进样测定6次,得到日内准确度和精密度;上述样品分别在3日内每天连续测定6次,得到日间准确度和精密度。
取200 μL 6 g/L小牛胸腺DNA溶液,分别加入标准品溶液,使空白DNA溶液中dG-dC的浓度分别为2、4、8、16 nmol/L,每个浓度条件下制备3个平行样品,并加入15N3-dG-dC内标物,然后进行酶解反应,并在拟定条件下对酶解液中的dG-dC进行定量分析,计算加标回收率。
取200 μL 6 g/L小牛胸腺DNA溶液,分别加入dG-dC标准品溶液,使空白DNA溶液中dG-dC浓度分别为0.2、4、32 nmol/L,每个浓度条件下制备3个平行样品,并加入15N3-dG-dC内标物,进行酶解反应后,对dG-dC进行定量分析。将上述样品于室温放置24 h,然后-20 ℃冻存1个月(其间反复冻融3次),测定样品中dG-dC的含量。比较新制备样品与经过放置后样品中dG-dC的含量,以判断方法的稳定性。将空白对照组细胞离心,按1.4.3方法进行DNA的提取,向得到的DNA中加入15N3-dG-dC内标物,按照1.4.4方法进行DNA酶解,在拟定的检测条件下进行定量分析,与药物处理组进行比较以判断方法的专属性。
1.4.7交联率的计算 根据公式计算交联率,以每109个碱基对中所含dG-dC交联的个数表示。其中,C为测得的dG-dC交联浓度(nmol/L);V为酶解后样品的体积(V=300 μL);C0为酶解前样品DNA的浓度;V0为酶解前样品的体积(V0=200 μL);M0为4种脱氧核苷酸的平均分子质量(M0=325 g/mol),示于式(1):
dG-dC crosslinks/109base pairs
= (C·V·109·2M0)/(C0·V0)
(1)
2 结果与讨论
2.1 方法学验证结果
dG-dC和15N3-dG-dC标准品的质谱图示于图2,分子离子丢失两侧核糖后,形成的碎片离子峰m/z289 (A)和m/z292 (B)均为基峰。采用SRM模式监测dG-dC的m/z521→m/z289和15N3-dG-dC的m/z524→m/z292离子通道,所得离子流图示于图3,其中,dG-dC和15N3-dG-dC的保留时间分别为15.48 min和15.47 min。线性相关系数R2为0.999 9,标准曲线示于图4。结果表明,在dG-dC浓度为0.08~60 nmol/L范围内,dG-dC和15N3-dG-dC的浓度比与SRM峰面积比的线性关系良好,方法的日内准确度和精密度分别为99.8%~104.1%和2.4%~4.8%,日间准确度和精密度分别为99.1%~103.9%和2.3%~3.7%,列于表1。向小牛胸腺DNA溶液中加入不同浓度dG-dC标准溶液,经酶解反应后,测定方法的加标回收率为92.5%~107.4%,列于表2。在拟定的分析条件下,S/N=5测得的dG-dC检测限(LOD)为2 fmol,S/N=17测得的dG-dC定量限(LOQ)为8 fmol。方法稳定性的测定结果列于表3,由表3可见,放置不同时间后,样品中dG-dC交联的浓度基本保持一致,表明dG-dC交联在样品溶液中稳定且不受贮存温度和时间的影响,说明该方法具有良好的稳定性。空白对照组和药物处理组细胞DNA中,dG-dC交联的SRM扫描离子流图示于图5。空白对照组中没有dG-dC交联,示于图5a;经药物处理后的细胞中有明显的dG-dC交联谱峰,示于图5b。该分析条件下,样品中未出现干扰dG-dC测定的内源性物质,方法专属性良好。结果表明,本方法的灵敏度、准确性、稳定性和专属性均能够满足细胞中DNA交联物的定量分析。
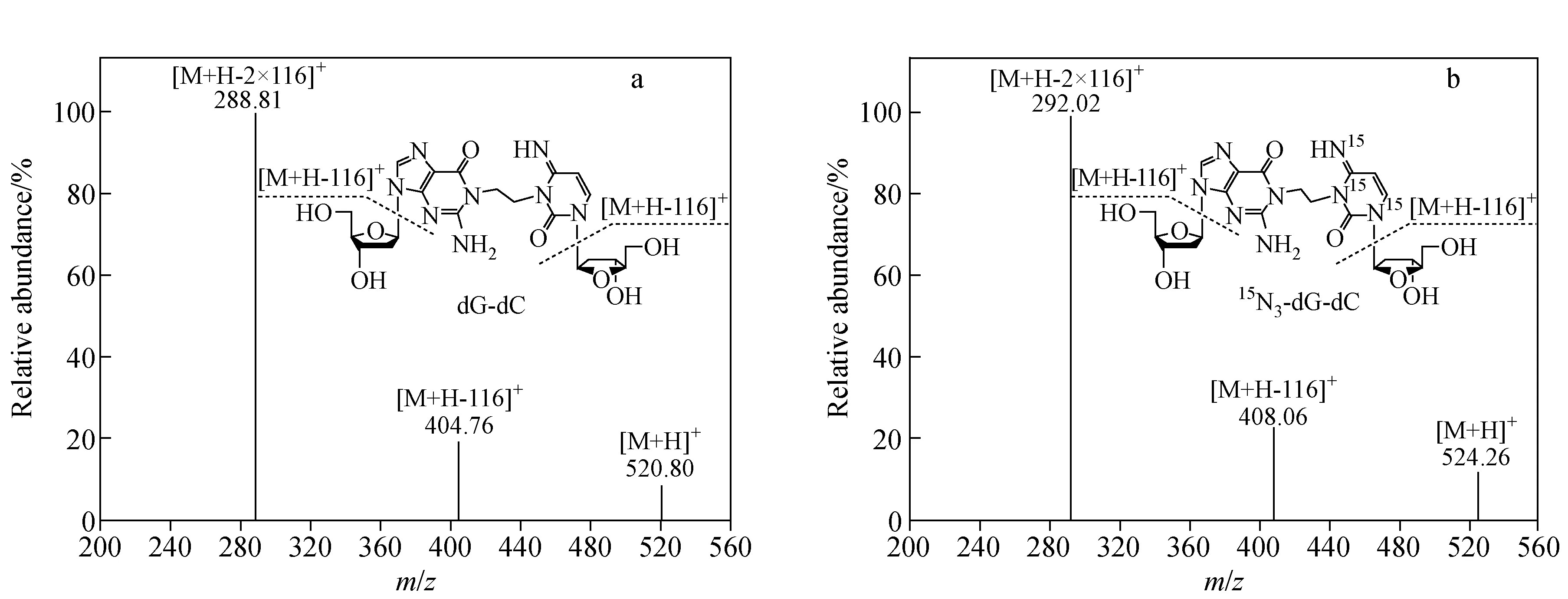
图2 dG-dC(a)和15N3-dG-dC(b)标准品的二级质谱全扫描谱图Fig.2 MS2 full scan spectra of dG-dC(a) and 15N3-dG-dC(b)
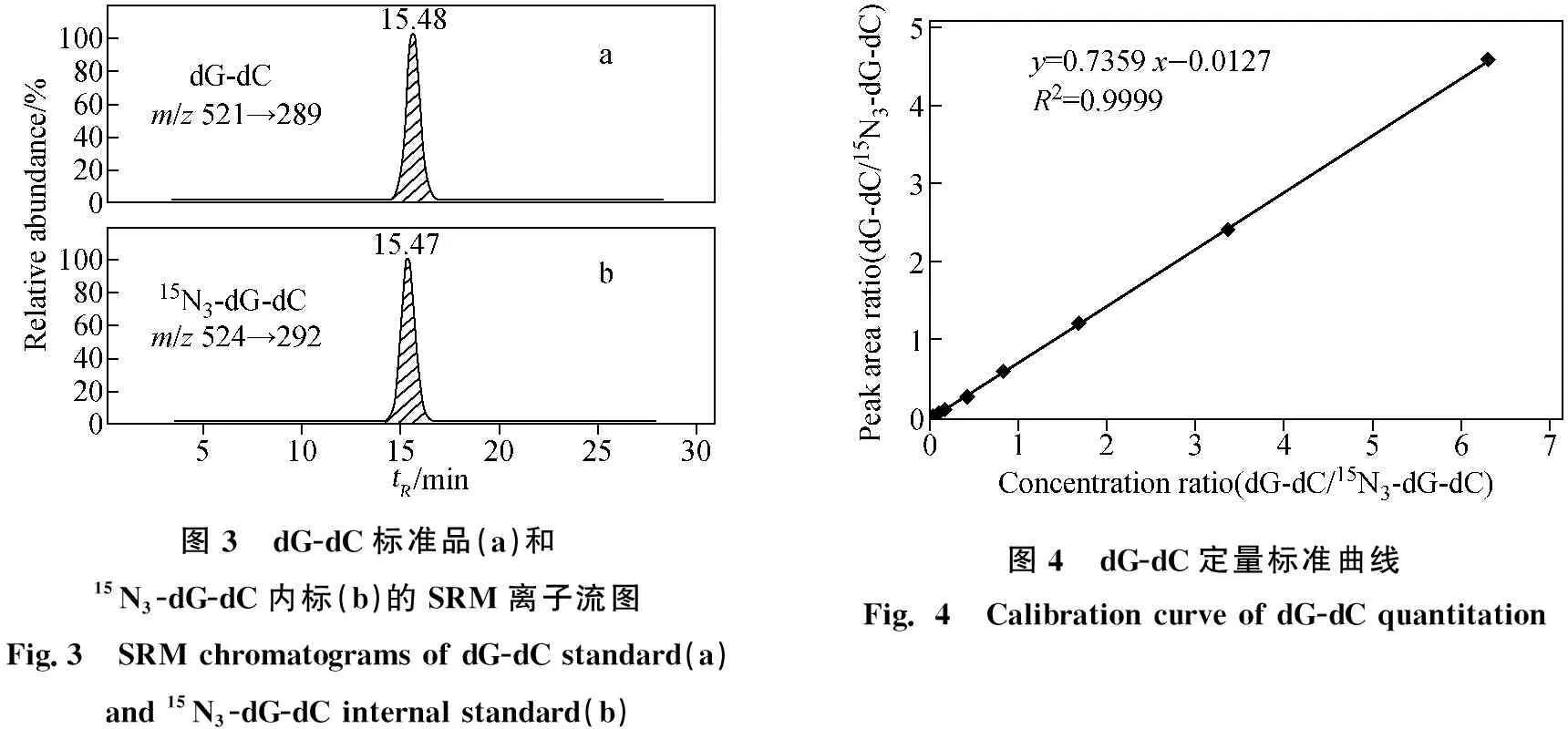
图3 dG-dC标准品(a)和15N3-dG-dC内标(b)的SRM离子流图Fig.3 SRM chromatograms of dG-dC standard(a) and 15N3-dG-dC internal standard(b)图4 dG-dC定量标准曲线Fig. 4 Calibration curve of dG-dC quantitation
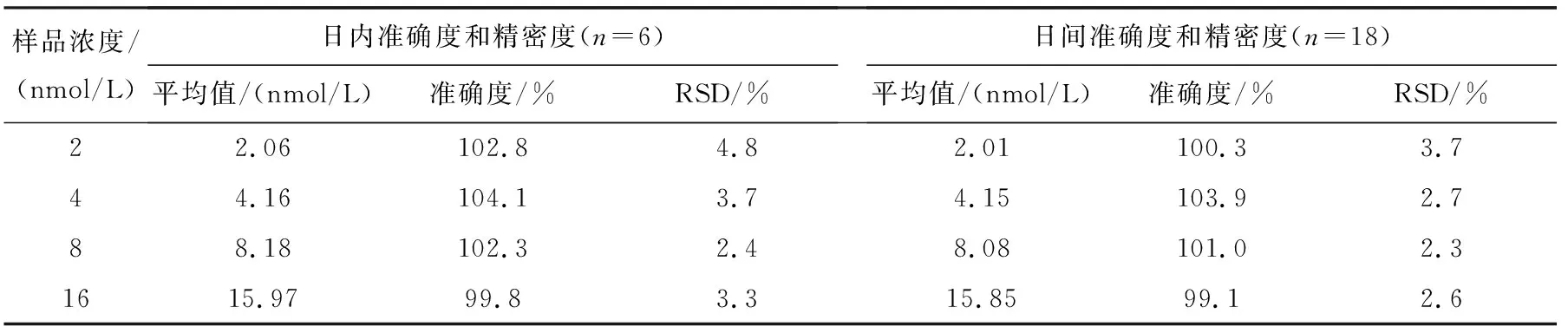
表1 dG-dC交联定量分析方法的准确度和精密度
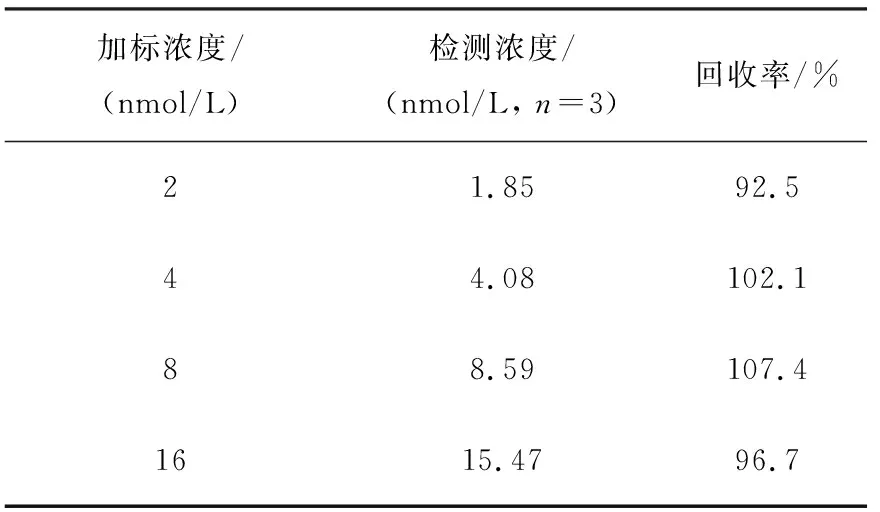
表2 小牛胸腺DNA酶解后样品中dG-dC交联的加标回收率Table 2 Recovery for dG-dC crosslinks in the enzymatic digestion mixtures of calf thymus DNA
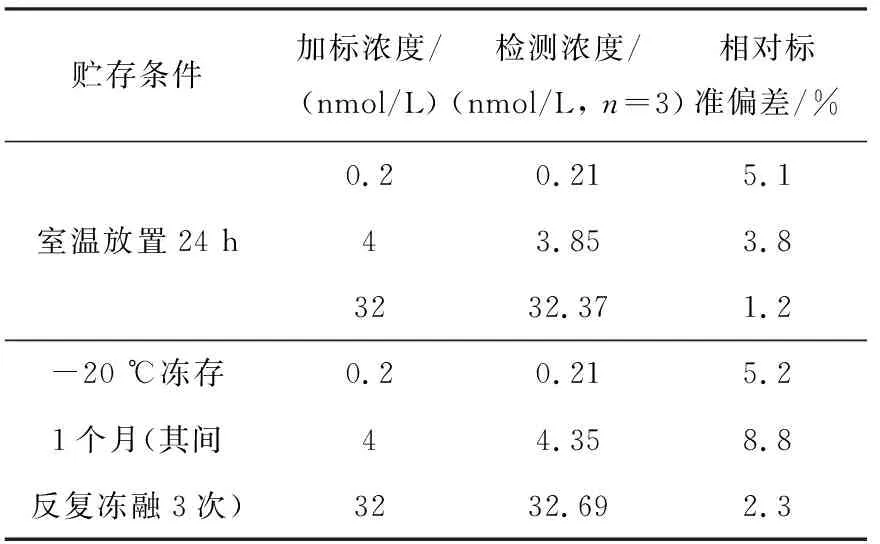
表3 小牛胸腺DNA酶解液中dG-dC交联物的稳定性Table 3 Stabilities for dG-dC crosslinks in the enzymatic digestion mixtures of calf thymus DNA
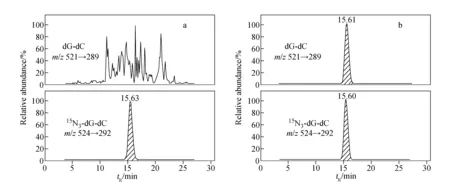
图5 空白对照(a)和经药物处理后细胞DNA样品(b)中dG-dC和15N3-dG-dC的SRM离子流图Fig.5 SRM chromatograms of dG-dC and 15N3-dG-dC for the control group(a) and the CENUs-treated group(b)
2.2 细胞中dG-dC交联物的测定
NIH/3T3和L1210细胞经不同浓度ACNU和BCNU处理6 h后,测得的dG-dC交联率列于表4。结果表明,使用相同浓度的同种药物分别处理2种细胞,L1210细胞中的dG-dC交联率明显高于NIH/3T3。AGT可对鸟嘌呤O6位的烷化损伤进行修复,进而阻碍dG-dC交联的形成。因此可以推测,癌细胞L1210中的AGT水平较低,使得dG-dC交联未能得到有效的修复,从而导致L1210细胞中DNA的交联率明显高于NIH/3T3细胞,这一推测与研究所观察到的现象符合。Ishiguro等[21]对能导致DNA股间交联的新型抗癌药物克罗拉滨(Cloretazine)进行研究,发现将编码AGT的O6-甲基鸟嘌呤-DNA-甲基转移酶(MGMT)基因导入L1210细胞后,AGT表达水平提高,药物的半抑制浓度(IC50)值显著增加。Tano等[22]发现经CENU处理后的NIH/3T3传代细胞中,AGT活性显著增加,细胞对CENU产生了耐药性。Preuss等[23]分别用ACNU、BCNU、CCNU和HeCNU(Elmustine, 依莫司汀)处理宫颈癌细胞Hela MR (AGT低表达)和HeLa S3 (AGT高表达),结果表明,4种CENUs对HeLa S3细胞的IC50均高于Hela MR细胞。
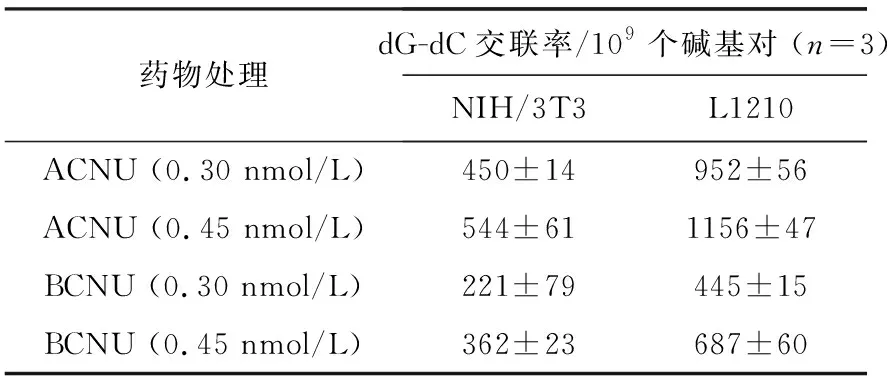
表4 经ACNU和BCNU处理后NIH/3T3和L1210细胞中的dG-dC交联水平Table 4 Levels of dG-dC crosslinks in NIH/3T3 and L1210 cells treated with ACNU and BCNU
两种细胞经ACNU处理后的dG-dC交联率均高于BCNU,尤其对于比较敏感的L1210细胞,ACNU的交联率显著高于BCNU。因此,推测ACNU对癌细胞的抑制效果高于BCNU,在临床上将表现出较好的肿瘤抑制效果。Wolff等[24]对CENUs的临床应用进行了流行病学研究,对使用ACNU、BCNU、CCNU和FTMS进行治疗后的24 193位晚期神经胶质瘤患者的寿命进行统计分析,结果表明,ACNU能够使患者寿命平均延长8.9个月,在4种药物的临床应用中表现出最佳的抗癌疗效,而BCNU未延长患者寿命。
3 结论
本研究建立了细胞中dG-dC股间交联物的HPLC-ESI-MS/MS定量分析方法,该方法具有良好的灵敏度和准确性,并对ACNU和BCNU两种CENUs药物导致HIN/3T3和L1210细胞中的dG-dC交联进行了测定。结果表明,AGT活性较低的L1210细胞中dG-dC交联率较高,而且ACNU的交联能力高于BCNU。本工作为双官能团亚硝基脲类烷化剂抗癌活性的预测和耐药性的研究提供了可靠的实验方法,为进一步设计和开发高效低毒的亚硝基脲类抗癌新药提供了依据。
参考文献:
[1] YAMAGUCHI T, KANEMITSU H, YAMAMO-TO S, et al. N,N'-bis(2-chloroethyl)-N-nitrosourea (BCNU)-induced apoptosis of neural progenitor cells in the developing fetal rat brain[J]. Toxicologic Pathology, 2010, 23(1): 25-30.
[2] BATISTA L F Z, ROOS W P, CHRISTMANN M, et al. Differential sensitivity of malignant glioma cells to methylating and chloroethylating anticancer drugs: p53 Determines the switch by regulating xpc, ddb2, and DNA double-strand breaks[J]. Cancer Research, 2007, 67(24): 11 886-11 895.
[3] FIUMICINO S, MARTINELLI S, COLUSSI C, et al. Sensitivity to DNA cross-linking chemotherapeutic agents in mismatch repair-defective cells in vitro and in xenografts[J]. International Journal of Cancer, 2000, 85(4): 590-596.
[4] CAO J, ZHAO L J, JIN S B, et al. Relationship between the molecular structure and the anticancer activity of N-(2-chloroethyl)-N’-cyclohexyl-N-nitrosoureas: A theoretical investigation[J]. International Journal of Quantum Chemistry, 2012, 112(3): 747-758.
[5] SHEWACH D S, KUCHTA R D. Introduction to cancer chemotherapeutics[J]. Chemical Review, 2009, 109(7): 2 859-2 861.
[6] STEWART B W, KLEIHUES P. World Cancer Report [M]. Lyon: IARC Press, 2003: 48-49.
[7] 郑长青, 季守平, 章扬培. DNA损伤修复与肿瘤烷化剂化疗[J]. 军事医学科学院院刊, 2009, 1(33): 77-80.
ZHENG Changqing, JI Shouping, ZHANG Yangpei. DNA repair and alkylating chemotherapeutic agents[J]. Bulletin of the Academy of Military Medical Sciences, 2009, 33(1): 77-80(in Chinese).
[8] ZHU R, LIU M C, LUO M Z, et al. 4-Nitrobenzyloxycarbonyl derivatives of O6-benzylguanine as hypoxia-activated prodrug inhibitors of O6-alkylguanine-DNA alkyltransferase (AGT), which produces resistance to agents targeting the O6position of DNA guanine[J]. Journal of Medicinal Chemistry, 2011, 54(21): 7 720-7 728.
[9] REESE J S, ROTH J C, GERSON S L. Bone marrow-derived cells exhibiting lung epithelial cell characteristics are enriched in vivo using methylguanine DNA methyltransferase-mediated drug resistance[J]. Stem Cells, 2008, 26(3): 675-681.
[10] UEDA-KAWAMITSU H, LAWSON T A, GW-ILT P R. In vitro pharmacokinetics and pharmacodynamics of 1,3-bis(2-chloroethyl)-1-nitrosourea (BCNU)[J]. Biochemical Pharmacology, 2002, 63(7): 1 209-1 218.
[11] TUBBS J L, PEGG A E, TAINER J A. DNA binding, nucleotide flipping, and the helix-turn-helix motif in base repair by O6-alkylguanine-DNA alkyltransferase and its implications for cancer chemotherapy[J]. DNA Repair, 2007, 6(8): 1 100-1 115.
[12] POLINA G, FAHMI H. Density functional theory study of the reaction mechanism of the DNA repairing enzyme alkylguanine alkyltransferase[J]. Chemical Physics Letters, 2008, 463(1/2/3): 214-218.
[13] KAINA B, MARGISON G P, CHRISTMANN M. Targeting O6-methylguanine-DNA methyltransferase with specific inhibitors as a strategy in cancer therapy[J]. Cellular and Molecular Life Sciences, 2010, 67(21): 3 663-3 681.
[14] DANIELS D S, WOO T T, LUU K X, et al. DNA binding and nucleotide flipping by the human DNA repair protein AGT[J]. Nature Structural Molecular Biology, 2004, 11(8): 714-720.
[15] 张俊杰, 张立坚, 刘春安, 等. 组织中全基因组DNA甲基化的液相色谱-串联质谱分析[J]. 质谱学报, 2010, 31(6): 326-330.
ZHANG Junjie, ZHANG Lijian, LIU Chunan, et al. Analysis of global DNA methylation in tissue by liquid chromatography-tandem mass spectrometry [J]. Journal of Chinese Mass Spectrometry Society, 2010, 31(6): 326-330(in Chinese).
[16] FISCHHABER P L, GALL A S, DUNCAN J A,et al. Direct demonstration in synthetic oligonucleotides that N,N-bis(2-chloroethyl)-nitrosourea cross-links N1of deoxyguanosine to N3of deoxycytidine on opposite strands of duplex DNA[J]. Cancer Research, 1999, 59(17): 4 363-4 368.
[17] RAHMAN K M, THOMPSON A S, JAMES C H, et al. The pyrrolobenzodiazepine dimer SJG-136 forms sequence-dependent intrastrand DNA cross-links and monoalkylated adducts in addition to interstrand cross-links[J]. Journal of the American Chemical Society, 2009, 131(88): 13 756-13 766.
[18] BASKERVILLE-ABRAHAM I M, BOYSEN G, TROUTMAN J M, et al. Development of an ultraperformance liquid chromatography/mass spectrometry method to quantify cisplatin 1,2 intrastrand guanine-guanine adducts[J]. Chemical Research in Toxicology, 2009, 22(5): 905-912.
[19] MALAYAPPAN B, JOHNSON L, NIE B, et al.
Quantitative high-performance liquid chromatography-electrospray ionization tandem mass spectrometry analysis of bis-N7-guanine DNA-DNA cross-links in white blood cells of cancer patients receiving cyclophosphamide therapy[J]. Analytical Chemistry, 2010, 82(9): 3 650-3 658.
[20] 白宝清, 赵丽娇, 宋秀庆, 等. 1-[N-(2-脱氧胞基)]2-[N-(2-脱氧鸟基)]乙烷的合成及其在DNA股间交联检测中的应用[J]. 合成化学, 2010, 18(3): 280-284.
BAI Baoqing, ZHAO Lijiao, SONG Xiuqing, et al. Synthesis of 1-[N-(2’-deoxycytidyl)]-2-[N-(2’-deoxyguanosyl)]ethane and its application in the detection of DNA interstrand crosslink[J]. Chinese Journal of Synthetic Chemistry, 2010, 18(3): 280-284(in Chinese).
[21] ISHIGURO K, SHYAM K, PENKETH P G, et al.
Mode of action of the chloroethylating and carbamoylating moieties of the prodrug cloretazine[J]. Molecular Cancer Therapeutics, 2006, 5(4): 967-976.
[22] TANO K, DUNN W C, DARROUDI F, et al. Amplification of the DNA repair gene O6-methylguanine-DNA methyltransferase associated with resistance to alkylating drugs in a mammalian cell line[J]. Journal of Biological Chemistry, 1997, 272: 13 250-13 254.
[23] PREUSS I, THUST R, KAINA B. Protective effect of O6-Methylguanine-DNA Methyltransferase (MGMT) on the cytotoxic and recombinogenic activity of different antineoplastic drugs[J]. International Journal of Cancer, 1996, 65(4): 506-512.
[24] WOLFF J E A, BERRAK S, WEBB S E K. Nitrosourea efficacy in high-grade glioma: A survival gain analysis summarizing 504 cohorts with 24 193 patients[J]. Journal of Neuro-Oncology, 2008, 88(1): 57-63.

