食品接触塑料容器中限用荧光增白剂184和393的迁移行为研究
冼燕萍,郭新东,穆同娜,董 浩,卢宇靖,吴玉銮,罗海英,罗东辉
(1. 广州质量监督检测研究院,广东 广州 510110;2. 北京市海淀区产品质量监督检验所,北京 100094;3.广东工业大学轻工化工学院,广东 广州 510006)
荧光增白剂(fluorescent whitening agents,FWA)常被用于塑料制品、纸张、涂料、洗涤用品和纺织品中,以提高基体的白度,保证基体的亮度[1]。自2011年媒体曝光爆米花桶含有荧光增白剂的事件后,人们对食品接触性制品的安全性问题的关注度不断提高。欧盟[2]、美国[3]和中国[4]都将荧光增白剂作为食品接触性塑料制品的添加剂(塑料着色剂)进行监管,制订了允许用于生产塑料食品接触材料和制品的添加剂清单,清单中规定了相关的限用量和/或特定迁移量,其中FWA184和FWA393的结构及相关性质列于表1。当食品接触塑料制品中的荧光增白剂在存储过程中迁移至食品时,会通过食物链进入人体,一旦荧光增白剂在人体内蓄积,就会存在削弱人体免疫力及伤口愈合能力、危害肝脏等风险,甚至有可能诱发细胞癌变[5]。因此,建立食品接触性塑料容器中限用荧光增白剂迁移量的检测方法,研究其迁移规律,可为保障相关食品接触性塑料制品的质量安全提供技术支持。
目前,关于荧光增白剂的检测方法主要有紫外灯照射观测法[6]、液相色谱法[5, 7-13]和液相色谱-串联三重四极杆质谱法(LC-MS/MS)[14-16]。紫外灯照射观测法只能定性检测荧光增白剂的总量,不能鉴别荧光增白剂的种类;液相色谱和液相色谱-串联三重四极杆质谱具有色谱的分离能力,可以定性定量测定荧光增白剂的种类,检测基质主要为食品接触塑料材料[7,15]、纸塑包装[8-9]、食品[10]、环境水、纸张和婴儿纺织品[14,16]等,但尚未见关于塑料制品中荧光增白剂的迁移检测报道。本研究根据欧盟法规对食品接触材料的前处理要求,以及基于FWA184和FWA393在GB 9685—2008中的特定迁移量(SML),考察了食品接触塑料容器中限用的双苯并噁唑类荧光增白剂FWA184和FWA393在分别代表水性、酸性、酒类与脂类的4种食品模拟物中的迁移特性。
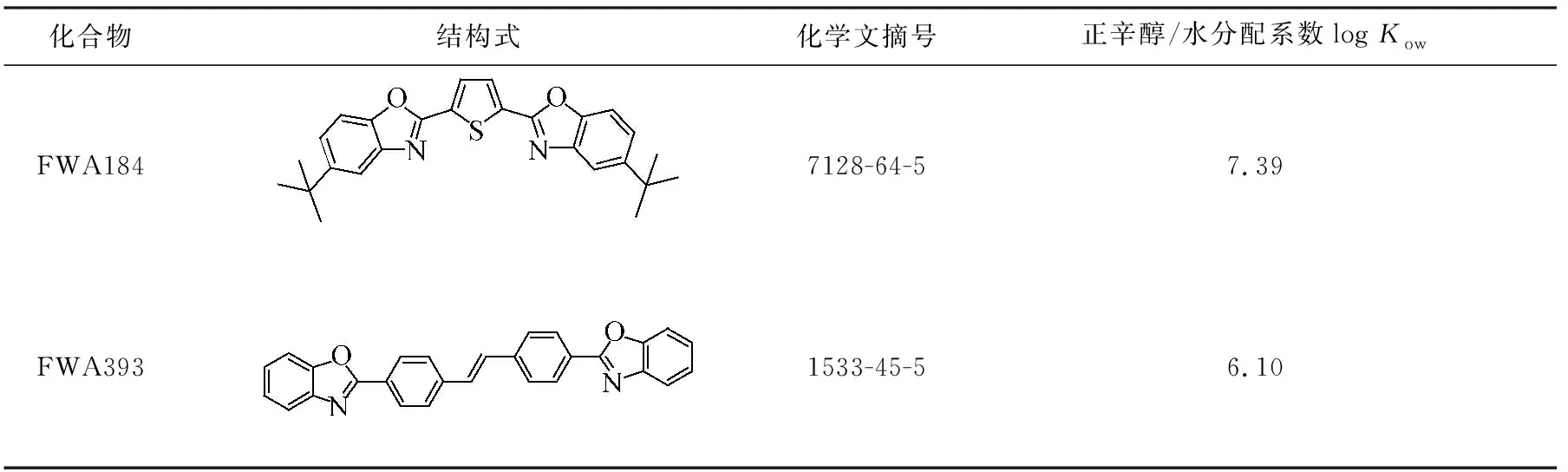
表1 FWA184和FWA393的分子结构式及其正辛醇/水分配系数(log Kow)
1 实验部分
1.1 主要仪器与装置
Qtrap 4000三重四极杆串联质谱仪:美国AB Sciex公司产品,配有电喷雾离子源(ESI);Shimadzu-20AT高效液相色谱仪:日本Shimadzu公司产品,配有二元高压泵、自动进样器、柱温箱;Milli-Q去离子水发生器:美国Millipore公司产品。
1.2 主要材料与试剂
FWA 184和FWA 393标准品:梯希爱(上海)化成工业发展有限公司产品;甲醇、乙酸、无水乙醇(均为色谱纯):美国J.T.Baker公司产品;实验用水为自制超纯水;20个塑料盒/杯样品(其中10个样品用于盛装低温冷藏食品,10个样品用于盛装常温贮存食品):购自广州食品包装生产企业。样品检测之前在恒温恒湿环境中静置24 h。
标准溶液的配制:准确称取各标准品,用三氯甲烷配成浓度为100 mg/L的单标标准贮备液,再用乙醇配成2种荧光增白剂的混合标准贮备液和所需浓度的标准工作液,于-20 ℃冰箱保存。
1.3 样品处理
参考文献[17-18],选取95%乙醇作为脂类食品模拟物,在恒温箱中进行样品灌注单面暴露的迁移实验。对于包装低温冷藏食品的塑料盒/杯,在5 ℃下迁移实验240 h;而包装常温贮存食品的塑料盒/杯,则在40 ℃下迁移实验240 h。浸泡液经0.22 μm滤膜过滤后,待LC-MS/MS测定。
1.4 实验条件
1.4.1 色谱条件 色谱柱:Phenomenex Kinetex C18柱(2.1 mm×100 mm×2.6 μm);流动相为甲醇(A)和0.1%甲酸水(B);梯度洗脱程序:0~4.0 min、60%~100%A,4.0~10.0 min、100%A,10.0~10.1 min、100%~60%A,10.1~14.0 min、60%A;流速0.4 mL/min;柱温40 ℃;进样量20 μL。
1.4.2 质谱条件 ESI+正模式,电离电压(IS)5 500 V,雾化气(GAS 1)压力3.79×105Pa,辅助加热气(GAS 2)压力3.79×105Pa,辅助加热气温度550 ℃,多反应监测(MRM)模式。2种荧光增白剂的质谱条件列于表2。

表2 2种待测物的质谱分析条件
注:*为定量离子
2 结果与讨论
2.1 LC-MS/MS条件的优化
2种目标物的结构中均含有叔氮原子,可在ESI+模式下产生较强的[M+H]+信号。经质谱优化获得化合物的分子离子和二级碎片离子,以及去簇电压、碰撞能量等质谱参数,使每种化合物的分子离子和特征碎片离子对的强度达到最大。
在ESI+模式下,流动相中加入甲酸可以提供电离所需的H+,以提高响应值。比较了在乙腈-0.1%甲酸水和甲醇-0.1%甲酸水流动相体系下2种目标化合物的色谱行为,发现采用甲醇为有机相时,2种目标化合物的检测灵敏度明显高于乙腈作为有机相,其中FWA184的响应值提高了30多倍。故本实验选择甲醇-0.1%甲酸水作为流动相,并对洗脱梯度进行了优化。在最初4 min,有机相从60%逐步升至100%,使极性大的干扰物先流出,以减少基质干扰,然后使2种化合物在100%有机相下流出,同时获得良好的分离效果,保持100%有机相至10 min,有利于充分洗脱残留在色谱柱上极性小的杂质,可延长色谱柱的使用寿命。在优化好的仪器条件下,2种荧光增白剂标准溶液(10 μg/L)的提取离子色谱图示于图1。以S/N=3考察FWA393和FWA184的仪器检出限(LOD),均为0.01 μg/L,表明经优化后,待测物可获得较低的检出限。

图1 2种荧光增白剂标准溶液(10 μg/L)MRM色谱图Fig.1 Selected ion chromatogramsof 2 fluorescent whitening agents standards (10 μg/L)
2.2 迁移条件的选择
根据文献[17-18],选择分别代表水性、酸性、酒类和脂类食品的模拟物蒸馏水、3%乙酸、10%乙醇和橄榄油进行迁移实验,对于脂类食品模拟物,也可以采用异辛烷、95%乙醇等作为替代试验用介质。由于本实验采用LC-MS/MS检测,待测物检出限低,基于SML值,迁移实验后的浸泡液可以直接检测,故根据仪器的适用性,以95%乙醇代替橄榄油作为脂类食品模拟物。此外,迁移行为的发生必须经过以下过程:迁移物质和模拟物冲破阻隔层接触;浓度差促使互溶的物质扩散、溶解、混匀[9]。所以,模拟物对迁移物质的溶解性是迁移发生的条件之一。在实验前期配制标准溶液时,发现FWA184可溶于甲醇、乙醇、95%乙醇和氯仿;FWA393难溶于甲醇、乙醇、95%乙醇等溶剂,可溶于氯仿;两者均不溶于蒸馏水、3%乙酸和10%乙醇。分别用4种选定的食品模拟物稀释标准工作液(浓度为10 μg/L),采用LC-MS/MS检测。实验发现:以水、3%乙酸和10%乙醇稀释的标准溶液响应值分别下降了约70%、70%和50%;以95%乙醇稀释的标准溶液响应值没有发生变化。这些现象都表明了由于两者的logKow较大,在水基模拟物中的溶解度很低,难以发生迁移行为。对后续的阳性样品进行迁移实验研究(2.4),在浸泡了240 h和480 h的这3种食品模拟物中也未检出2种待测物。综上,本实验选择95%乙醇作为迁移实验研究的模拟物。
选择最苛刻的迁移条件进行实验,鉴于所考察的样品为小体积的塑料容器,而且一般用于低温冷藏食品和常温储存食品,根据GB/T 23296.1—2009[17]规定的迁移实验条件,分别选择迁移温度为5 ℃和40 ℃,迁移时间均为240 h。针对样品与食品实际接触的情况,选择在恒温箱中进行样品灌注单面暴露的迁移实验。
2.3 方法学评价
2.3.1 专属性 对20个阴性样品按1.3进行迁移实验,检测浸泡液及其添加待测物的浸泡液。发现样液中的共存物质对待测物的定性确证无干扰,方法专属性强。
2.3.2 线性范围、检出限和定量限 应用1.4的条件检测0.03~20 μg/L浓度范围的系列混合标准溶液。以相应化合物的浓度为横坐标(x,μg/L),各化合物定量离子对的峰面积为纵坐标(y),作标准曲线;相关系数分别为0.999 6和0.999 2,线性关系良好。检出限为0.01 μg/L,以S/N=10计算FWA393和FWA184的定量限(LOQ),均为0.03 μg/L,可以满足SML的要求。
2.3.3 准确度和精密度 选取阴性样品分别于5 ℃和40 ℃条件下进行3个水平的添加回收率和精密度实验(n=6),结果列于表3。可见,添加回收率为91.1%~105.3%,相对标准偏差(RSD)在2.7%~6.4%之间。该方法具有较高的回收率,良好的准确度和精密度。
2.4 迁移规律的研究
选取一个阳性的长方形塑料盒(其中FWA393含量为63 mg/kg,FWA184含量为4.5 mg/kg)为试样进行迁移规律研究,试样的浸泡面积约为1.95 dm2,所添加的模拟物体积为225 mL。本实验主要考察FWA393和FWA184在脂类食品模拟物中的迁移规律,并验证FWA393和FWA184在3种水基食品模拟物中难以发生迁移的理论观点,因此将4种食品模拟物分别在5 ℃和40 ℃条件下进行0~480 h的迁移实验研究,其中3种水基食品模拟物只在浸泡240 h和480 h后取样检测,而脂类食品模拟物则每隔24 h取0.2 mL样液进行检测分析。3种水基食品模拟物中均未检出2种目标物。在脂类食品模拟物中,FWA393和FWA184在不同温度和时间的迁移百分率示于图2。结果显示:在95%乙醇浸泡条件下,FWA393和FWA184在不同温度下的迁移率随着迁移时间的增加而增加;在前96 h迁移速率较快,在96~216 h迁移缓慢,随后趋于平稳;24 h后,FWA393和FWA184在40 ℃条件下的迁移率明显高于5 ℃的。对图2各数据点进行拟合,分别得到FWA393和FWA184在5 ℃和40 ℃条件下随迁移时间变化的迁移曲线方程,相关系数在0.981 7~0.997 3之间,列于表4。
实验表明,使用含有FWA393和FWA184的食品接触塑料容器盛装脂肪类食品存在荧光增白剂物质迁移至食品的情况,迁移量及危害风险与塑料容器中荧光增白剂的含量、储存温度和时间有关。

表3 2种目标物的添加回收率和精密度(n=6)

图2 迁移温度和迁移时间与FWA393(a)和FWA184(b)迁移率的关系Fig.2 The relationship of migration temperature and migration time vs FWA393(a) and FWA184(b) migration rate
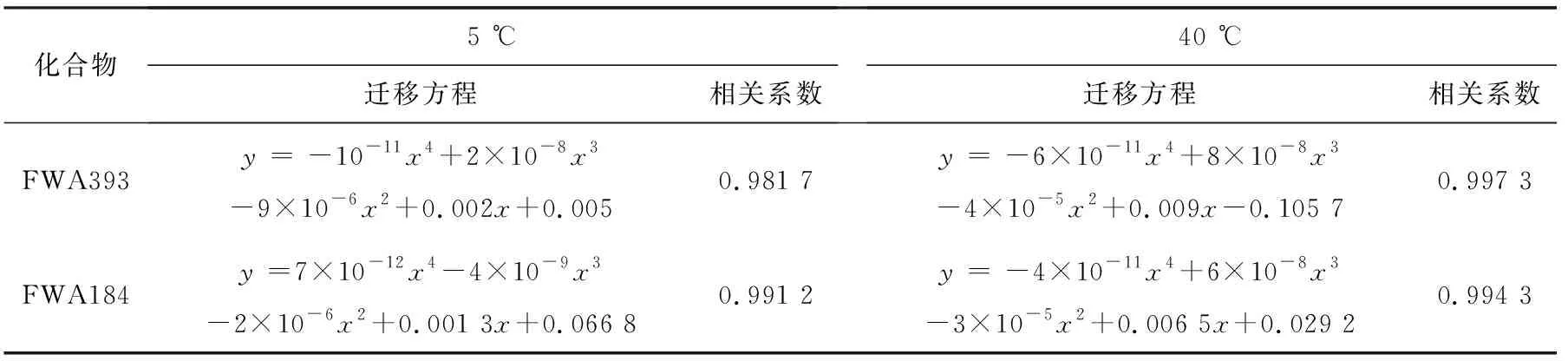
化合物5 ℃迁移方程相关系数40 ℃迁移方程相关系数FWA393y = -10-11x4 +2×10-8x3 -9×10-6x2+0.002x+0.0050.981 7 y = -6×10-11x4 +8×10-8x3 -4×10-5x2+0.009x-0.105 70.997 3FWA184y =7×10-12x4-4×10-9x3-2×10-6x2+0.001 3x+0.066 80.991 2 y = -4×10-11x4+6×10-8x3-3×10-5x2+0.006 5x+0.029 20.994 3
2.5 实际样品的检测
根据20个塑料杯/盒样品的用途,使用本方法分别在5 ℃和40 ℃条件下测定各样品中荧光增白剂的迁移值。仅有1个用于常温盛装和贮存食品的样品的脂类食品模拟物浸泡液中检出含有FWA184,其提取离子色谱图示于图3,迁移量为0.05 μg/L,折算成特定迁移量为2.1×10-4mg/kg,未超过限量要求(0.6 mg/kg)[4];其余19个样品的浸泡液中均未检出2种待测化合物。
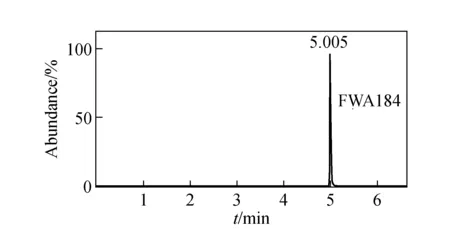
图3 阳性样品的提取离子色谱图Fig.3 Selected ion chromatograms of positive sample
3 结论
本研究建立了食品接触塑料容器中限用荧光增白剂184和393迁移量的液相色谱-串联三重四极杆质谱测定方法,初步探讨了FWA184和FWA393在5 ℃和40 ℃条件下采用脂类食品模拟物(95%乙醇)进行浸泡实验的迁移行为,并建立了迁移曲线方程。结果表明:添加了荧光增白剂的食品接触塑料容器对内装物有一定的影响;包装脂肪类食品时存在一定的安全风险,储存温度较高和延长保存时间会增加FWA184和FWA393的迁移量,从而对内装食品造成更大的污染;包装水性、酸性和酒精度较低的食品时安全性相对较高。
[1] 董仲生. 荧光增白剂的应用和使用安全性[J]. 中国洗涤用品工业, 2011, 128(4):31-39. DONG Zhongshen. Application and use security of Fluorescent whitening agents[J]. China Surfactant Soap and Detergent Industries, 2011, 128(4):31-39(in Chinese).
[2] European Commission Directive 2002/72/EC, Relating to plastic materials and articles intended to come into contact with foodstuffs. Official Journal of the European Communities, 2002, L 220/18-L 220/58.
[3] Code of Federal Regulations. Sec. 178.3297 Colorants for polymers[EB/OL]. http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfmfr=178.3297.
[4] GB 9685—2008 食品容器、包装材料用添加剂使用卫生标准 [S]. 北京:中国标准出版社,2008.
[5] 焦艳娜, 丁 利, 朱绍华, 等. 高效液相色谱-荧光检测法测定食品接触材料塑料制品中荧光增白剂[J]. 色谱, 2013, 31(1): 83-87. JIAO Yanna, DING Li, ZHU Shaohua, et al. Determination of fluorescent whitening agents in plastic food contact materials by high performance liquid chromatography with fluorescence detector[J]. Chinese Journal of Chromatography, 2013, 31(1): 83-87(in Chinese).
[6] GB/T 5009.78—2003 食品包装用原纸卫生标准的分析方法 [S]. 北京:中国标准出版社,2008.
[7] 吴钟玲, 陈树东, 林晓佳, 等. 高效液相色谱法测定食品接触聚苯乙烯制品中9种荧光增白剂[J]. 现代食品科技, 2013, 29(11): 2 757-2 761. WU Zhonglin, CHEN Shudong, LIN Xiaojia, et al. Determination of nine Fluorescent whitening agents in polystyrene food contact material by high performance liquid chromatography[J]. Modern Food Science and Technology, 2013, 29 (11): 2 757-2 761(in Chinese).
[8] 邓凯芬, 任佳丽, 彭湘莲, 等. ASE-HPLC测定纸塑包装中荧光增白剂VBL[J]. 食品与机械, 2012, 28(3): 96-100. DENG Kaifen, REN Jiali, PENG Xianglian, et al. Determination of fluorescent whitening agents VBL in food paper-plastic packaging materials using accelerated solvent extraction/high-performance liquid chromatography[J]. Food & Machinery, 2012, 28(3): 96-100(in Chinese).
[9] 邓凯芬. 食品纸塑包装中荧光增白剂的检测及迁移研究[D]. 长沙:中南林业科技大学, 2012.
[10] 练习中, 陈梅斯, 郑丽斯, 等. 高效液相色谱法测定食品中荧光增白剂[J]. 现代食品科技, 2011, 27 (10): 1 281-1 284. LIAN Xizhong, CHEN Meisi, ZHENG Lisi, et al. Determination of fluorescent whitening agents in food by HPLC[J]. Modern Food Science and Technology, 2011, 27 (10): 1 281-1 284(in Chinese).
[11] 冼燕萍, 郭新东, 罗海英, 等. 固相萃取-超高效液相色谱分离测定洗涤用品中4 种荧光增白剂[J]. 色谱, 2013, 31(2):162-169. XIAN Yanping, GUO Xindong, LUO Haiying, et al. Determination of four fluorescent whitening agents in laundry detergents by solid phase extraction combined with ultra-high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2013, 31(2): 162-169(in Chinese).
[12] SHU W C, DING W H. Determination of fluorescent whitening agents in laundry detergents and surface waters by solid-phase extraction and ion-pair high-performance liquid chromatography[J]. J Chromatogr A, 2005, 1 088(1/2): 218-223.
[13] SHU W C, DING W H. Determination of fluorescent whitening agents in infant clothes and paper materials by ion-pair chromatography and fluorescence detection[J]. Journal of the Chinese Chemical Society, 2009, 56(4): 797-803.
[14] CHEN H C, WANG S P, DING W H. Determination of fluorescent whitening agents in environmental waters by solid-phase extraction and ion pair liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2006, 1 102(1/2): 135-142.
[15] GUO X D, XIAN Y P, LUO H Y, et al. Quantitative determinations of seven fluorescent whitening agents in polystyrene and polyvinyl chloride plastics by ultrahigh performance liquid chromatography-tandem mass spectrometry[J]. Anal Methods, 2013, (5): 6 086-6 093.
[16] SANTOS M, NER′IN C, BATLLE R. The an- alysis of fluorescent whitening agents using reversed-phase HPLC and mass spectrometry[J]. Lcgc North America, 2004, 22: 550-560.
[17] GB/T 23296.1—2009 食品接触材料 塑料中受限物质 塑料中物质向食品及食品模拟物特定迁移试验和含量测定方法以及食品模拟物暴露条件选择的指南 [S]. 北京:中国标准出版社,2009.
[18] EN 13130-1:2004, Materials and articles in contact with foodstruffs-plastics substances subject to limitation-Part 1: Guide to test methods for the specific migration of substances from plastics to foods and food simulants and the determination of substances in plastics and the selection of conditions of exposure to food simulants [S]. Britsh: The Standard Policy and Strategy Committee, 2004.

