RRLC-Q-TOF-MS法研究人参皂苷Rh1对映异构体在大鼠体内的药代动力学行为
李春梅,于 擎,孙 乐,吴 巍,郭迎迎,刘淑莹,3
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117; 2. 温州医科大学药学院,浙江 温州 325035;3.中国科学院长春应用化学研究所,长春质谱中心,吉林 长春 130022)
人参(PanaxginsengC.A.Meyer)属于五加科人参属,是名贵中药,其用药已有两千多年的历史[1]。人参的主要有效成分是人参皂苷类化合物,具有广泛的药理活性[2-3]。红参是人参药材的常用炮制产品,研究表明,红参中除含有与白参中一样的人参皂苷外(人参皂苷Rb1、Rb2、Rc、Rd、Re、Rf、Rg1、Rg2、Rg3、Rh1),还含有人参皂苷Rh2和Rg3等稀有皂苷[4]。另外,由于人参皂苷存在一个20位手性碳原子,所以20位取代糖基在化学水解过程中,水分子可以从两个方向同时进攻20位碳原子,形成20-(R)人参皂苷Rh1、Rg3、Rg2等[5]。其中,人参皂苷Rh1是一种重要的稀有皂苷,主要作用于动物的神经系统[6-8],具有神经保护、抗脑缺血、抗软骨退变、抗肿瘤、抗过敏和抗炎活性等作用[9-10],有望成为痴呆综合症、贫血、骨关节炎和白内障的治疗药物。
在红参提取物中,人参皂苷Rh1是由20-(S)和20-(R)型人参皂苷Rh1组成的混旋体[11]。人们对消旋体药物非常重视,这是因为相对于非对映异构体药物,对映异构体药物在生物体内会更多地受到酶等同样带有立体化学特征的生物大分子的影响,对映异构体药物之间的药效学和药代动力学差异十分明显[12]。Gui等[13]利用HPLC方法同时研究了20-(S)和20-(R)人参皂苷Rg2对映异构体在大鼠体内的药代动力学行为;也有文献报道了20-(S)-Rh1在大鼠体内的药代动力学特征及其苷元的检测[14];但目前尚未见关于20-(S)和20-(R)型人参皂苷Rh1混旋体的药代动力学特征的报道。因此,同时分析检测人参皂苷Rh1对映异构体及探索其药代动力学和药效学特征对于人参的应用是十分重要的。
液相色谱-质谱联用技术已成为分析人参皂苷代谢及药代动力学特征的有效方法[15-20]。本工作采用高分离快速液相色谱-四极杆-飞行时间质谱(RRLC-Q-TOF-MS)技术,选择适当的流动相,通过高效快速分离,建立人参皂苷Rh1对映异构体的分离分析方法;并利用此方法对人参皂苷Rh1对映异构体在大鼠体内的药代动力学进行研究,比较20-(S)和20-(R)型人参皂苷Rh1在大鼠体内的代谢差异。
1 实验部分
1.1 仪器与试剂
Agilent RRLC 1200 SL-6520 Q-TOF-MS液质联用系统:美国Agilent公司产品,其中RRLC 1200 SL配有在线脱气机、二元梯度泵、可控温自动进样系统和智能柱温箱,Q-TOF-MS配有双喷雾电离源;离心机:德国Eppendorf公司产品。
20-(S)和20-(R)人参皂苷Rh1及人参皂苷Rf(内标):南京泽朗医药科技有限公司产品,纯度为98%,人参皂苷Rh1的化学结构式示于图1;乙腈和甲醇(色谱纯):美国Tedia公司产品;丙二醇和聚乙二醇(分析纯):北京化工厂产品;甲酸铵:美国Sigma公司产品;水由Milli-Q超纯水系统制得;其他试剂均为分析纯。

图1 20-(S)人参皂苷Rh1(a)和20-(R)人参皂苷Rh1(b)的化学结构式Fig.1 The chemical structures of 20-(S)-Rh1(a) and 20-(R)-Rh1(b)
1.2 实验条件
1.2.1 色谱条件 Agilent SB C18色谱柱(2.1 mm×100 mm×1.8 μm),柱温30 ℃;流动相:A为水-乙腈(90∶10,V∶V)溶液,B为水-乙腈(10∶90,V∶V)溶液,均内含15 mmol/L甲酸铵;二元线性梯度洗脱:0~15 min、24%B,15~16 min、24%~100% B,16~20 min、100%B;流速0.3 mL/min;进样量5 μL。
1.2.2 质谱条件 电喷雾负离子模式,干燥气温度350 ℃,干燥气流速4 L/min,雾化气压力255 kPa,传输毛细管电压3 500 V,碎裂器电压200 V,锥孔电压65 V。一级质谱采样频率为2 s。实验数据采用Agilent MassHunter Qualitative Analysis(B. 03.01)软件分析。
1.3 溶液配制及样品处理
1.3.1 标准溶液的配制 以甲醇为溶剂,将20-(S)人参皂苷Rh1、20-(R)人参皂苷Rh1和人参皂苷Rf(内标)分别配制成195、39、40 mg/L的标准品母液,于4 ℃冷藏备用,实验时用甲醇稀释。分别将100 μL 20-(S)、20-(R)人参皂苷Rh1标准溶液和100 μL内标储备液加入到100 μL空白大鼠血浆中,混匀;再加入200 μL甲醇,涡旋1 min,以3 000 r/min离心5 min,取上清液,配制成浓度为39.00、3.90、1.95、0.98、0.49、0.24 mg/L的20-(S)人参皂苷Rh1和7.80、0.98、0.49、0.24、0.12、0.06、0.035 mg/L的20-(R)人参皂苷Rh1的血浆标准溶液。
1.3.2 供试品溶液的制备 将20-(S)和20-(R)人参皂苷Rh1溶于生理盐水中,给药量为25 mg/kg,对应于20-(S)人参皂苷Rh1为23 mg/kg,20-(R)人参皂苷Rh1为2 mg/kg。
1.3.3 动物实验 选取6只Wister大鼠(体重(200 ± 10) g,雄性,购自吉林大学),实验前12 h禁食不禁水。分别注射23 mg/kg和2 mg/kg 20-(S)和20-(R)人参皂苷Rh1混合样品,在注射后1、3、5、10、20、30、40、60 min的时间点通过目内眦取血,每个时间点取0.5 mL血。血样自然冷却后,以3 000 r/min离心5 min。取100 μL血浆,加入100 μL内标储备液和300 μL甲醇,离心后取上清液,装入样品瓶中,待测。
2 结果与讨论
2.1 色谱和质谱条件
由于对映异构体的极性相近,所以一般情况下不能用常规的液相色谱柱进行分离。为了获得人参皂苷Rh1对映异构体的基线分离,本工作使用常规的Agilent SB C18色谱柱,以甲酸铵作为流动相添加剂,同时添加到水相和有机相中,成功地分离了人参皂苷Rh1的对映异构体。实验发现,甲酸铵浓度对分离有着较大的影响,随着甲酸铵浓度的增加,流动相的pH值下降,同时20-(S)和20-(R)人参皂苷Rh1的分离度不断上升。结果表明,甲酸铵浓度为15 mmol/L时,人参皂苷Rh1对映异构体获得了基线分离,达到了很好的分离度,20-(S)和20-(R)人参皂苷Rh1分离的保留时间分别为9.49 min和10.72 min。
20-(S)和20-(R)人参皂苷Rh1在质谱的正离子模式和负离子模式下均可检测到,其质谱图示于图2。由图2a可见,在正离子模式下,一级质谱图中生成的人参皂苷碎片离子种类较多,包括[M+H-Glc-2H2O]+、[M+H-H2O]+和[M+H-2H2O]+,其中[M+H-Glc-2H2O]+是最稳定且丰度最高的离子,通过调节质谱碎裂电压不但不能减弱脱水反应,反而会降低仪器的灵敏度。由图2b可见,在负离子模式下,人参皂苷Rh1产生离子的类型比较简单,在一级质谱图中,产生[M-H]-和[M+HCOO]-离子,其中 [M+HCOO]-离子是基峰,其丰度远高于[M-H]-离子,所以本工作采用负离子模式进行分析。
2.2 方法学确证
2.2.1 选择性 空白血浆和使用标准加入法加入了20-(R,S)人参皂苷Rh1混旋体和内标的血浆样品的总离子流图示于图3。由图3可见,人参皂苷Rh1对映异构体获得了基线分离,且在2个色谱峰之间没有任何基质干扰峰存在,表明此方法具有良好的选择性。
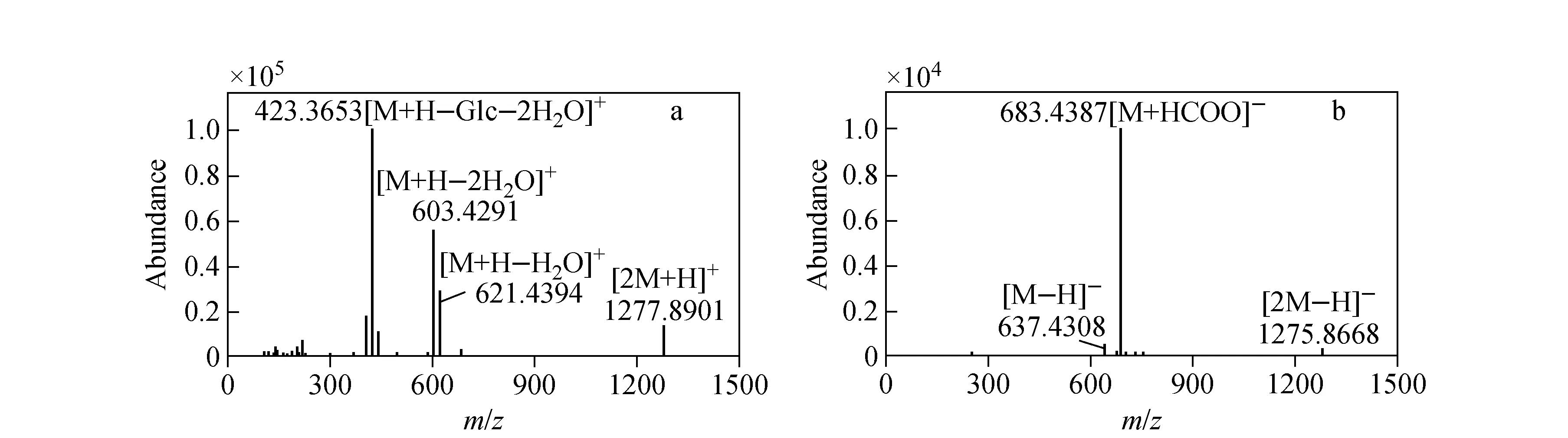
图2 人参皂苷Rh1在正离子模式下(a)和负离子模式下(b)的一级质谱图Fig.2 The full-scan mass spectrum of ginsenoside Rh1 in positive ion mode(a) and in negative ion mode(b)

图3 空白血浆(a),加入20-(R, S)人参皂苷Rh1和内标(b)的总离子流图Fig.3 The total ion chromatogram of blank plasma(a), the plasma added 20-(R, S)ginsenoside Rh1 and internal standard(b)
2.2.2 线性关系考察 以血浆中20-(S)和20-(R)人参皂苷Rh1的浓度为横坐标,20-(S)和20-(R)人参皂苷Rh1与人参皂苷Rf(内标)的面积比为纵坐标,通过最小二乘线性回归法得到标准曲线,列于表1。结果表明,20-(S)和20-(R)人参皂苷Rh1具有良好的线性关系,定量限分别为0.20 mg/L和0.03 mg/L。
2.2.3 精确度与精密度 按1.3.1方法制备高、中、低3个浓度的质量控制样品,每个浓度制备5个样本,连续测定3天。20-(S)人参皂苷Rh1浓度为39.00、1.95和0.24 mg/L;20-(R)人参皂苷Rh1浓度为7.80、0.49和0.035 mg/L。质量控制样品的日内和日间精密度列于表2。两者的日内精密度分别为89.54%~95.79% 和88.76%~94.33%;日间精密度分别为88.16%~92.41%和88.49%~94.35%;RSD值均小于5%。结果表明,该方法具有较好的精确度与精密度。
2.2.4 提取回收率 分别取高、中、低3个浓度20-(S)和20-(R)人参皂苷Rh1的质量控制样品,加入到空白血浆中,经沉淀蛋白等处理后,测其峰面积。以此峰面积与空白血浆处理后加入相同量的20-(S)和20-(R)人参皂苷Rh1所测得的峰面积比值来考察样品的提取回收率。结果表明,提取回收率的范围可以满足20-(S)和20-(R)人参皂苷Rh1的测定要求,相对标准偏差小于5%,结果列于表3。
2.2.5 稳定性实验 考察了高、中、低3个浓度的质量控制样本的稳定性,结果显示,待测物连续3天在3个冷冻(-20 ℃)—解冻循环(室温)中稳定,提取后的样品溶液在室温下放置24 h稳定。

表1 大鼠血浆中20-(S)和20-(R)人参皂苷Rh1的标准曲线,相关系数和线性范围

表2 质量控制样品的日内和日间精密度(n=5)

表3 大鼠血浆中20-(S)和20-(R)人参皂苷Rh1的提取回收率(n=3)
2.3 方法学应用
利用所建立的方法研究大鼠血浆中的20-(S)和20-(R)人参皂苷Rh1的药代动力学行为。静脉注射后,6只大鼠的平均血液药物浓度-时间曲线示于图4。通过赤池信息标准(AIC)进行房室模型分析表明,20-(S)人参皂苷Rh1图形符合二室模型特征,而20-(R)人参皂苷Rh1符合一室模型特征。20-(S)人参皂苷Rh1血药浓度半衰期的α相(t1/2α)和β相(t1/2β)分别为1.74±0.064和15.19±0.65,而20-(R)人参皂苷Rh1血药浓度半衰期为6.10±0.16,其主要药代动力学参数列于表4。实验结果表明,人参皂苷对映异构体之间的代谢差异较大,20-(S)人参皂苷Rh1的清除速率大于20-(R)人参皂苷Rh1,这为临床应用20-(R,S)人参皂苷Rh1对映异构体提供了理论依据。

图4 尾静脉注射20-(S)-Rh1和20-(R)-Rh1后,6只大鼠的平均血液药物浓度-时间曲线(n=6)Fig.4 The average blood drug concentration-time curve of 6 rats after intravenous injection of 20-(S)-Rh1 and 20-(R)-Rh1(n=6)

化合物名称参数单位测定值C0mg/L39.53±0.30t1/2αmin1.74±0.064t1/2βmin15.19±0.65Ke1/h0.24±0.01120-(S)人参皂苷Rh1k121/h0.13±0.022k211/h0.076±0.003 3AUC(mg·min)/L164.75±12.55VcmL0.58±0.042CLmL/h0.11±0.009 8t1/2min6.10±0.16AUC(mg·min)/L37.46±2.2120-(R)人参皂苷Rh1C0mg/L4.25±0.098Ke1/h0.11±0.005 3VdmL0.47±0.004 4CLmL/h0.053±0.002 8
3 结论
本工作建立了一种快速、简单且重复性好的,使用常规Agilent SB C18色谱柱同时定性定量分析20-(S)和20-(R)人参皂苷Rh1对映异构体的RRLC-Q-TOF-MS方法。流动相的改进是此方法的关键,15 mmol/L甲酸铵在有效提高柱效和分离度的同时,流动相的pH值也不超出色谱柱的承受范围。质谱检测采用负离子模式进行分析,20-(S)和20-(R)人参皂苷Rh1的定量范围分别为39.00~0.24 mg/L和7.80~0.035 mg/L。2个对映异构体的日内和日间稳定性均能满足药代动力学研究的要求。该方法能够同时测定在尾静脉注射20-(S)和20-(R)人参皂苷Rh1后血浆中的浓度,从而进行药代动力学研究,可为今后20-(R,S)人参皂苷Rh1的临床应用提供科学依据。
[1] LIU C X, XIAO P G. Recent advances on ginseng research in China [J]. J Ethnopharmaco, 1992, 36(1): 27-38.
[2] 黎 阳,张铁军,刘素香,等. 人参化学成分和药理研究进展[J].中草药,2009,40(1):164. LI Yang, ZHANG Tiejun, LIU Suxiang, et al. Research progress on chemical constituents and pharmacological activities ofPanaxginseng[J]. Chinese Herbal Medicine, 2009, 40(1): 164(in Chinese).
[3] FUZZATI N. Analysis methods ofginsenoside[J]. J Chromatogr B, 2004, 812(1/2): 119-133.
[4] HA Y W, LIM S S, HA I J, et al. Preparative isolation of fourginsenosidefrom Koren red ginseng (steam-treatedPanaxginsengC. A. Meyer), by high-speed counter-current chromatography coupled with evaporative light scattering detection [J]. J Chromatogr A, 2007, 1 151(1): 37-44.
[5] ZHANG X, SONG F R, CUI M, et al. Investigation of the hydrolysis ofginsenosideby high performance liquid chromatograph-electrospray ionization mass spectrometry [J]. Planta Med, 2007, 73(11): 1 225-1 229.
[6] JUNG J S, SHIN J A, PARK E M, et al. Anti-inflammatory mechanism ofginsenosideRh1 in lipopolysaccharide-stimulated microglia: Critical role of the protein kinase A pathway and hemeoxygenase-1 expression [J]. J Neurochem, 2010, 115(6): 1 668-1 680.
[7] JUNG J S, KIM D H, KIM H S.GinsenosideRh1 suppresses inducible nitric oxide synthase gene expression in IFN-γ-stimulated microglia via modulation of JAK/STAT and ERK signaling pathways[J]. Biochemical and Biophysical Research Communications, 2010, 397(2): 323-328.
[8] YOON J H, CHOI Y J, LEE S G.GinsenosideRh1 suppresses matrix metalloproteinase-1 expression through inhibition of activator protein-1 and mitogen-activated protein kinase signaling pathway in human hepatocellular carcinoma cells [J]. Eur J Pharmacol, 2012, 679(1/2/3): 24-33.
[9] CHOI Y J, YOON J H, CHA S W, et al.GinsenosideRh1 inhibits the invasion and migration of THP-1 acute monocytic leukemia cells via inactivation of the MAPK signaling pathway [J]. Fitoterapia, 2011, 82(6): 911-919.
[10] ZHENG H, JEONG Y, SONG J, et al. Oral administration ofginsenosideRh1 inhibits the development of atopic dermatitis-like skin lesions induced by oxazolone in hairless mice [J]. Int Immunopharmacology, 2011, 11(4): 511-518.
[11] YU Q, YU B B, LIU S Y. Silver(Ι)-assisted enantiomeric analysis ofginsenosideusing electrospray ionization tandem mass spectrometry [J]. Mass Spectrom, 2012, 47(10): 1 313-1 321.
[12] GUI F J, YANG X W, LI L Y, et al. Simultaneous enantiomer determination of 20 (R)- and 20 (S)-ginsenoside-Rg2 in rat plasma after intravenous administration using HPLC method [J]. Journal of Chromatography B, 2007, 850(1): 1-6.
[13] LAI L, LIU Y T, HAO H P, et al. Determination of 20(S)-ginsenosideRh1 and its aglycone 20(S)-protopanaxatriol in rat plasma by sensitive LC-APCI-MS method and its application to pharmacokinetic study [J]. Eur J Mass Spectrom, 2009, 15(1): 65-87.
[14] US Food and Drug Administration. FDA'S policy statement for the development of new stereoisomeric drugs [J]. Chirality, 1992, 4(5): 338-340.
[15] LI X Y, SUN J G, WANG G J, et al. Simultaneous determination of panax notoginsenosideR1,ginsenosideRg1, Rd, Re and Rb1 in rat plasma by HPLC/ESI/MS: Platform for the pharmacokinetic evaluation of total panax notoginsenoside, a typical kind of multiple constituent traditional Chinese medicine [J]. Biomed Chromatogr, 2007, 21(7): 735-746.
[16] QIAN T, CAI Z, WONG R N S, et al. In vivo rat metabolism and pharmacokinetic studies ofginsenosideRg3 [J]. J Chromatogr B, 2005, 816(1): 223-232.
[17] QIAN T, CAI Z, WONG R N S, et al. Liquid chromatography/mass spectrometric analysis of rat samples for in vivo metabolism and pharmacokinetic studies ofginsenosideRh2 [J]. Rapid Commun Mass Spectrom, 2005, 19(23): 3 549-3 554.
[18] QIAN T, JIANG Z, CAI Z. High-performance liquid chromatography coupled with tandem mass spectrometry applied for metabolic study ofginsenosideRb1 on rat [J]. Anal Biochem, 2006, 352(1): 87-96.
[19] LI K, CHEN X, XU J, et al. Liquid chromatography/tandem mass spectrometry for pharmacokinetic studies of 20-(R)-ginsenosideRg3 in dog [J]. Rapid Commun Mass Spectrom, 2005, 19(6): 813-817.
[20] SUN J, WANG G, HAITANG X, et al. Simultaneous rapid quantification ofginsenosideRg1 and its secondary glycoside Rh1 and aglycone protopanaxatriol in rat plasma by liquid chromatography-mass spectrometry after solid-phase extraction [J]. J Pharm Biomed Anal, 2005, 38(1): 126-132.

