高效液相色谱-大气压化学电离串联质谱法研究4-(甲基亚硝胺基)-1-(3-吡啶基)-1-丁酮体外模拟代谢作用
范腾蛟,赵丽娇,张 然,钟儒刚
(北京工业大学生命科学与生物工程学院,环境与病毒肿瘤学北京市重点实验室,北京 100124)
烟草特异亚硝胺(tobacoo specific nitrosamine, TSNA)是烟草产品中特有的一类致癌物,由尼古丁和相关生物碱经亚硝化产生,可诱发肺癌、食管癌、口腔癌、鼻腔癌、胃癌、肝癌、胰腺癌、膀胱癌、肾癌、宫颈癌等多种癌症[1-2]。目前已发现的TSNA主要有7种,其结构示于图1。其中4-(甲基亚硝胺基)-1-(3-吡啶基)-1-丁酮(NNK)对啮齿类动物具有较强的致癌性,被国际癌症研究所(IARC)列为A1组致癌物质[3-4]。NNK在细胞色素P450 (CYP450)的作用下发生代谢活化,生成活泼亲电试剂,导致DNA损伤从而诱发癌症。
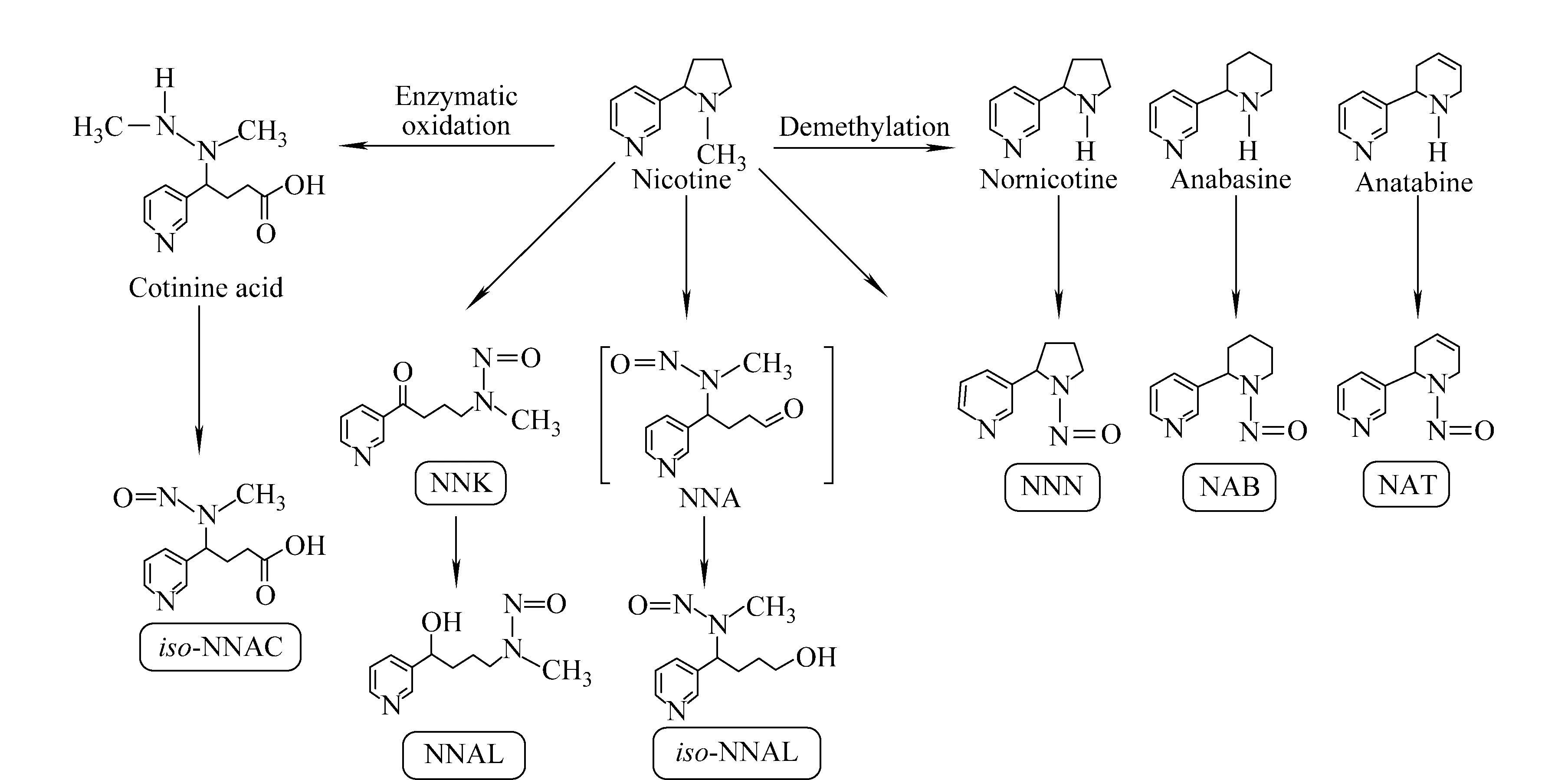
图1 烟草特异亚硝胺的结构以及烟草生物碱前体Fig.1 Structures of TSNAs and precursors of tabacco alkaloid
CYP450催化下的α-羟基化反应是NNK致癌的重要代谢途径之一。NNK是非对称亚硝胺:有两条α-羟基化反应代谢途径,即α-甲基羟基化反应途径(pathway A)和α-亚甲基羟基化反应途径(pathway B),其代谢机理示于图2。途径A是发生在啮齿类动物肺中的主要反应形式,可直接代谢产生4-羟基-1-(3-吡啶基)-1-丁酮(HPB),代谢中间体(1)可与DNA发生吡啶基氧代丁基化作用,生成释放HPB的DNA加合物,或者与血红蛋白结合生成释放HPB的血红蛋白加合物[5]。途径B可直接代谢产生醛酮和甲基重氮氢氧化物(2),后者可与DNA反应生成甲基DNA加合物。研究表明,在人体中不同亚型CYP450催化NNK的α-羟基化反应效率为2A13 > 2B6 > 2A6> 1A2 ~ 1A1 > 2D6 ~ 2E1 ~ 3A4[4]。CYP2A13在NNK的α-羟基化反应中较其他亚型具有更重要的作用,且在呼吸道组织中的催化效率更高[6-7],而CYP2A6在肝组织中的催化效率较其他组织高[8-9],这使得NNK代谢具有一定的器官特异性。此外,NNK代谢还具有种族特异性,例如同样是在肝中的α-亚甲基羟基化反应,主导大鼠体内NNK代谢的是1A2、2B1和3A三种亚型的P450,而主导人体内代谢的则是2A6和3A4两种亚型的P450[8,10]。
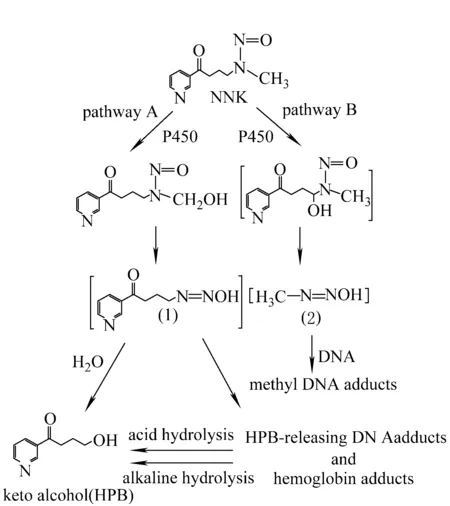
图2 CPY450催化下的NNK代谢机理Fig.2 Metabolic mechanism of NNK catalyzed by cytochrome P450
目前已有大量关于NNK代谢产物测定的相关报道。Mullett等[11]利用自动固相微萃取-高效液相色谱(HPLC)技术检测了NNK及其代谢产物HPB。Lee等[12]使用高效液相色谱-电喷雾质谱(HPLC-ESI-MS)法检测了A/J小鼠尿液中HPB等5种NNK代谢物。Chiang等[13]使用HPLC/MS法检测了经NNK处理的A549和H1437细胞中NNK、NNAL(4-(甲基亚硝胺基)-1-(3-吡啶基)-1-丁醇)和HPB的含量,结果表明在细胞中表达CYP2A13和CYP2A6可明显增强NNK的代谢。Lang等[14]利用亲水色谱-串联质谱法测定了兔血液中NNK及其代谢物HPB和NNAL等8种化合物,发现α-亚甲基羟基化反应是NNK在兔体内发生α-羟基化反应的主要途径。以上研究表明,HPB可以作为一种标志物应用于NNK体内代谢活化并致癌的相关研究。
体外模拟代谢是研究外源化学物质体内代谢机制和代谢活性常用的实验方法。Wang等[15]和Sturla等[16]用4-(乙酸基甲基亚硝胺基)-1-(3-吡啶基)-1-丁酮(NNKOAc)模拟NNK代谢产物,测定了其导致的DNA加合物,结果表明,NNK-DNA加合物能够释放HPB,HPB可以作为NNK导致DNA损伤的生物标志物。本研究采用高效液相色谱-大气压化学电离串联质谱(HPLC-APCI-MS/MS)法对NNK体外模拟代谢产物进行定量分析,旨在为TSNA致癌生物标志物的相关研究提供可靠的实验方法。
1 实验部分
1.1 主要仪器与试剂
TSQ Quantum高效液相色谱-质谱联用仪:美国Thermo公司产品;Z-323K型高速离心机:德国Hermle公司产品;BS-210S电子分析天平:德国Sartorius公司产品;PALL超纯水装置:美国Pall公司产品。
NNK、HPB、[3,3,4,4-D4]-HPB:加拿大Toronto Research Chemicals公司产品;大鼠肝微粒体:齐氏生物科技有限公司产品;葡萄糖-6-磷酸二钠盐、还原型辅酶II四钠盐:百灵威(J&K Chemical)公司产品;乙腈、甲醇(色谱纯)、乙酸铵:美国Sigma公司产品;Microcon YM-30微孔离心过滤器:美国Millipore公司产品;磷酸氢二钠、磷酸二氢钠(分析纯):天津市福晨化学试剂厂产品;氯化钾、氯化镁(分析纯):北京化工厂产品;三羟甲基氨基甲烷(Tris,分析纯):北京鼎国生物技术有限公司产品。
1.2 实验条件
1.2.1 色谱条件 Agilent Zorbax SB C18反相色谱柱(2.1 m×150 mm×5 μm);柱温25 ℃;流动相为10 mmol/L乙酸铵水溶液(A)和乙腈(B),流速0.2 mL/min;检测波长230 nm (二级管阵列检测器);梯度洗脱程序:0~5 min、98%A,5~15 min、98%~80%A,15~20 min、80%~75%A,20~25 min、75%~80%A,25~35 min、80%~98%A,35~45 min、98%A;进样量25 μL。
1.2.2 质谱条件 大气压化学电离源,正离子检测模式;放电电流4.0 μA;雾化器温度450 ℃;鞘气(N2)压力138 kPa;辅气(N2)压力35 kPa;离子传输毛细管温度270 ℃;导管入口补偿电压60 V;碰撞压力0.2 Pa;碰撞能量20 V;碰撞诱导解析能量5 V;质谱定量分析采用选择反应扫描模式(SRM),对m/z166→106和m/z170→106离子通道进行监测。
1.3 NNK体外代谢实验
向5支玻璃反应管中分别加入300 μL 10%大鼠肝微粒体工作液(含30 μL大鼠肝微粒体原液),180 μL浓度为0.2 mol/L的磷酸盐缓冲液(pH 7.4),6 μL浓度为1.65 mol/L的KCl溶液,6 μL浓度为0.4 mol/L的MgCl2溶液,30 μL浓度为0.05 mol/L的葡萄糖-6-磷酸二钠盐溶液,48 μL浓度为0.025 mol/L的还原型辅酶II四钠盐溶液),于37 ℃预热20 min。将其中一只反应管内的溶液作为空白对照样品,向另外4只反应管中分别加入1 400 μL NNK溶液,用Tris-HCl溶液(10 mmol/L,pH 7.4)定容至10 mL,使NNK的浓度分别为0.01、0.1、1、10 mmol/L。各反应管中D4-HPB内标物的浓度为100 nmol/L,于37 ℃反应12 h,每小时分别从5支反应管中取出200 μL反应混合液,置于-20 ℃保存。待所有反应完毕后,将反应混合液用YM-30离心过滤器过滤,待HPLC-APCI-MS/MS分析。
1.4 标准溶液的配制
配制浓度分别为0.2、0.8、2、8、20、80、200、400 nmol/L的HPB标准溶液,内标物D4-HPB的浓度为100 nmol/L。以HPB和D4-HPB的浓度比为横坐标,HPB和D4-HPB的峰面积比为纵坐标,绘制标准曲线。
1.5 方法学验证
配制浓度分别为0.8、4、20、40 nmol/L的HPB标准溶液(D4-HPB内标浓度为100 nmol/L),在拟定分析条件下,一天内进样测定6次,得到日内准确度和相对标准偏差;上述样品分别在3日内测定18次,得到日间精密度和相对标准偏差。向空白对照样品中分别加入HPB标准溶液,经过与待测样品相同的处理过程后,在拟定条件下进行分析,并计算加标回收率。
2 结果与讨论
2.1 方法的灵敏度和准确性
HPB和D4-HPB标准品的质谱图及碎裂机理示于图3,其主要碎片离子峰均为m/z106。采用SRM正离子模式监测HPB的m/z166→106和D4-HPB的m/z170→106离子通道,所得离子流图示于图4,其中HPB和D4-HPB的保留时间分别为19.84 min和19.81 min。将HPB和D4-HPB的SRM峰面积比对其浓度比作图,得到的标准曲线示于图5。结果表明,HPB在浓度为0.2~400 nmol/L范围内,HPB和D4-HPB的浓度比与SRM峰面积比的线性关系良好,线性相关系数R2=0.999 9。方法准确度和精密度的测定结果列于表1。由表1可知,方法的日内和日间准确度分别为97.2%~101.8%和96.6~101.1%;日内和日间相对标准偏差均为1.1%~3.2%。向空白对照样品中加入不同浓度的HPB标准溶液,按与待测样品相同的步骤进行处理和分析,测得方法的加标回收率为98%~103%,详细数据列于表2。在拟定的分析条件下,以3倍信噪比(S/N)测得的HPB检出限(LOD)为0.025 nmol/L,以10倍信噪比测得的HPB定量限(LOQ)为0.05 nmol/L。以上结果表明,本方法的灵敏度和准确性均能满足NNK代谢物的定量分析。
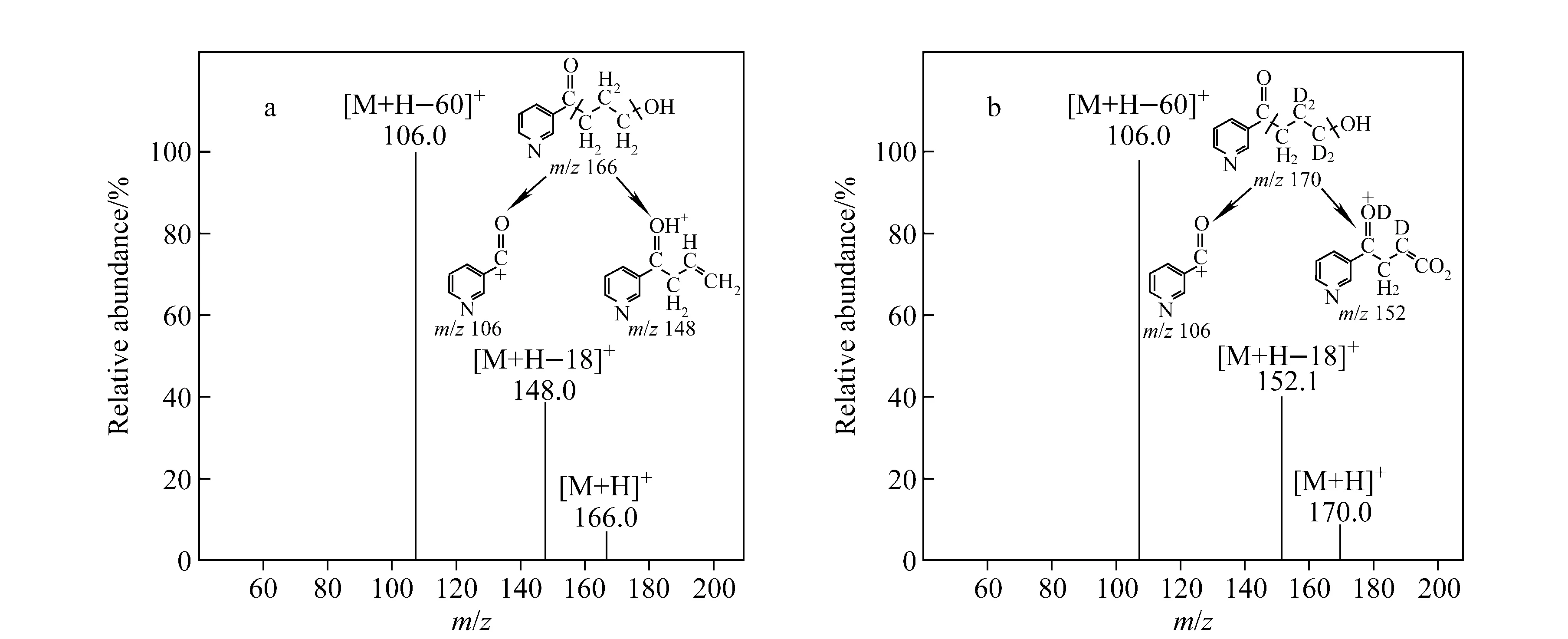
图3 HPB (a)和D4-HPB (b)的二级质谱全扫描图Fig.3 MS2 full scan spectra for HPB (a) and D4-HPB (b)
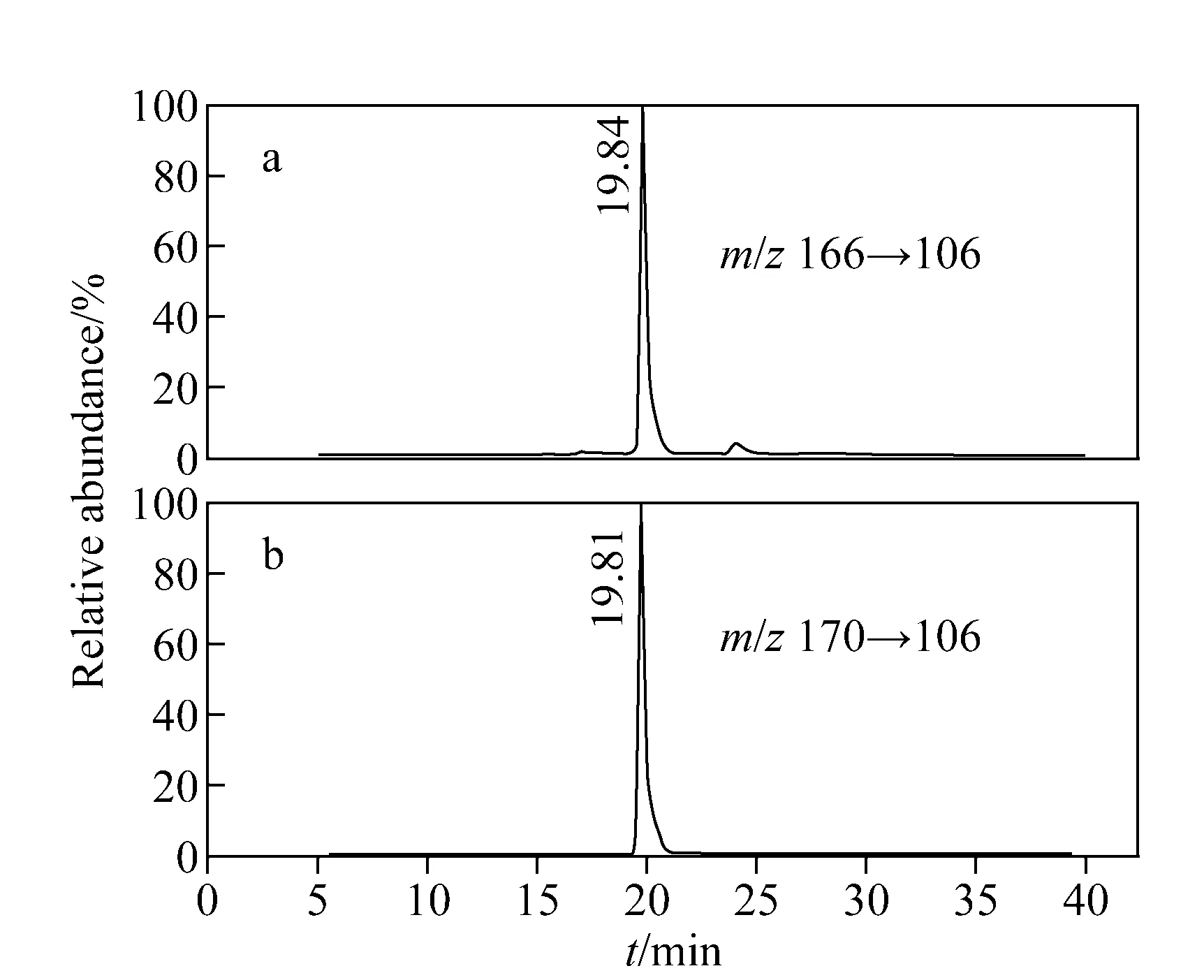
图4 HPB标准样品(a)和D4-HPB内标(b)的SRM离子流图Fig.4 SRM chromatograms for HPB standard(a) and D4-HPB internal standard(b)
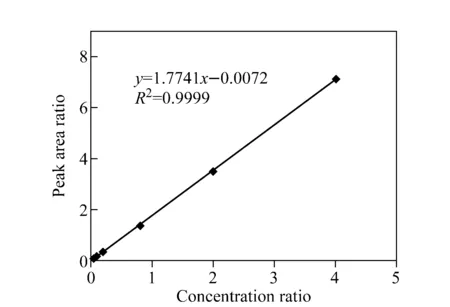
图5 HPB和D4-HPB的SRM峰面积比对其浓度比作图的标准曲线Fig.5 Calibration curve of HPB constructed by plotting SRM peak area ratio between HPB and D4-HPB versus their concentration ratio

样品浓度/(nmol/L)日内准确度和相对标准偏差 (n=6)相对标准偏差RSD/%回收率/%日间准确度和相对标准偏差 (n=18)相对标准偏差RSD/%回收率/%0.83.0101.83.198.041.197.21.196.6203.299.43.299.9403.0101.13.0101.1

表2 HPB在空白溶液中的加标回收率
2.2 体外模拟NNK代谢产物HPB的测定
空白对照组和模拟代谢组中HPB的SRM离子流图示于图6。图6a中m/z170→106离子通道在19.93 min出峰,而m/z166→106离子通道在此时没有信号,表明空白对照组中没有HPB;而图6b显示,模拟代谢组中有明显的HPB谱峰,说明该方法的专属性良好。在体外模拟代谢条件下,不同浓度NNK代谢物的测定结果示于图7,可以看出,代谢产物HPB的浓度随NNK浓度的增加和反应时间的延长而逐渐上升。在反应前2 h,NNK浓度为0.01 mmol/L和0.1 mmol/L的反应体系中,代谢物HPB的生成量逐渐上升,但增长趋势缓慢;NNK浓度为1 mmol/L和10 mmol/L的反应体系中,HPB浓度随反应时间的延长而显著上升,9 h后上升速率逐渐减缓。Richter等[17]对NNK在仓鼠、大鼠、小鼠及人类肺组织中的代谢反应动力学进行了研究,发现人肺组织中的主要代谢产物是HPB;而且NNK在人肺中代谢的主要产物和动力学特征与啮齿类动物有显著差异,表明NNK的代谢机制与不同亚型P450的参与有关。与动物实验相比,本研究所建立的NNK体外模拟代谢体系为阐明不同物种、不同器官中各类亚型P450催化下NNK代谢及其反应动力学之间的差异提供了一种更加简单、直接,而且具有高灵敏度和专属性的研究方法。
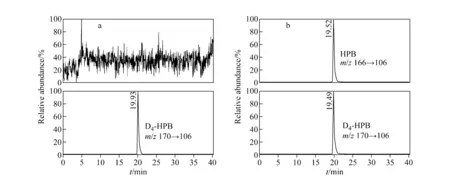
注:图6b为HPB和D4-HPB在NNK浓度为1mmol/L下反应6 h的离子流图图6 空白对照组(a)和体外代谢组(b)中HPB和D4-HPB的SRM离子流图Fig.6 SRM chromatograms for HPB and D4-HPB of the blank group(a) and the in vitro simulation group(b)
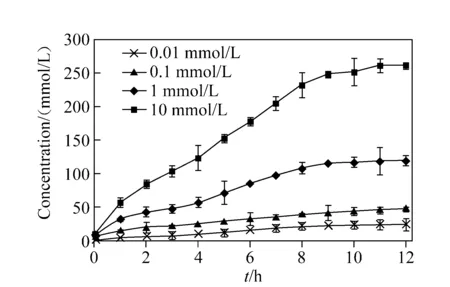
图7 不同浓度NNK代谢产物HPB的浓度变化Fig.7 Concentration of HPB metabolized from different concentrations of NNK
3 结论
本研究建立了NNK的体外模拟代谢模型,利用HPLC-APCI-MS/MS法对不同浓度NNK经体外模拟代谢生成的产物HPB进行了定量分析。结果表明,大鼠肝微粒体中的P450能够将反应体系中的NNK代谢为HPB,且HPB浓度随NNK浓度的增加和反应时间的延长而上升。该体外模拟代谢体系可用于探讨不同亚型P450催化下的烟草特异亚硝胺代谢活化的反应动力学研究,以阐明其代谢作用的分子机制,并为烟草特异亚硝胺致癌生物标志物的相关研究提供可靠的定量分析方法。
[1] HECHT S S. Biochemistry, biology, and carcinogenicity of tobacco-specificn-nitrosamines [J]. Chemical Research in Toxicology, 1998, 11(6): 559-603.
[2] HECHT S S. Tobacco carcinogens, their biomarkers and tobacco-induced cancer [J]. Nature Reviews Cancer, 2003, 3(10): 733-744.
[3] IARC. Monographs on the evaluation of the carcinogenic risk of chemicals to humans: Tobacco habits other than smoking: Betel quid and areca nut chewing and some related nitrosamines [R]. International Agency for Research on Cancer, Lyon, France, 1985, 37: 1-268.
[4] IARC. Monographs on the evaluation of the carcinogenic risk of chemicals to humans: Smokeless tobacco and some tobacco-specificn-nitrosamines [R]. International Agency for Research on Cancer, Lyon, France, 2007, 89: 1-592.
[5] HECHT S S. Tobacco smoke carcinogens and lung cancer [J]. Journal of the National Cancer Institute, 1999, 91(14): 1 194-1 210.
[6] SU T, BAO Z P, ZHANG Q Y, et al. Human cytochrome P450 CYP2A13: Predominant expression in the respiratory tract and its high efficiency metabolic activation of a tobacco-specific carcinogen, 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone [J]. Cancer Research, 2000, 60(18): 5 074-5 079.
[7] JALAS J R, DING X X, MURPHY S E. Comparative metabolism of the tobacco-specific nitrosamines 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone and 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanol by rat cytochrome P450 2A3 and human cytochrome P450 2A13 [J]. Drug Metabolism and Disposition, 2003, 31(10): 1 199-1 202.
[8] PATTEN C J, SMITH T J, MURPHY S E, et al. Kinetic analysis of the activation of 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone by heterologously expressed human P450 enzymes and the effect of P450-specific chemical inhibitors on this activation in human liver microsomes [J]. Archives of Biochemistry and Biophysics, 1996, 333(1): 127-138.
[9] MESSINA E S, TYNDALE R F, SELLERS E M. A major role for CYP2A6 in nicotine C-oxidation by human liver microsomes [J]. Journal of Pharmacology and Experimental Therapeutics, 1997, 282(3): 1 608-1 614.
[10] SMITH T J, GUO Z, HONG J Y, et al. Kinetics and enzyme involvement in the metabolism of 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK) in microsomes of rat lung and nasal-mucosa [J]. Carcinogenesis, 1992, 13(8): 1 409-1 414.
[11] MULLETT W M, LEVSEN K, BORLAK J, et al. Automated in-tube solid-phase microextraction coupled with HPLC for the determination ofn-nitrosamines in cell cultures [J]. Analytical Chemistry, 2002, 74(7): 1 695-1 701.
[12] LEE H L, WANG C Y, LIN S, et al. Liquid chromatography tandem mass spectrometric method for the simultaneous determination of tobacco-specific nitrosamine NNK and its five metabolites [J]. Talanta, 2007, 73(1): 76-80.
[13] CHIANG H C, WANG C Y, LEE H L, et al. Metabolic effects of CYP2A6 and CYP2A13 on 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK)-induced gene mutation-A mammalian cell-based mutagenesis approach [J]. Toxicology and Applied Pharmacology, 2011, 253(2): 145-152.
[14] LANG H L, WANG S, ZHANG Q D, et al. Simultaneous determination of NNK and its seven metabolites in rabbit blood by hydrophilic interaction liquid chromatography-tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2013, 405(6): 2 083-2 089.
[15] WANG M Y, CHENG G, STURLA S J, et al. Identification of adducts formed by pyridyloxobutylation of deoxyguanosine and DNA by 4-(acetoxymethylnitrosa mino)-1-(3-pyridyl)-1-butanone, a chemically activated form of tobacco specific carcinogens [J]. Chemical Research in Toxicology, 2003, 16(5): 616-626.
[16] STURLA S J, SCOTT J, LAO Y B, et al. Mass spectrometric analysis of relative levels of pyridyloxobutylation adducts formed in the reaction of DNA with a chemically activated form of the tobacco-specific carcinogen 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone [J]. Chemical Research in Toxicology, 2005, 18(6): 1 048-1 055.
[17] RICHTER E, ENGL J, FRIESENEGGER S, et al. Biotransformation of 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone in lung tissue from mouse, rat, hamster, and man [J]. Chemical Research in Toxicology, 2009, 22(6): 1 008-1 017.

