新型苯并吡喃黄酮的合成及其抗肿瘤活性
(贵州大学生命科学学院贵州省中药民族药创制工程中心,贵州贵阳 550025)
(贵州大学生命科学学院贵州省中药民族药创制工程中心,贵州贵阳 550025)
2,2-二甲基-8-乙酰基-7-羟基-5-甲氧基色满分别与对甲基苯甲酰氯,间氯苯甲酰氯和间三氟甲基苯甲酰氯经Baker-Venkataraman重排和关环反应合成了3个新型的苯并吡喃黄酮(3a~3c);1-(2″,4″-二甲氧基苯基)-3-(2',2'-二甲基-7'-羟基-5'-甲氧基色满-8')-1,3-二酮(4)分别与烯丙基溴,异戊烯基溴和碘甲烷经取代和关环反应合成了3个新型的3-烃基苯并吡喃黄酮(6a~6c)。3和6的结构经1H NMR,13C NMR和MS表征。采用MTT法和SRB法研究了3和6体外对人白血病细胞(K562)和人肺癌细胞(K549)的抗肿瘤活性。结果表明:2',4'-二甲氧基-2″,2″-二甲基-3″,4″-2H二氢吡喃-3-甲基-5″,6″:5,6-黄酮(6c)显示了较好的抗肿瘤活性。
苯并吡喃黄酮;3-烃基黄酮;合成;抗肿瘤活性
黄酮类化合物广泛存在于多种植物中,大多具有抗肿瘤、抗心血管疾病、抗病毒、抗炎、抗氧化等多种药理活性[1-2]。特别是苯并吡喃黄酮,具有良好的药理活性,如摩鲁新具有很好的抗HIV活性[3]和显著的抗肿瘤活性[4]。
为满足活性筛选和新药研究开发的需要,依据药物设计的原理,在前期[5]工作的基础上,本文将2,2-二甲基-8-乙酰基-7-羟基-5-甲氧基色满(1)分别与对甲基苯甲酰氯,间氯苯甲酰氯和间三氟甲基苯甲酰氯经Baker-Venkataraman重排和关环反应合成了3个新型的苯并吡喃黄酮(3a~3c,Scheme 1);1-(2″,4″-二甲氧基苯基)-3-(2',2'-二甲基-7'-羟基-5'-甲氧基色满-8')-1,3-二酮(4)分别与烯丙基溴,异戊烯基溴和碘甲烷经取代和关环反应合成了3个新型的3-烃基苯并吡喃黄酮(6a~6c,Scheme 2)。3和 6的结构经1H NMR,13C NMR和MS表征。并采用MTT法和SRB法研究了3和6体外对人白血病细胞(K562)和人肺癌细胞(K549)的抗肿瘤活性。
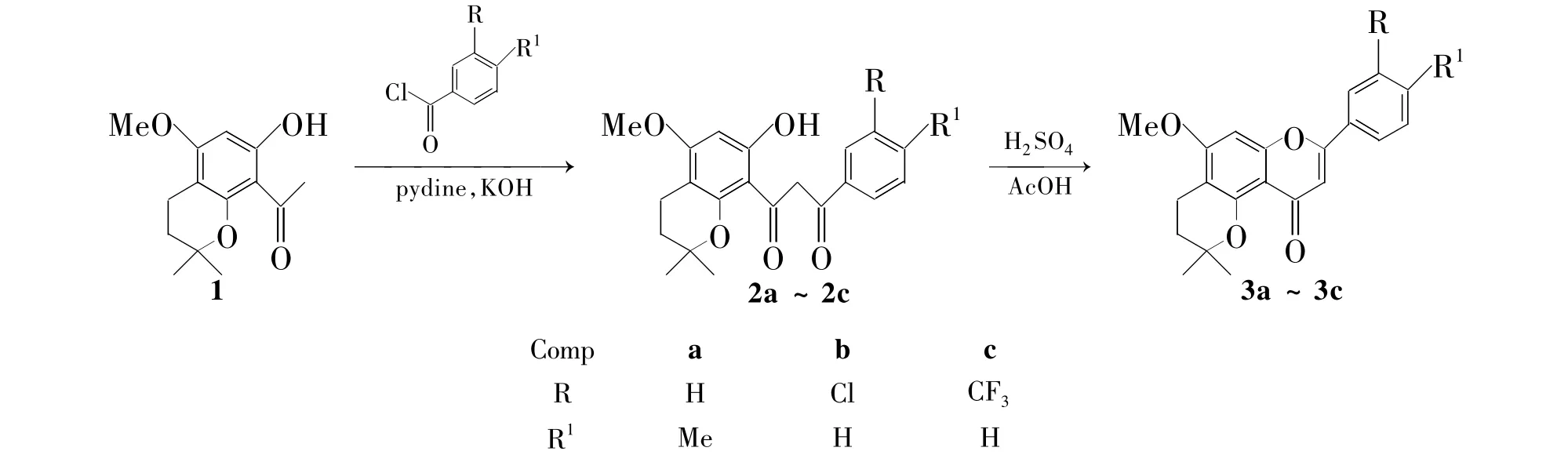
Scheme 1
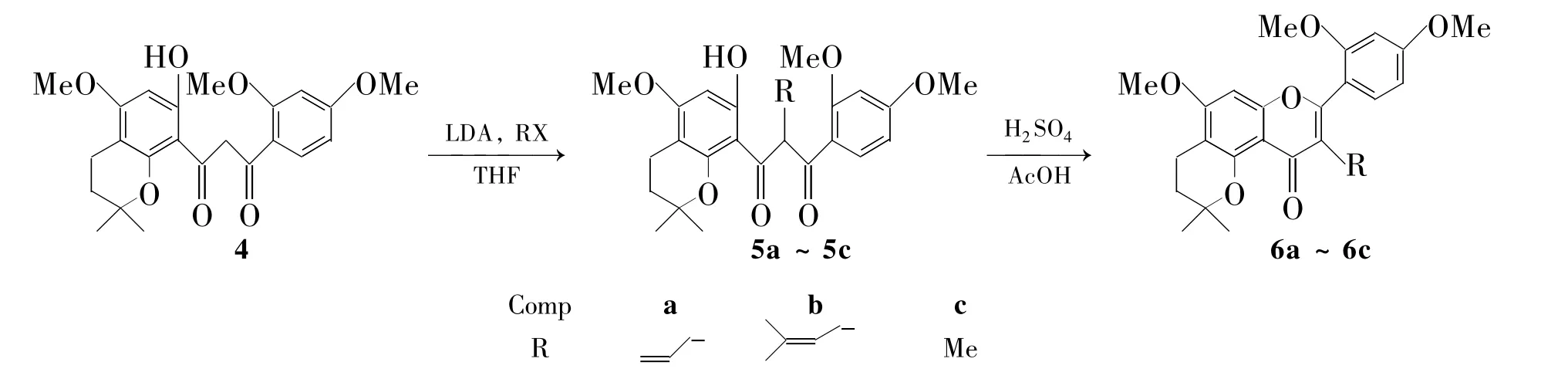
Scheme 2
1 实验部分
1.1 仪器与试剂
Bruker-DRX500(500 MHz)型和Bruker-AV400 (400 MHz)型核磁共振仪(CDCl3为溶剂,TMS为内标);HP5973型和HP1100MSD型质谱仪。
所用试剂均为分析纯;无水溶剂均按标准方法纯化。
1.2 合成
(1)2a~2c的合成(以2a为例)
在反应瓶中依次加入1 250.0 mg(1 mmol),4-甲基苯甲酰氯0.15 mL(1.1 mmol),KOH 0.45 g和吡啶5 mL,搅拌下于室温反应5 h(TLC跟踪)。加入5%盐酸50 mL,用乙酸乙酯(2×70 mL)萃取,合并有机相,用饱和NaCl溶液(30 mL)反萃,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析[洗脱剂:A=V(乙酸乙酯)∶V(石油醚)=1∶20]纯化得黄色粉末1-对甲基苯基-3-(2',2'-二甲基-7'-羟基-5'-甲氧基色满-8'-)-1,3-二酮(2a)300.2 mg,收率81.5%;ESI-MS m/z: 369{[M+H]+},391{[M+Na]+}。
用类似方法合成黄色粉末1-间氯苯基-3-(2',2'-二甲基-7'-羟基-5'-甲氧基色满-8'-)-1,3-二酮 (2b)【收率 54.3%;ESI-MS m/z:390 {[M+H]+},412{[M+Na]+}】和1-间三氟甲基苯基-3-(2',2'-二甲基-7'-羟基-5'-甲氧基色满-8'-)-1,3-二酮(2c)【收率70.6%;ESI-MS m/z: 424{[M+H]+},446{[M+Na]+}】。
(2)3a~3c的合成(以3a为例)
在反应瓶中依次加入 2a 185.2 mg(0.5 mmol),冰乙酸5 mL和浓硫酸30 μL,搅拌下于室温反应45 min。加水10 mL,用乙酸乙酯(2×75 mL)萃取,合并有机相,用饱和NaCl溶液(30 mL)反萃,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1∶5)纯化得白色粉末4'-甲基-2″,2″-二甲基-3″,4″-2H二氢吡喃-5″,6″: 5,6-黄酮(3a)120.3 mg。
用类似的方法合成白色粉末3'-氯-2″,2″-二甲基-3″,4″-2H二氢吡喃-5″,6″:5,6-黄酮(3b)和淡黄色粉末3'-三氟甲基-2″,2″-二甲基-3″,4″-2H二氢吡喃-5″,6″:5,6-黄酮(3c)。
3a:收率68.5%;1H NMR δ:1.34(s,3H),1.80(t,J=6.8 Hz,2H),2.0(s,6H),2.63(t,J=6.8 Hz,2H),3.95(s,3H),6.55(s,1H),6.74(s,1H),7.35(d,J=8.0 Hz,2H),7.87 (d,J=8.1 Hz,2H);13C HMR(125 MHz)δ: 17.5,21.2,26.6,28.9,30.0,34.3,37.2,56.1,75.6,91.5,108.7,126.5,130.4,142.3,162.2;ESI-MS m/z:351{[M+H]+},373 {[M+Na]+}。
3b:收率57.3%,1H NMR δ:1.43(s,6H),1.82(t,J=6.8 Hz,2H),2.65(t,J=6.8 Hz,2H),3.94(s,3H),6.56(s,1H),6.90(s,1H),7.40~7.50(m,2H),7.69(d,J=7.5Hz,1H),7.82(s,1H);13C HMR δ:17.0,26.2,30.9,55.9,77.0,90.6,108.7,124.1,125.5,130.1,131.2,134.9,154.9,157.9,159.7,162.1,177.2;EI-MS m/z:370.097 8[M+]。
3c:收率60.8%;1H NMR δ:1.45(s,6H),1.83(t,J=6.8 Hz,2H),2.66(t,J=6.8 Hz,2H),3.96(s,3H),6.57(s,1H),7.26(s,1H),7.39~7.50(m,2H),7.79(d,J=7.6 Hz,1H),7.92(s,1H);13C HMR δ:14.4,17.4,27.0,31.3,56.4,76.2,77.4,90.6,108.2,124.9,126.3,130.3,131.5,133.3,135.7,155.1,158.5,160.1,162.8,177.9;EI-MS m/z:404.123 1[M+]。
(3)6a~6c的合成(以6a为例)
在反应瓶中依次加入 4 207.1 mg(0.5 mmol)和无水THF 5 mL,冷却至-78℃,加入二异丙基氨基锂(LDA)3 mL(5 mmol),搅拌反应1 h;升温至-20℃反应4 h;再降温至-78℃,加入烯丙基溴0.52 mL(6 mmol),反应8 h。加入稀盐酸2 mL淬灭反应,加入适量蒸馏水,用乙酸乙酯(2×75 mL)萃取,合并有机相,用饱和NaCl溶液20 mL反萃,无水硫酸镁干燥,减压蒸除溶剂得棕色油状物2,4-双甲氧基苯基-2-烯丙基-3-2',2'-二甲基-7'-羟基-5'-甲氧基色满-8'-)-1,3-二酮(5a)。用冰醋酸(5 mL)溶解,加入浓硫酸30 μL,搅拌下于室温反应45 min。加水10 mL,用乙酸乙酯(2×75 mL)萃取,合并有机相,用饱和NaCl溶液(30 mL)反萃,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1∶5)纯化得棕色油状物2',4'-二甲氧基-2″,-2″-二甲基-3″,4″-2H二氢吡喃-3-烯丙基-5″,6″:5,6-黄酮(6a)137.2 mg。
用类似的方法合成淡黄色油状物2',4'-二甲氧基-2″,2″-二甲基-3″,4″-2H二氢吡喃-3-异戊烯基-5″,6″:5,6-黄酮(6b)和黄色油状物2',4'-二甲氧基-2″,2″-二甲基-3″,4″-2H二氢吡喃-3-甲基-5″,6″:5,6-黄酮(6c)。
6a:收率63.2%;1H NMR δ:1.43(s,6H),1.81(t,J=6.8 Hz,2H),2.63(t,J=6.8 Hz,2H),3.76(s,3H),3.83(s,3H),3.86(s,3H),4.77~4.84(m,2H),5.86~5.92(m,1H),6.33 (s,1H),6.54(t,J=6.8 Hz,2H),7.25(d,J= 10.0 Hz,1H);13C HMR δ:17.1,26.6,29.9,50.7,55.5,55.6,75.2,90.1,98.8,104.4,106.1,108.6,114.3,115.4,122.1,131.3,136.5,154.8,157.8,158.3,158.4,161.1,162.3,176.7;EI-MS m/z:436.188 9[M+]。
6b:收率62.6%;1H NMR δ:1.42(s,3H),1.43(s,6H),1.56(s,3H),1.80(t,J=6.7 Hz,2H),2.62(t,J=6.7 Hz,2H),2.98(d,J=5.5 Hz),3.75(s,3H),3.82(s,3H),3.84(s,3H),5.17(s,1H),6.32(s,1H),6.52(m,2H),7.22 (m,1H);13C HMR δ:17.1,17.4,24.6,25.5,26.5,31.5,55.5,55.6,75.2,90.1,98.8,104.5,105.9,108.6,115.7,122.8,123.6,130.3,131.4,154.7,157.2,158.3,161.0,162.2,177.0;EI-MS m/z:464.220 5[M+]。
6c:收率57.6%;1H NMR δ:1.27(s,6H),1.64(s,6H),1.72(t,J=6.8 Hz,2H),2.54 (t,J=6.8 Hz,2H),3.74~3.81(m,9H),6.33 (s,1H),6.48~6.62(m,2H),7.26(s,1H);13C HMR δ:10.1,17.7,26.5,29.6,29.9,31.9,55.6,56.2,75.5,90.8,98.9,105.5,131.7,154.2,156.4,159.1,161.8,163.0,176.5;EI-MS m/z:410.174 0[M+]。
1.3 体外抗肿瘤活性
以阿霉素为阳性对照药,分别采用MTT法(四氮唑盐还原法)测试3和6对人白血病细胞株K562的体外抗肿瘤活性。采用SRB法(磺酰罗丹明蛋白染色法)测试3和6对人肺癌细胞株A549的体外抗肿瘤活性。

表1 体外抗肿瘤活性*Table 1 In vitro antitumor activities
2 结果与讨论
2.1 合成
在合成2时,采用简便的“一锅法”完成了Baker-Venkataraman重排反应。该方法具有节约能源和绿色环保等优点。实验结果表明芳酰氯的种类对收率影响很大,苯环上带有给电子基团的芳酰氯收率高于带吸电子基团的芳酰氯。
在合成6时,先利用大位阻碱LDA使β-丙二酮于低温形成稳定的碳负离子,再经取代和关环反应合成3-烃基苯并吡喃黄酮,为合成该类化合物提供了一种有效的方法。
2.2 抗肿瘤活性
3和6的抗肿瘤活性见表1。由表1可见,3和6均有一定的抑制活性。其中6c对K562和A549抑制活性均较好,可以作为先导化合物进一步研究,其它相关药理活性的研究正在进行中。
3 结论
合成了6个新型的新型苯并吡喃黄酮类化合物。初步的体外抗肿瘤活性测试结果表明:2',4'-二甲氧基-2″,2″-二甲基-3″,4″-2H二氢吡喃-3-甲基-5″,6″:5,6-黄酮(6c)对K562和A549具有较好的抑制活性。
[1]吴立军.天然药物化学[M].北京:人民卫生出版社,2008.
[2]彭芳,陈植和.黄酮类化合物的生物活性[J].国外医药-植物药分册,1998,13(5):207-209.
[3]罗士德,J Nemec,宁冰梅.桑白皮中抗人爱滋病病毒成分研究[J].云南植物研究,1995,17(1): 89-95.
[4]Tsui-Hwa Tseng,Shien-Kai Chuang,Chao-ChinHu,et al.The synthesis of morusin as a potent antitumor agent[J].Tetrahedron,2010,66:1335-1340.
[5]陈斌,张尧,陈诗尧,等.两种新型A环并吡喃环黄酮的合成[J].合成化学,2013,21(2):185-188.
新型苯并吡喃黄酮的合成及其抗肿瘤活性*
陈 斌,刘雄伟,陈诗尧,郭丰敏,刘雄利,周 英
Synthesis and Anti-tumor Activities of Novel Benzopyranylflavonoids
CHEN Bin, LIU Xiong-wei, CHEN Shi-yao,GUO Feng-min, LIU Xiong-li, ZHOU Ying
(Guizhou Province Chinese Medicine and Ethnic Medicine Creation Engineering Center,College of Life Sciences,Guizhou University,Guiyang 550025,China)
Three novel benzopyranylflavonoids(3a~3c)were synthesized by Baker-Venkataraman rearrangement and cyclization of 1-(7-hydroxy-5-methoxy-2,2-dimethylchromanan-8-yl)ethanone with 4-methylbenzoyl chloride,3-chlorobenzoyl chloride and 3-(trifluoromethyl)benzoyl chloride,respectively.Futhermore,three novel 3-alkyl benzopyranylflavonoids(6a~6c)were synthesized by substitution and cyclization of 1-(2″,4″-methoxyphenyl)-3-(7'-hydroxy-5'-methoxy-2',2'-dimethylchromanan-8'-yl)propane-1,3-dione with 3-bromoprop-1-ene,1-bromo-3-methybut-2-ene and iodomethane,respectively.The structures were characterized by1H NMR,13C NMR and MS.The vitro anti-tumor activities of 3 and 6 against K562 and K549 were investigated by MTT method and SRB method.The results showed that 2',4'-dimethoxy-2″,2″-dimethy-3″,4″-2H-pyranyl-3-methyl-5″,6″: 5,6-flavonoid(6c)exhibited better anti-tumor activities.
benzopyranylflavonoid;3-alkyl flovonoid;synthesis;anti-tumor activity
周英,博士,教授,博士生导师,E-mail:yingzhou71@yeah.net
O626;O621.3
A
1005-1511(2014)01-0030-04
*
2013-08-19;
2013-12-13
教育部“新世纪人才支持计划”[教技函(2011)95号];贵州省优秀青年科技人才培养对象专项[黔科合人字2011(34)号];2012年贵阳市大学生创新计划基金;贵州大学引进人才科研项目[贵大人基合字(2013)013号]
陈斌(1987-),男,汉族,四川蓬安人,硕士研究生,主要从事天然活性物质的全合成及结构修饰的研究。E-mail:chenbin871739688@163.com

