三奎烷的合成及其衍生化研究进展
(太原理工大学材料科学与工程学院,山西太原 030024)
(太原理工大学材料科学与工程学院,山西太原 030024)
综述了三奎烷、氮杂三奎烷、氧杂三奎烷的结构特征、合成方法及反应性能,并对这一领域的发展前景进行了展望。参考文献34篇。
三奎烷;氮杂三奎烷;氧杂三奎烷;合成;衍生化;综述
三奎烷是分子中心有一个碳(或氮,氧)原子,周围均匀分布着三个五元环的分子(Chart 1)。理论上讲,三奎烷具有独特的碗状结构,使其具有独特的性质,科学家们对此类化合物进行了大量的理论计算及合成研究。

Chart 1
1964年,Woodward小组[1]报道了首例三奎烯的合成。以醇1为原料,经三氧化铬氧化得酮(2);2的双键被过氧乙酸氧化得环氧化产物(3);羰基邻位的碳原子在叔丁醇钾条件下生成碳负离子,碳负离子进攻分子内的环氧得羟基酮(4);4被铬酸氧化成缩醛(5);5被四醋酸铅氧化成三奎烷酸酐(6);6在甲醇加热条件下开环生成单羧酸酯(7);7与重氮甲烷反应得双酯(8);8在甲醇钠作用下发生异构化得酯基双异构化产物(9)和单异构化产物(10)(9/10=7/3);9或10经5步反应脱酯基得三奎烯(11,Sheme 1)。虽然总产率较低,但这在三奎烷化学的发展史上具有里程碑意义。
1976年,Paquette小组[2]首次获得了三奎烯晶体,并确定了其结构。晶体结构表明:三奎烯是分子中心有一个碳原子,分子中有三个五元环的碗状分子。位于中心的碳碳键的键角为106.5°,边缘的碳碳键的键角为103.9°,113.8°,112.8°,整个分子呈弯曲状。三奎烷的碗状结构及分子中碳碳键键角的扭曲使分子有较大的张力,这也为这类化合物难于合成提供了理论依据。
目前,科学家们已合成了三奎烷、氮杂三奎烷、氧杂三奎烷及其衍生物,并对它们的反应性能进行了研究。本文对三奎烷及杂三奎烷的合成及性能研究进行系统阐述。

Scheme 1

Scheme 2
1 三奎烷的合成及衍生化
1.1 三奎烷的合成及衍生化
自Woodward[1]报道了第一例三奎烷的合成后,Cook小组[3-4],Wilson小组[5],Meijere小组[6]和West小组[7]分别用不同的方法实现了三奎烷、边缘或中心碳原子上有取代基的三奎烷衍生物的合成。相对于第一例三奎烷的合成,这些合成方法具有更短的实验步骤和较高的产率。
1998年,Meijere小组[8]研究了三奎烯的氧化反应,发现三奎烯在间氯过氧苯甲酸,Oxone或四氧化锇等不同氧化条件下反应得不同产物。
1.2 三苯并三奎烷的合成及衍生化
1989年,Kuck小组[9]首次合成了三苯并三奎烷,并在此基础上发展了三奎烷化学的一个独特领域。该小组以酮(12)为原料,经四步反应得其差向异构体(15);15被氢化铝锂选择性还原得醇(16);16在多聚磷酸存在下关环得三苯并三奎烷(17,Scheme 2)。
1991年,Kuck小组[10]对三苯并三奎烷进行衍生化,在其分子中引入了3个二甲基胺基。随后,该小组[11-18]对三苯并三奎烷进行了进一步衍生化,在其分子中引入了卤素、巯基、烷氧基、磷酸酯、叠氮、胺、金属配体等官能团,大大丰富了三苯并三奎烷体系;2008年,Kuck小组[19]合成了三苯并三奎烷的硫醚衍生物,制备了其与C60的包合物并获得了其晶体结构;2011年,Kuck小组和曹小平小组[20]共同报道了具有6个苯并呋喃基团的三苯并三奎烷,获得了其晶体,并制备了其与C60的包合物;2012年,Hopf小组[21]采用简单的原料,一步合成了三苯并三奎烷。
2010年,Kuck小组和曹小平小组[22]共同报道了手性三苯并三奎烷的合成及拆分(Scheme 3)。这是首次分离到具有旋光性的三苯并三奎烷衍生物。三苯并三奎烷的手性可以通过两种方法产生:方法一是在前手性的三奎烯分子的桥头碳上引入三个不同的非手性取代基。该方法比较困难,因为三苯并三奎烷的桥头碳原子的选择性单官能团化或双官能团化是很难做到的。方法二是在六个非桥头碳原子上进行不完全官能团化。该研究采用了第二种方法。
该小组以桥头三烯丙基取代的三苯并三奎烷(18)为原料,在H2,Pd/C条件下还原得三正丙基取代产物(19);19在四氯化钛作用下与二甲氧基二氯甲烷反应,在其中一个苯环对位引入醛基;醛基被间氯过氧苯甲酸氧化成酸,并在碱性条件下脱羧转化为酚;重复羰基化和氧化反应在酚羟基邻位引入羧酸基团,而羧酸(23)与(R)-BINOL反应成酯(24a和24b,Scheme 3)。由于原料本身是没有手性的,所以反应过程中生成的化合物都是对映体,而当这些对映体与(R)-BINOL反应后生成的产物则是一对非对映体。利用柱色谱对非对映体进行了分离,然后在碱性条件下水解酯得互为对映体的光学纯化合物。光学纯三奎烷的合成为其在手性识别和不对称催化中的应用奠定了基础。
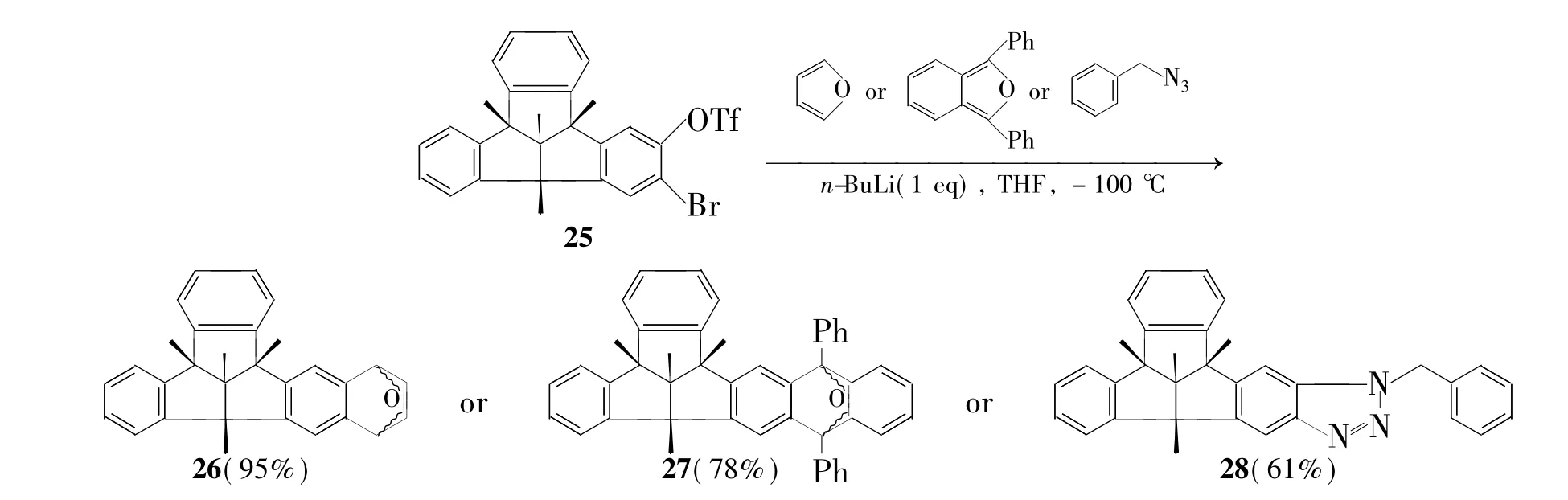
2012年,Kuck小组和曹小平小组[23]报道了三苯并三奎烷衍生物的合成。以溴和三氟甲磺酸根取代三苯并三奎烷(25)为原料,在丁基锂作用下转化为苯炔中间体,再与呋喃、苯并呋喃和苄基叠氮发生环加成反应,分别生成加成产物26,27和28(Scheme 4)。同时,分子中的呋喃环可在四氢铝锂作用下发生开环得三奎烷衍生物。
这两个小组不仅合成了具有一个三奎烷结构的化合物,还合成了含有2个三奎烷结构的化合物,并对其进行了衍生化。这一研究丰富了三苯并三奎烷的体系,为其在分子容器、自组装方面的研究奠定了基础。

Scheme 3
Scheme 4

Scheme 5
2013年,Kuck小组和曹小平小组[24]研究了三苯并三奎烷手性穴番的合成,并研究了其自组装性能。
2 杂三奎烷的合成及衍生化
2.1 氮杂三奎烷的合成及衍生化
1996年,Mascal小组[25]以1,3-吡咯二丙酸二甲酯(29)为原料,首先在铑/氧化铝、氢气条件下还原得四氢吡咯衍生物(30);30在二甲苯中回流反应得双环化合物(31);31在氢氧化钠条件下发生水解及进一步在碱石灰、高温条件下发生关环反应得含一个双键的氮杂三奎烯(32);32在盐酸作用下发生加成反应得羟基取代的氮杂三奎烷(33);33被氢化铝锂还原得氮杂三奎烷(34,Scheme 5),总产率19%。
同时,Mascal小组还合成了九氯代氮杂三奎烯。2000年,该小组[26]以九氯代氮杂三奎烯为原料,经三丁基锡烷还原得六氯代氮杂三奎烯,其被金属锂还原得氮杂三奎烯;2001年,Mascal小组[27]以含有一个双键的氮杂三奎烯为原料,与NBS、浓盐酸反应得羟基和溴取代的产物。
2001年,Mascal小组[28]发现含一个双键的氮杂三奎烯在酸性条件下加热可发生三聚反应得三聚物,并确定了其晶体结构。2005年,Mascal小组[29-30]又合成了氮杂三奎烯、边缘取代的六氯代氮杂三奎烯以及它们的负离子。
2011年,Mascal小组[31]以六氯代氮杂三奎烯为原料,合成了在边缘叔碳原子上连有炔基和烯丙基的六氯代三奎烯衍生物。其中,乙炔基取代的氮杂三奎烯可与苯基叠氮进行Click反应生成三唑。同时,苯环、环己基以及环氧基团被引入到三奎烯分子中,大大丰富了氮杂三奎烯衍生物的体系。
2.2 氧杂三奎烷的合成及衍生化
与氮原子不同,氧原子最外层有六个电子,可形成两根化学键达到八电子稳定结构。而氧杂三奎烷的氧原子上连有三根化学键,呈+1价,合成氧杂三奎烷更具有挑战性。
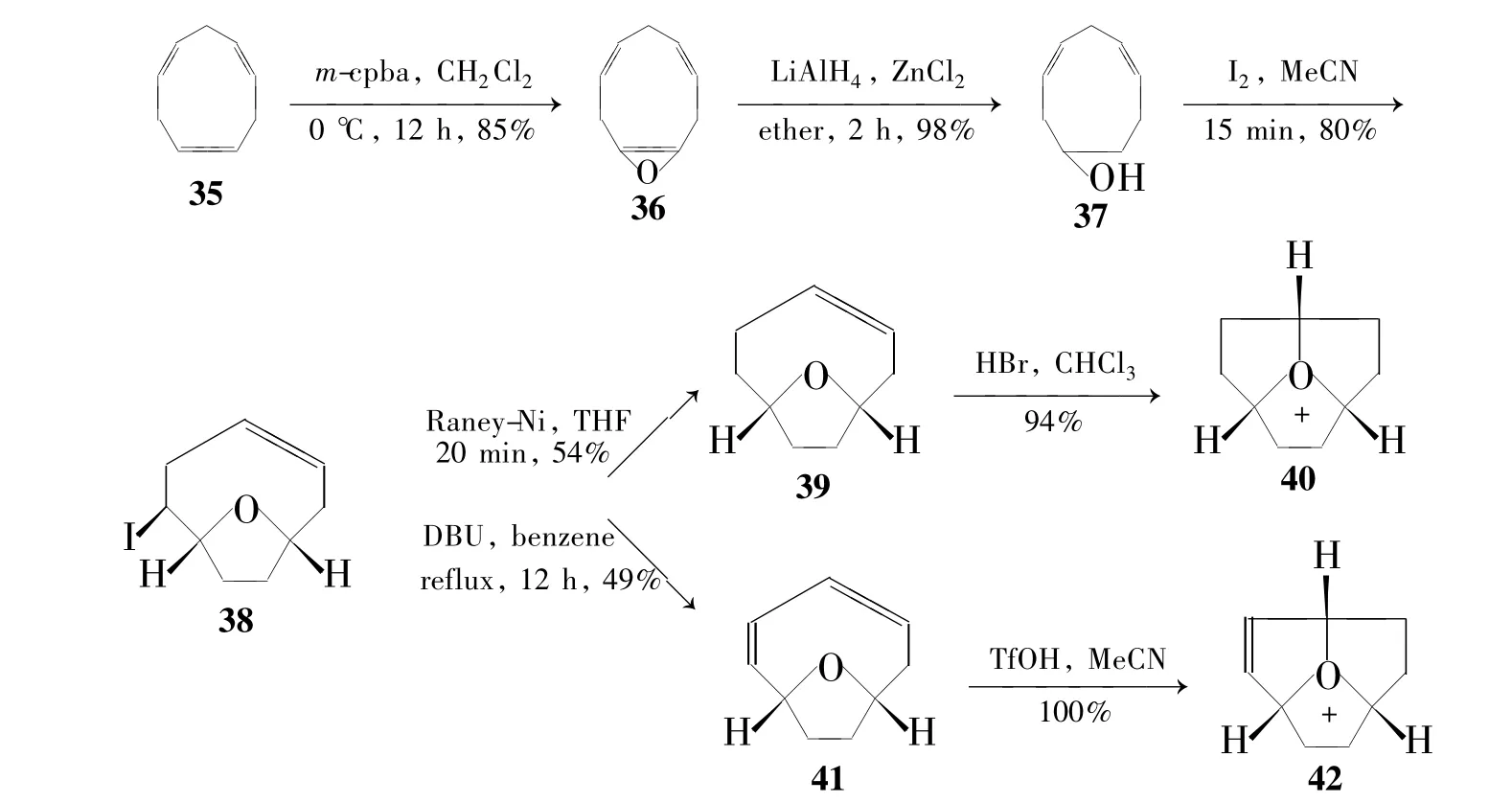
2008年,Mascal小组[32]首次合成了氧杂三奎烷(Scheme 6)。该小组以壬三烯(35)为原料,在m-cpba条件下进行选择性环氧化得单环氧化产物(36);用氢化铝锂将其还原成醇(37);37在单质碘存在下发生关环反应得含一个五元环和一个八元环的化合物(38);38在Raney Ni条件下还原或在DBU条件下脱碘化氢分别得含一个双键或两个双键的化合物(39或41);39在溴化氢作用下发生关环反应得氧杂三奎烷的溴盐(40);41在三氟甲磺酸存在的条件下发生关环反应得含一个双键的氧杂三奎烯的三氟甲磺酸盐(42)。
Scheme 6

Scheme 7
Mascal小组[32]以氧杂三奎烷为原料,合成了氧杂三奎烯(Scheme 7)。含一个双键的氧杂三奎烯42在碳酸氢钠作用下发生开环反应生成含一个五元环及一个八元环的化合物(43);43在三氧化铬-吡啶条件下发生氧化反应得羰基化合物(44);44中酮邻位的氢原子发生溴代生成二溴代物(45);45在DBU条件下脱去两分子溴化氢得烯酮(46);46在硼氢化钠、三氯化铈存在下发生选择性还原反应得羟基衍生物(47);47在三氟甲磺酸存在下发生关环反应得氧杂三奎烯的三氟甲磺酸盐(48)。这一氧正离子在室温下能稳定存在。该研究获得了氧杂三奎烷的六氟锑酸盐晶体,确定了其结构。2009年,Mascal小组[33]又合成了三甲基氧杂三奎烯,并研究了其与叠氮化钠的反应,发现其可在叠氮钠条件下发生开环。
2012年,Mascal小组[34]研究了氧杂三奎烷的氧原子(+2)与碳硼烷配位的情况,并对其进行了计算化学的研究。研究表明,氧杂三奎烷正离子可以与H(CHB11Cl11)发生配位。
3 总结与展望
对三奎烷、氮杂三奎烷、氧杂三奎烷的合成及反应性能进行了系统综述,并指出这一领域的发展方向。更多更简便的三奎烷的合成、衍生化方法学被期待发展出来;同时,硼杂、硅杂、磷杂、硫杂三奎烷(Chart 2)在理论上是可行的,其合成研究也具有较大的意义。
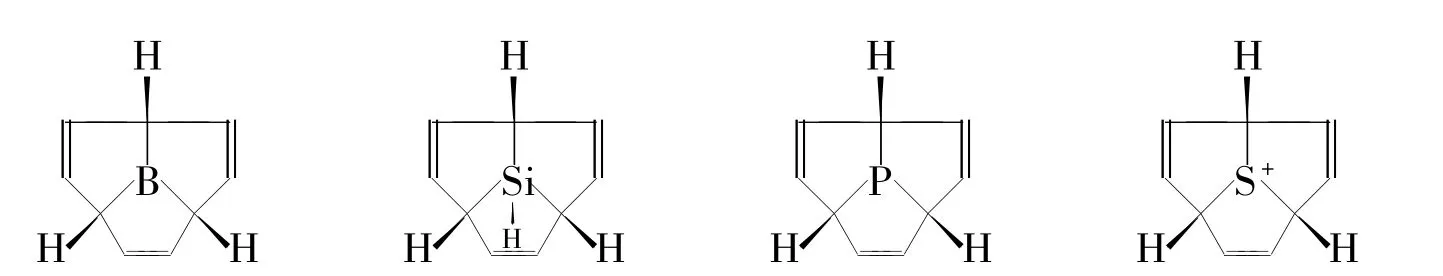
Chart 2
三奎烷具有独特的碗状结构,这种结构的独特性如用于实际,对三奎烷化学的发展将是极大的推动。因此,研究三奎烷的应用将是三奎烷化学的一个重要发展方向。
[1]K B Woodward,T Fukunaga,R C Kelly.Triquinacene[J].J Am Chem Soc,1964,86:3162-3164.
[2]E D Stevens,J D Kramer,L A Paquette.X-ray crystal structure analysis of triquinacene at 90K[J].J Org Chem,1976,41:2266-2269.
[3]A K Gupta,G S Lannoye,G Kubiak,et al.General approach to the synthesis of polyquin enes.Ⅷ.Synthesis of triquinacene,1,10-dimethyltriquinacene,and 1,10-cyclohexanotriquinacene[J].J Am Chem Soc,1989,111:2169-2179.
[4]X Y Fu,J M Cook.General approach for the synthesis of polyquinenes via the Weiss reaction.14.Synthesis of ellacene(1,10-decanotriquinacene)and studies of the proposed dimerization to a substituted dodecahedrane[J].J Org Chem,1992,57:5121-5128.
[5]J A Cadieux,D J Buller,P D Wilson.Versatile route to centro-substituted triquinacene derivatives:Synthesis of 10-phenyltriquinacene[J].Org Lett,2003,5: 3983-3986.
[6]A D Meijere,C H Lee,B Bengtson,et al.Preparation and properties of centrally bridgehead-substituted Hexacyclo-[4.4.0.02,1.03,5.04,8.07,9]decanes (“Diademanes”)and Related(CH)10 Hydrocarbons[J].Chem Eur J,2003,9:5481-5488.
[7]A Yungai,F G West.Convenient route to centro-substituted triquinaceneskeletonsviatheinterrupted Nazarov reaction[J].Tetrahedron Lett,2004,45: 5445-5448.
[8]R Haag,R Zuber,S Donon,et al.Highly exo-selective epoxidation and hydroxylation of triquinacene and Its derivatives:All-exo-Hexahydroxytriquinane[J].J Org Chem,1998,63:2544-2547.
[9]A D Mejere,D Kuck,A Schuster.Towards tribenzoacepentalene:Tribenzotriquinacene,dihydrotribenzo-acepentalenediide,and the tribenzoacepentalene radical anion[J].Angew Chem Int Ed Engl,1989,28:595-597.
[10]A Schuster,D Kuck.Three-and fourfold bridgeheadsubstituted tribenzotriquinacenes[J].Angew Chem Int Ed Engl,1991,30:1699-1702.
[11]D Kuck,A Schuster,C Fusco,et al.Oxyfunctionalization of nonnatural targets by dioxiranes.Selective oxidation of centropolyindans[J].J Am Chem Soc,1994,116:2375-2381.
[12]R Haag,B Ohlhorst,M Noltemeyer,et al.Tribenzacepentalene dianion and 4,7-disubstituted tribenzodihydroacepentalene derivatives:Formation,reactions,and structural properties of potential tribenzacepentalene precursors[J].J Am Chem Soc,1995,117: 10474-10485.
[13]R Eckrich,B Neumann,H G Stammler,et al.Stereoselective epoxidation of cyclohexa-anellated triquinacenes with iodine/silver(Ⅰ)oxide as compared to m-chloroperbenzoic acid[J].J Org Chem,1996,61:3839-3843.
[14]J Tellenbröker,D Kuck.Tribenzotriquinacenes with sixfold peripheral functionalization-potential building blocks for novel organic networks[J].Angew Chem Int Ed,1999,38:919-922.
[15]C A Dullaghan,G B Carpenter,D A Sweigart,et al.Synthesis and reactivity of manganese tricarbonyl complexes of the centropolyindanes 10-methyltribenzotriquinacene and fenestrindane[J].Organometallics,2000,19:2233-2236.
[16]D Kuck,A Schuster,R A Krause,et al.Multiply bridgehead-and periphery-substituted tribenzotriquinacenes-highly versatile rigid molecular building blocks with C3vor C3symmetry[J].Tetrahedron,2001,57(17):3587-3613.
[17]X P Cao,D Barth,D Kuck.Multiple vinylation of tribenzotriquinacenes and fenestrindanes at their aromatic peripheries by use of Nájera's catalyst[J].Eur J Org Chem,2005,70:3482-3488.
[18]L Zhou,T X Zhang,B R Li,et al.C3v-symmetrical tribenzotriquinacenes extended by six C1-functional groups and the first triquinacene-based tris(dithiametacyclophanes)[J].J Org Chem,2007,72: 6382-6389.
[19]P E Georghiou,L N Dawe,H A Tran,et al.C3v-Symmetrical tribenzotriquinacenes as hosts for C60and C70in solution and in the solid state[J].J Org Chem,2008,73:9040-9047.
[20]T Wang,Z Y Li,A L Xie,et al.Tribenzotriquinacenes bearing six-fold benzofuran extensions:Electron-rich C3v-symmetrical hosts for C60[J].J Org Chem,2011,76:3231-3238.
[21]G Markopoulos,L Henneicke,J Shen,et al.Tribenzotriquinacene:Eine vielseitige synthese und C3-chirale plattformen[J].Angew Chem Int Ed,2012,124 (51):13057-13060.
[22]W X Niu,T Wang,Q Q Hou,et al.Synthesis and optical resolution of inherently chiral difunctionalized tribenzotriquinacenes[J].J Org Chem,2010,75: 6704-6707.
[23]W X Niu,E Q Yang,Z F Shi,et al.Single-wing extended tribenzotri-quinacenes via bowl-shaped dehydrobenzene and isobenzofuran tribenzotriquinacene derivatives[J].J Org Chem,2012,77:1422-1434.
[24]T Wang,Y F Zhang,Q Q Hou,et al.C3-Symmetrical tribenzotriquinacene derivatives:Optical resolution through cryptophane synthesis and supramolecular self-assembly into nanotubes[J].J Org Chem,2013,78:1062-1069.
[25]M Mascal,N M Hext,O V Shishkin.Azatriquinane,azatriquinacene,and a remarkable dimerization product[J].Tetrahedron Lett,1996,37:131-134.
[26]M Mascal,M Lera,A J Blake.Azatriquinanes.2. Synthesis of azatriquinadiene and azatriquinacene[J].J Org Chem,2000,65:7253-7255.
[27]M Lera,A J Blake,C Wilson M Mascal.Azatriquinanes.Part 4.The chemistry of azatriquinenamine and its bromination products[J].J Chem Soc,Perkin Trans,2001,1:3145-3149.
[28]M Mascal,M Lera,A J Blake,et al.The azatriquinenamine trimer——A novel proton chelate[J].Angew Chem Int Ed,2001,40:3696-3698.
[29]M Mascal,J C Bertran.The azaacepentalenide anion:A new aromatic,bowl-shaped heterocycle[J].J Am Chem Soc,2005,127:1352-1353.
[30]D Pham,J C Bertran,M M Olmstead,et al.Interaction of fullerenes with the concave surfaces of perchloroazatriquinacene[J].Org Lett,2005,7: 2805-2808.
[31]M Jevric,T Zheng,N K Meher,et al.Azatriquinane as a platform for tripodal metal complexes and calixiform scaffolds[J].Angew Chem Int Ed,2011,50: 717-719.
[32]M Mascal,N Hafezi,N K Meher,et al.Oxatriquinane and oxatriquinacene:Extraordinary oxonium ions[J].J Am Chem Soc,2008,130: 13532-13533.
[33]M Mascal,N Hafezi,M D Toney.1,4,7-Trimethyloxatriquinane:SN2 reaction at tertiary carbon[J].J Am Chem Soc,2010,132:10662-10664.
[34]E S Stoyanov,G Gunbas,N Hafezi,et al.The R3O+…H+hydrogen bond:Toward a tetracoordinate oxadionium(2+)ion[J].J Am Chem Soc,2012,134:707-714.
三奎烷的合成及其衍生化研究进展*
崔培培,罗居杰,李中华
Research Progress on the Synthesis and Derivatization of Triquinacenes
CUI Pei-pei, LUO Ju-jie, LI Zhong-hua
(College of Materials Science and Engineering,Taiyuan University of Technology,Taiyuan 030024,China)
In this paper structural characteristics,synthetic methods,properties and the prospect of development of triquinacenes,azatriquinacenes and oxotriquinacenes were reviewed with 34 references.
triquinacene;azatriquinacene;oxotriquinacene;synthesis;derivatization;review
O626.1
A
1005-1511(2014)01-0126-07
2013-05-13;
2013-12-05
太原理工大学引进人才基金(tyut-rc201243a)
崔培培(1986-),女,汉族,山东聊城人,博士研究生,讲师,主要从事有机合成化学和质子交换膜的研究。E-mail: cuipeipei@tyut.edu.cn

