新型多甲氧基取代二苯醚类化合物的合成
(南京大学环境学院污染控制和资源化国家重点实验室,江苏南京 210023)
(南京大学环境学院污染控制和资源化国家重点实验室,江苏南京 210023)
以碘化亚铜为催化剂,Cs2CO3为碱,甲氧基取代苯酚(1)和甲氧基取代碘苯通过偶联反应形成C-O-C键,合成了27个新型的多甲氧基取代二苯醚类化合物,其结构经1H NMR和IR表征。最佳合成条件为:1 1.0 mmol,CuI 0.10 mmol,Cs2CO32.0 mmol,DMF为溶剂,N2保护下于130℃下回流反应16 h。在最佳反应条件下,收率37%~94%。
甲氧基取代苯酚;甲氧基取代碘苯;多甲氧基取代二苯醚;合成
二苯醚衍生物种类繁多,是一类重要的有机化工中间体,在农药、医药、香料等工业上有广泛用途[1-3]。甲氧基取代二苯醚类化合物作为合成中间体在实际生产中已有广泛应用。2-甲氧基二苯醚是新型高效广谱杀菌剂2,4,4'-三氯-2'-甲氧基二苯醚(俗称三氯生)的重要中间体,而三氯生在国外已广泛用于各类卫生消毒用品的生产,如杀菌皂、洗面奶、牙膏、抗菌餐具洗涤剂等[4]。2-甲氧基二苯醚还是合成甲氧基取代溴代二苯醚的中间体[5]。已有研究证明甲氧基取代溴代二苯醚类化合物存在于多种生物体内[6-7]。4-甲氧基二苯醚可作为合成4-羟基二苯醚的中间体,而4-羟基二苯醚是合成新型昆虫生长调节剂及保幼激素类似物-蚊蝇醚的主要中间体[8]。因此,寻找一种有效的方法合成该系列化合物具有重要应用价值和意义。
Willanson合成法[9]是生成C-O键的一种经典方法。该方法采用硝基卤代苯和酚类化合物在碱溶液中直接作用生成醚,但反应条件较苛刻,反应时间长,不易控制。而目前二苯醚较普遍的生产方法是采用Ullmann法合成C-O键[10-12],即在铜盐催化下,由酚盐与氯苯反应而得。但该反应需在高温(200℃ ~250℃)、高压(1 MPa以上)下才能实现。Tao等人[13]在此基础上研究出一种在常压、温度低于180℃条件下制备二苯醚的方法,目前该方法已应用于实际生产中;Kim等[14]以纳米氧化亚铜为催化剂,以芳基卤化物和酚类化合物为底物,通过Ullmann偶联反应,有效合成C-O键,该方法简单易行,产率较高,但纳米氧化亚铜的制备过程繁琐;Sreedhar等[15]以纳米碘化亚铜为催化剂,可使一些有机胺类和酚类化合物在相对温和的条件下生成C-O键,该方法高效、廉价、环保;Pan等[16]用W/O微乳化制备的CuI颗粒为催化剂,在较温和的条件下实现了C-O交叉偶联反应;Zhu等[17]以碘化亚铜为催化剂,卤代芳烃和亚磺酸盐为底物,通过偶联反应,生成相应的芳基砜,该方法简单高效、适用范围广。
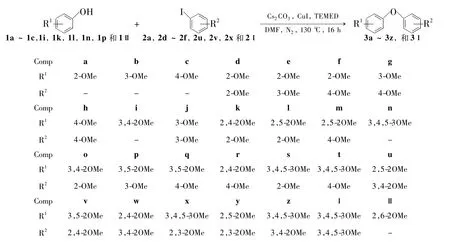
Scheme 1
本文以碘化亚铜为催化剂,Cs2CO3为碱,DMF为溶剂,甲氧基取代苯酚(1a~1c,1i,1k,1l,1n,1p和1Ⅱ)和甲氧基取代碘苯(2a,2d~2f,2u,2v,2x和2Ⅰ)为底物,通过偶联反应形成C-O-C键,成功合成了27个新型的多甲氧基取代二苯醚类化合物(3a~3z和3Ⅰ,Scheme 1),其结构经1H NMR和IR表征。并对反应条件进行优化。
1 实验部分
1.1 仪器与试剂
CN66M/X-6型显微熔点仪(温度未校正);Bruker Avance-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);NEXUS 870型傅里叶变换红外光谱仪(KBr压片);Agilent 1200型高效液相色谱仪。
甲氧基取代苯酚(1),碘化亚铜和四甲基乙二胺,纯度>98%,国药控股股份有限公司;碘苯(2a),甲氧基代碘苯和碳酸铯,纯度>98%,安耐吉化学[萨恩化学技术(上海)有限公司];DMF,纯度≥99.5%,阿拉丁化学品有限公司;其余所用试剂均为分析纯。
1.2 合成
(1)3a~3z和3Ⅰ的合成[以2-甲氧基二苯醚(3a)为例]
在反应瓶中依次加入2-甲氧基苯酚(1a)124 mg(1 mmol)和DMF 10 mL,搅拌使其溶解;依次加入碘苯 204 mg(1 mmol),四甲基乙二胺(TEMED)116 mg(0.1 mmol),碳酸铯650 mg (2.0 mmol)和碘化亚铜190 mg(0.1 mmol),氮气保护下回流(130℃)反应16 h。冷却至室温,加水50 mL,分液,水相依次用乙酸乙酯(3×30 mL)和饱和氯化钠溶液(3×10 mL)萃取,合并萃取液,用无水硫酸镁干燥,减压浓缩后经硅胶柱层析[梯度洗脱剂:V(石油醚)∶V(乙酸乙酯)=30∶1~5∶1]纯化得3a 188 mg,产率94%。
用类似方法合成3b~3z和3Ⅰ。
3a:白色粉末,产率94%,m.p.72℃ ~73℃;1H NMR δ:3.91(s,3H),6.97~7.19(m,6H),7.16(t,J=8.4 Hz,1H),7.33(t,J=8.8 Hz,2H);IR ν:3 064,2 980,2 846,1 597,1 581,1 491,1 456,1 439,1 387,1 335,1 222,1 262,872,748 cm-1。
3b:淡黄色液体,产率93%;1H NMR δ: 3.81(s,3H),6.62(d,J=5.6 Hz,2H),6.68 (d,J=7.6 Hz,1H),7.06(d,J=6.4 Hz,2H),7.13(t,J=5.6 Hz,1H),7.24(dd,J=5.2 Hz,12.0 Hz,1H),7.36(t,J=6.0 Hz,2H);IR ν: 3 066,2 985,2 835,1 586,1 487,1 467,1 451,1 438,1 330,1 246,1 218,1 139,850,760 cm-1。
3c:淡黄色液体,产率 89%;1H NMR δ: 3.84(s,3H),6.92(dd,J=2.8 Hz,6.8 Hz,2H),6.98(dd,J=1.6 Hz,8.4 Hz,2H),7.03 (dd,J=3.2 Hz,6.8 Hz,2H),7.09(t,J=8.4 Hz,1H),7.32(dd,J=2.8,9.6 Hz,2H);IR ν:3 061,2 952,2 835,1 589,1 506,1 465,1 441,1 333,1 227,1 197,872,842,758 cm-1。
3d:无色晶体,产率37%,m.p.74℃ ~75℃;1H NMR δ:3.89(s,6H),6.84~6.91(m,4H),7.00(d,J=6.4 Hz,2H),7.08(t,J=6.0 Hz,2H);IR ν:3 066,2 956,2 834,1 600,1 583,1 500,1 455,1 440,1 328,1 252,1 213,875,742 cm-1。
3e:蓝色粉末,产率86%,m.p.52℃ ~53℃;1H NMR δ:3.80(s,3H),3.87(s,3H),6.53(t,J=6.8 Hz,2H),6.62(d,J=6.6 Hz,1H),6.94~6.95(m,1H),7.02(d,J=6.4 Hz,2H),7.14~7.22(m,2H);IR ν:3 067,2 966,2 838,1 596,1 581,1 500,1 490,1 455,1 438,1 330,1 265,1 206,1 141,839,762,746 cm-1。
3f:无色晶体,产率87%,m.p.68℃ ~70℃;1H NMR δ:3.82(s,3H),3.90(s,3H),6.86(m,4H),6.96(d,J=7.2 Hz,2H),7.01 (d,J=6.8 Hz,1H),7.07(m,1H);IR ν: 3 075,2 954,2 842,1 591,1 499,1 458,1 444,1 323,1 254,1 217,845,751 cm-1。
3g:无色液体,产率91%;1H NMR δ:3.80 (s,3H),3.84(s,3H),6.54(s,2H),6.62(d,J=6.6 Hz,1H),6.90(d,J=7.2 Hz,2H),7.01(d,J=7.2 Hz,2H),7.20(t,J=6.8 Hz,1H);IR ν:3 044,2 955,2 835,1 602,1 589,1 505,1 465,1 452,1 441,1 283,1 246,1 212,1 138,832,766 cm-1。
3h:白色片状固体,产率83%,m.p.95℃~96℃;1H NMR δ:3.81(s,6H),6.86(d,J= 7.2 Hz,4H),6.93(d,J=7.2 Hz,4H);IR ν: 3 062,2 956,2 838,1 608,1 509,1 467,1 455,1 441,1 298,1 248,1 104,835,762 cm-1。
3i:白色粉末,产率85%,m.p.43℃ ~45℃;1H NMR δ:3.86(s,3H),3.90(s,3H),6.58 (dd,J=2.4 Hz,7.2 Hz,1H),6.68(d,J=2.0 Hz,1H),6.84(d,J=7.2 Hz,1H),6.98(d,J= 6.6 Hz,2H),7.07(t,J=5.8 Hz,1H),7.32(t,J=6.4 Hz,2H);IR ν:3 064,2 955,2 834,1 592,1 558,1 506,1 464,1 455,1 413,1 331,1 261,1 220,956,854,760,692 cm-1。
3j:淡黄色液体,产率 81%;1H NMR δ: 3.81(d,J=1.6 Hz,6H),6.64(d,J=6.6 Hz,4H),6.69(d,J=6.6 Hz,2H),7.25(t,J=6.5 Hz,2H);IR ν:3 069,2 958,2 835,1 601,1 488,1 467,1 449,1 312,1 264,1 198,846,768 cm-1。
3k:白色粉末,产率88%,m.p.80℃ ~82℃;1H NMR δ:3.82(d,J=3.6 Hz,6H),3.93 (s,3H),6.43(dd,J=2.4 Hz,7.2 Hz,1H),6.59(d,J=2.0 Hz,1H),6.69(d,J=6.4 Hz,1H),6.82(t,J=5.8 Hz,1H),6.90(d,J=6.8 Hz,1H),6.98~7.02(m,2H);IR ν:3 085,2 957,2 842,1 593,1 502,1 467,1 451,1 439,1 330,1 255,1 215,838,756 cm-1。
3l:白色粉末,产率77%,m.p.67℃ ~68℃;1H NMR δ:3.72(s,3H),3.85(d,J=10.8 Hz,6H),6.44(d,J=2.4 Hz,1H),6.58(dd,J=2.4 Hz,7.2 Hz,1H),6.89(dd,J=3.6 Hz,9.6 Hz,3H),6.99(d,J=6.4 Hz,1H),7.09~7.12(m,1H);IR ν:3 070,2 947,2 834,1 600,1 499,1 462,1 455,1 430,1 283,1 266,1 129,838,754 cm-1。
3m:淡黄色液体,产率86%;1H NMR δ: 3.72(s,3H),3.82(s,3H),3.86(s,3H),6.46 (s,1H),6.59(d,J=7.2 Hz,1H),6.87(d,J=6.8 Hz,2H),6.92(d,J=6.8 Hz,1H),6.97(d,J=7.2 Hz,2H);IR ν:3 071,2 952,2 835,1 614,1 590,1 504,1 464,1 443,1 295,1 265,1 209,1 128,830,727 cm-1。
3n:白色粉末,产率88%,m.p.80℃ ~82℃;1H NMR δ:3.82(s,6H),3.86(s,3H),6.30(s,2H),7.02(d,J=3.8 Hz,3H),7.10 (t,J=5.8 Hz,1H),7.34(t,J=6.4 Hz,2H);IR ν:3 089,2 958,2 830,1 585,1 500,1 491,1 456,1 443,1 420,1 336,1 223,1 122,817,789,705 cm-1。
3o:淡黄色粉末,产率90%,m.p.74℃~75℃;1H NMR δ:3.85(s,3H),3.88(s,3H),3.91(s,3H),6.48(dd,J=2.0 Hz,6.8 Hz,1H),6.69(d,J=2.0 Hz,1H),6.80(d,J=6.8 Hz,1H),6.91(d,J=3.2 Hz,2H),7.01(d,J=6.4 Hz,1H),7.09~7.12(m,1H);IR ν: 3 083,2 964,2 834,1 600,1 584,1 499,1 471,1 442,1 342,1 259,1 212,838,738 cm-1。
3p:无色液体,产率84%;1H NMR δ:3.78 (s,6H),3.81(s,3H),6.21(d,J=2.0 Hz,2H),6.25(d,J=1.6 Hz,1H),6.63~6.7(m,3H),7.23~7.29(m,1H);IR ν:3 072,2 959,2 837,1 601,1 489,1 473,1 441,1 319,1 264,1 205,1 152,828,772 cm-1。
3q:白色粉末,产率88%,m.p.55℃ ~56℃;1H NMR δ:3.76(s,6H),3.83(s,3H),6.13(d,J=0.8 Hz,2H),6.19(s,1H),6.90 (d,J=6.8 Hz,2H),7.01(d,J=6.8 Hz,2H);IR ν:3 091,2 960,2 832,1 607,1 500,1 473,1 459,1 425,1 296,1 251,1 212,1 134,843,823,754 cm-1。
3r:无色晶体,产率89%,m.p.39℃ ~40℃;1H NMR δ:3.79(s,3H),3.83(d,J=5.2 Hz,6H),6.43(dd,J=2.4 Hz,7.2 Hz,1H),6.60(d,J=2.0 Hz,1H),6.83(d,J=7.2 Hz,2H),6.88(dd,J=1.2 Hz,6.8 Hz,3H);IR ν: 3 045,2 939,2 835,1 598,1 501,1 464,1 439,1 313,1 262,1 211,829,748 cm-1。
3s:淡黄色固体,产率91%,m.p.71℃ ~72℃;1H NMR δ:3.79(s,6H),3.84(s,3H),3.90(s,3H),6.26(s,2H),6.93~6.99(m,2H),7.03(d,J=6.4 Hz,1H),7.12(t,J=6.4 Hz,1H);IR ν:3 071,2 938,2 829,1 601,1 502,1 461,1 421,1 421,1 343,1 263,1 221,1 124,1 010,813,778,754 cm-1。
3t:白色固体,产率92%,m.p.50℃ ~51℃;1H NMR δ:3.80(dd,J=0.8 Hz,9.2 Hz,12H),6.18(d,J=18.4 Hz,2H),6.90(d,J= 7.2 Hz,2H),6.99(d,J=7.2 Hz,2H);IR ν: 3 077,2 961,2 837,1 593,1 498,1 463,1 452,1 417,1 342,1 210,1 129,822,756 cm-1。
3u:黄色固体,产率93%,m.p.80℃~81℃;1H NMR δ:3.73(s,3H),3.85(d,J=2.8 Hz,6H),3.88(s,3H),6.51~6.53(m,2H),6.59 (dd,J=2.4 Hz,7.2 Hz,1H),6.69(d,J=2.0 Hz,1H),6.80(d,J=6.8 Hz,1H),6.93(d,J= 7.2 Hz,1H);IR ν:3 082,2 948,2 833,1 603,1 588,1 505,1 471,1 428,1 323,1 276,1 260,1 227,1 132,1 017,856,780,723 cm-1。
3v:白色固体,产率91%.m.p.52℃ ~53℃;1H NMR δ:3.76(s,6H),3.82(s,3H),3.84(d,3H),6.10(s,2H),6.12(s,1H),6.46(d,J=7.2 Hz,1H),6.60(s,1H),6.99 (d,J=6.8 Hz,1H);IR ν:3 081,2 940,2 837,1 597,1 508,1 471,1 440,1 311,1 261,1 209,932,861,824,791 cm-1。
3w:淡黄色固体,产率86%.m.p.72℃~73℃;1H NMR δ:3.83(t,J=4.2 Hz,12H),6.36 (dd,J=2.4 Hz,7.2 Hz,1H),6.44(dd,J= 2.4 Hz,7.2 Hz,1H),6.60(d,J=2.0 Hz,1H),6.65(d,J=2.0 Hz,1H),6.75(d,J=6.8 Hz,1H),6.91(d,J=6.8 Hz,1H);IR ν: 3 080,2 953,2 833,1 598,1 504,1 463,1 439,1 412,1 313,1 259,1 209,837,800,761 cm-1。
3x:白色粉末,产率82%,m.p.65℃ ~66℃;1H NMR δ:3.80(s,6H),3.84(s,3H),3.90(s,3H),3.92(s,3H),6.27(s,2H),6.60 (d,J=6.4 Hz,1H),6.74(d,J=6.4 Hz,1H),6.99(t,J=6.8 Hz,1H);IR ν:3 078,2 938,2 835,1 593,1 499,1 470,1 430,1 342,1 246,1 130,778,741 cm-1。
3y:黄色固体,产率80%,m.p.80℃ ~81℃;1H NMR δ:3.73(s,3H),3.85(d,J=2.8 Hz,6H),3.88(s,3H),6.51~6.53(m,2H),6.59(dd,J=2.4 Hz,7.2 Hz,1H),6.69(d,J=2.0 Hz,1H),6.80(d,J=6.8 Hz,1H), 6.93(d,J=7.2 Hz,1H);IR ν:3 082,2 948,2 833,1 603,1 588,1 505,1 471,1 428,1 323,1 276,1 260,1 227,1 132,1 017,856,780,723 cm-1。
3z:白色粉末,产率86%,m.p.74℃ ~75℃;1H NMR δ:3.81(s,6H),3.84(s,3H),3.87(s,3H),3.90(s,3H),6.24(s,2H),6.57 (dd,J=2.0 Hz,6.8 Hz,1H),6.67(d,J=2.0 Hz,1H),6.84(d,J=7.2 Hz,1H);IR ν: 3 083,2 938,2 836,1 600,1 501,1 468,1 422,1 348,1 230,1 125,1 009,835,781 cm-1。
3Ⅰ:白色粉末,产率84%,m.p.104℃~106℃;1H NMR δ:3.83(s,12H),3.86(s,6H),6. 29(s,4H);IR ν:3 096,2 942,2 842,1 595,1 498,1 465,1 418,1 338,1 225,1 128,823,784 cm-1。
2 结果与讨论
2.1 反应条件优化
以1a(1 mmol)和2a(1 mmol)为底物,CuI (0.05 mmol~0.20 mmol)为催化剂,考察溶剂、催化剂及碱剂对3a产率的影响,优化反应条件,实验结果见表1。从表1可见,以DMF为溶剂时3a产率最高可达96%,DMSO和THF分别次之。
由表1还可以看出,以K2CO3为碱剂时3a产率最高仅为74%(No.7),而以Cs2CO3为碱剂时,产率最高达96%(No.13和No.16)。即用Cs2CO3为碱剂时,3a收率普遍比K2CO3较高。可能因为 Cs2CO3作为路易斯碱时,其碱性比K2CO3大,对反应的促进作用比K2CO3强[18]。
从表1还可以看出,以DMF为溶剂时,当反应温度控制在100℃时,3a产率(78%)明显低于回流状态(130℃,94%),温度升至150℃时3a产率96%,提升不明显。因此,为了便于控制反应温度及提高产率,反应温度控制在130℃为宜。
同时,本文考察了不同催化剂 (CuI[17],Cu-Br[19],CuCl[20]和铜粉[21])对反应的影响,结果见表2。由表2可见,CuI为催化剂时3a产率最高(94%)。
此外,还对CuI用量对反应的影响进行了比较,结果见图1。由图1可见,CuI用量对反应影响较大。随着用量增多,产率明显提高。用量为0.10 mmol时产率为94%;增加用量至0.15 mmol和0.20 mmol时,产率分别为96%和97%,对产率提高并不明显,故CuI用量为0.10 mmol。
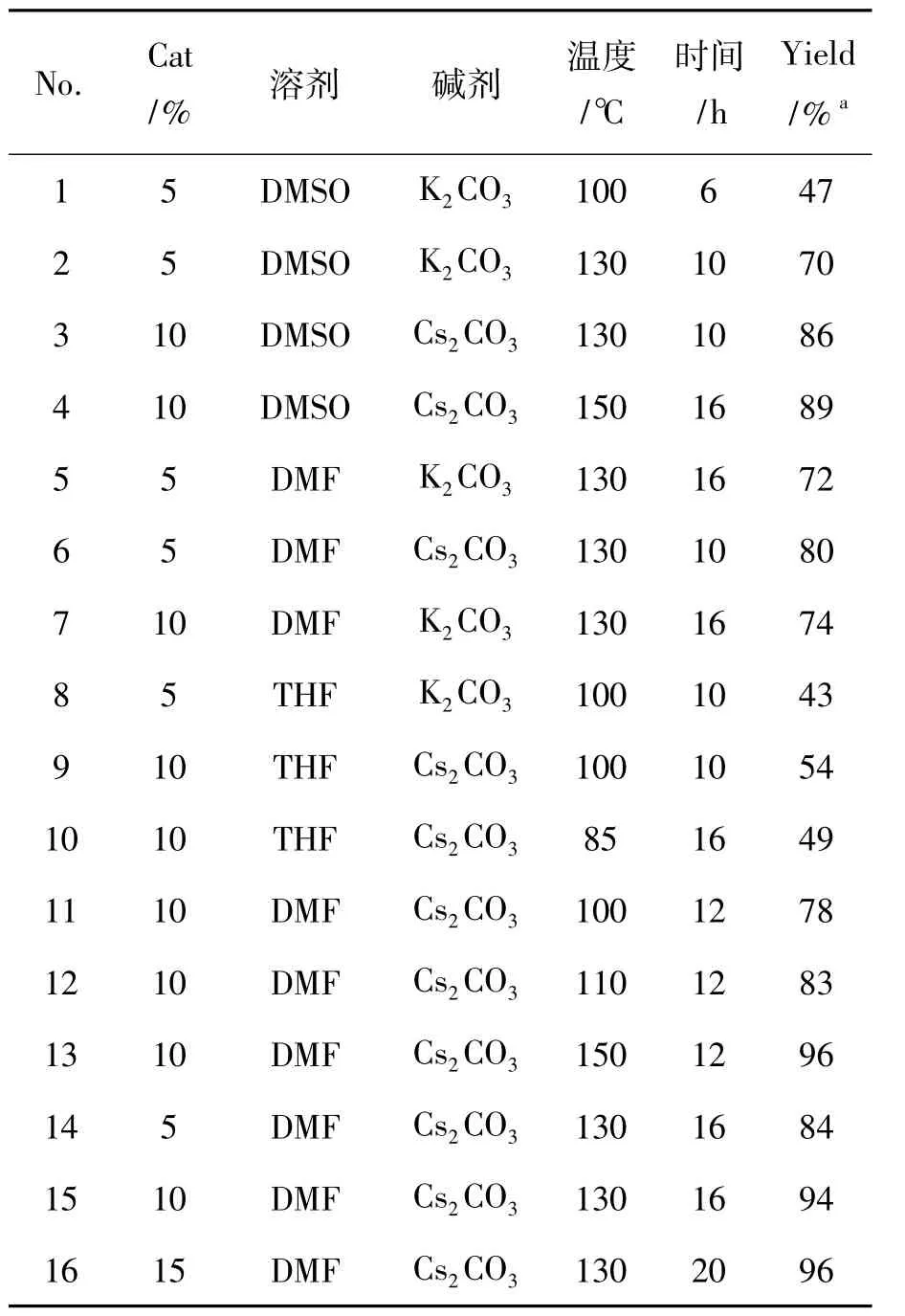
表1 反应条件筛选*Table 1 Optimization of the reaction conditions

表2 催化剂对反应的影响*Table 2 Effect of catalysts on reaction

图1 CuI用量与产率的关系曲线Figure 1 Relation curve of CuI dose and the yield
2.2 底物结构
由底物结构及产率分析可知,本文所选绝大部分底物均有反应发生且收率良好。仅有少部分底物收率较低甚至不反应,如2,2'-二甲氧基产率很低(3d,37%),可能是因为甲氧基均在邻位产生了相应的排斥效应。此外,2,6-二甲氧基苯酚(1Ⅱ)与甲氧基取代碘苯未发生反应,这主要是由于2,6-二甲氧基苯酚中羟基两个邻位存在两个甲氧基,空间位阻较大,阻止了反应的发生。
3 结论
以碘化亚铜为催化剂,甲氧基取代苯酚和甲氧基取代碘苯通过偶联反应成功合成了27个新型的多甲氧基取代二苯醚类化合物。最佳合成条件为:甲氧基取代苯酚1.0 mmol,催化剂CuI 0.10 mmol,碱剂Cs2CO32.0 mmol,DMF 10 mL,N2保护下于130℃下回流反应16 h。
该合成方法操作简单、后处理容易、收率良好,是一种较好的合成多甲氧基取代二苯醚类化合物的方法。
[1]Sawyer J S.Recent advances in diaryl ether synthesis[J].Tetrahedron,2000,56(29):5045-5065.
[2]Nicolaou K C,Boddy C N C,Brase S,et al.Chemistry,biology,and medicine of the glycopeptide antibiotics[J].Angew Chem Int Ed,1999,38(15):2097-2152.
[3]Nicolaou K C,Natarajan S,Li H,et al.Total synthesis of vancomycin aglycon-part 1:Synthesis of amino acids 4-7 and construction of the AB-COD ring skeleton[J].Angew Chem Int Ed,1998,37(19):2708-2714.
[4]汪敦佳,王国宏,董静华.2-甲氧基二苯醚的合成[J].化学世界,2003,(2):94-96.
[5]Vetter W,Kirres J,Bendig P.Bromination of 2-methoxydiphenyl ether to an average of tetrabrominated 2-methoxydiphenyl ethers[J].Chemosphere,2011,84 (8):1117-1124.
[6]Zhang K,Wan Y,An L H,et al.Trophodynamics of polybrominated diphenyl ethers and methoxylated polybrominated diphenyl ethers in a marine food web[J]. Environ Toxicol Chem,2010,29(12):2792-2799.
[7]Teuten E L,Xu L,Reddy C M.Two abundant bioaccumulated halogenated compounds are natural products[J].Science,2005,307(5711):917-920.
[8]王天桃,张应阔,钱万红.4-羟基二苯醚的合成研究[J].农药,1995,34(7):10-11.
[9]Scarborough H A.Substitution products of 4-nitro-and 4-acetamido-diphenyl ether[J].J Chem Soc,1929: 2361-2367.
[10]Ullmann F.A new presentation method of phenyl ether salic acid[J].Ber Dtsch Chem Ges,1904,37 (1):853-854.
[11]Pellón R F,Carrasco R,Miliàn V.Use of pyridine as cocatalyst for the synthesis of 2-carboxy substituted diphenylethers by Ullmann-Goldberg-condensation[J]. Synth Comm,1995,25(7):1077-1083.
[12]Kunz K,Scholz U,Ganzer D.Renaissance of Ullmann and Goldberg reactions-progress in Copper catalyzed C-N-,C-O-and C-S-coupling[J].Synlett,2003,(15):2428-2439.
[13]陶英丕,孙素桢,于瑞林.常压法合成二苯醚[J].精细化工,1994,11(3):37-39.
[14]Kim J Y,Park J C,Kim A,et al.Cu2O nanocubecatalyzed cross-coupling of aryl halides with phenols via Ullmann coupling[J].Eur J Inorg Chem,2009,2009(28):4219-4223.
[15]Sreedhar B,Arundhathi R,Reddy P L,et al.CuI nanoparticles for C-N and C-O cross coupling of heterocyclic amines and phenols with chlorobenzenes[J].J Org Chem,2009,74(20):7951-7954.
[16]潘攀,蔡振亚,叶加久,杨春燕.纳米CuI催化偶联反应合成二苯醚类农药中间体[J].现代农业科技,2010,(9):25-26.
[17]Zhu W,Ma D W.Synthesis of aryl sulfones via L-proline-promoted CuI-catalyzed coupling reaction of aryl halides with sulfinic acid salts[J].J Org Chem,2005,70(7):2696-2700.
[18]张学胜,石佳奇,孙莉.钯催化条件下形成碳硫键合成多氯代二苯硫醚[J].有机化学,2011,31(7): 1107-1113.
[19]Zhang Q,Wang D P,Wang X Y,et al.(2-Pyridyl) acetone-promoted Cu-catalyzed O-arylation of phenols with aryl Iodides,bromides,and chlorides[J].J Org Chem,2009,74(18):7187-7190.
[20]Buck E,Song Z J,Tschaen D,et al.Ullmann diaryl ether synthesis:Rate acceleration by 2,2,6,6-tetramethylheptane-3,5-dione[J].J Org Lett,2002,4(9): 1623-1626.
[21]Engels V,Benaskar F,Patil N,et al.Cu-based nanoalloys in the base-free Ullmann heterocyle-aryl ether synthesis[J].Org Process Res Dev,2010,14 (3):644-649.
新型多甲氧基取代二苯醚类化合物的合成*
刘 伏,张学胜,王遵尧
Synthesis of Novel Polymethoxy Diphenyl Ethers
LIU Fu, ZHANG Xue-sheng, WANG Zun-yao
(State Key Laboratory of Pollution Control and Resources Reuse,School of Environment,Nanjing University,Nanjing 210023,China)
Twenty seven novel polymethoxy diphenyl ethers were synthesized by coupling reaction of methoxy-iodobenzenes and methoxy-phenols(1)using CuI as the catalyst,cesium carbonate as the base.The structures were characterized by1H NMR and IR.The optimum reaction conditions at 130℃ for 16 h under N2atmosphere were as follows:1 was 1.0 mmol,CuI was 0.10 mmol,Cs2CO3was 2.0 mmol,DMF was the solvent.The yield were 37% ~94%under the optimum reaction conditions.
methoxy-phenol;methoxy-iodobenzene;polymethoxy diphenyl ethers;synthesis
O625.32
A
1005-1511(2014)01-0006-06
2012-11-16;
2013-11-16
国家自然科学基金资助项目(41071319,20977046);中央高校基本科研业务基金资助项目(1112021101)
刘伏(1989-),女,汉族,山东临沂人,硕士研究生,主要从事有机合成及有机分析的研究。E-mail:liufu0616@126.com
王遵尧,教授,Tel.025-89680358,E-mail:wangzunyao315cn@163.com

