围手术期大剂量补液对降低ERCP术后胰腺炎发病率的随机对照研究
姜中华 王翔 沈伟明 杨红梅 吴旭东 王建华 范志宁
内镜下逆行胰胆管造影(ERCP)术后胰腺炎(post-ERCP pancreatitis, PEP)、高淀粉血症(hyperamylasemia, HA)是ERCP最常见的并发症。除了提高操作水平以外,还可以通过预防性胰管支架置入、减少胰腺显影次数、术前应用硝酸甘油[1]、术后应用非甾体类消炎药肛栓[2]等方法来降低PEP的发生率。急性胰腺炎(AP)早期大剂量补液对缩短病程和缓解病情的发展有着重要的治疗作用[3]。Sashidhar等[4]通过回顾性病例对照研究发现ERCP术后并发胰腺炎的患者围手术期输液量均少于对照组。本研究进一步阐明围手术期大剂量补液对PEP、HA的预防作用。
一、资料和方法
1.入选和剔除标准:收集南京医科大学第二附属医院和盐城市第一人民医院2013年1月至12月因胆总管结石,胆管癌伴胆道梗阻拟行ERCP治疗的患者,年龄18~75岁,性别不限。排除标准:(1)伴急性胆源性胰腺炎、慢性胰腺炎患者;(2)伴急性胆管炎或脓毒症者;(3)既往曾行ERCP乳头括约肌切开术;(4)有大剂量补液风险,心、肺、肾功能不全的患者;(5)妊娠期妇女;(6)围手术期使用生长抑素、肛塞消炎痛等预防PEP的药物者。本研究经医院医学伦理委员会批准,患者术前签署知情同意书。采用随机数字表法将患者随机分入大剂量补液(大剂量)组和对照组。根据cotton标准[5],ERCP术后3、24 h血淀粉酶超过正常范围上限3倍以上、持续24 h,且伴有持续性腹痛者为PEP。血清淀粉酶检测值超过正常值高限即定义为HA。
2.ERCP治疗方法:所有患者均由每个医院固定的同一个经验丰富医师进行操作。所有患者术中常规乳头切开。对胆总管结石患者行ERCP取石,多发、巨大结石碎石困难者行塑料支架置入;对胆管癌患者行金属支架置入;对插管困难、乳头水肿者行胰管支架置入。术后均留置鼻胆管。
3.围手术期补液治疗:术前1 h给予林格液和5%葡萄糖1∶1的混合液静脉滴注。大剂量组补液速度为4 ml·kg-1·h-1,对照组为2 ml·kg-1·h-1,均维持24 h。此后,未并发胰腺炎患者逐渐减少输液量,直至恢复正常饮食,若并发穿孔、出血患者则终止研究,并行相应治疗。对肝门部肿瘤患者,行ERCP术当天给予头孢他啶(复达欣)2.0 g静脉注射,12 h 1次,连续3 d。
4.观察指标:术前及术后3、24 h采血检查血淀粉酶、C反应蛋白(CRP)。淀粉酶采用速率法测定,CRP采用全血超敏法测定。
二、结果
1.一般资料:两所医院共行ERCP治疗1 284例,符合入选标准245例,其中4例患者出现并发症,共241例患者纳入本组分析。241例患者中胆总管结石179例,胆管癌62例(经症状、腹部CT或MRI等诊断),术中均以碘普罗胺(优维显)为造影剂。两组患者的性别、年龄、病种构成等方面均具有可比性。

表1 两组患者基本情况比较
2.术后高淀粉酶血症和PEP发生率:两组共发生PEP 12例,发生率为4.97%(12/241),其中大剂量补液组发生2例(1.69%),对照组发生10例(8.13%),大剂量补液组的发生率显著低于对照组,差异有统计学意义(P=0.034)。两组术后共发生HA 71例,发生率为29.87%(72/241),其中大剂量补液组发生23例(19.4%),对照组发生49例(39.8%),大剂量补液组的发生率亦显著低于对照组,差异有统计学意义(P=0.001)。
3.发生PEP的危险因素分析:本组患者发生PEP与临床常见的影响因素均无相关性(表2)。
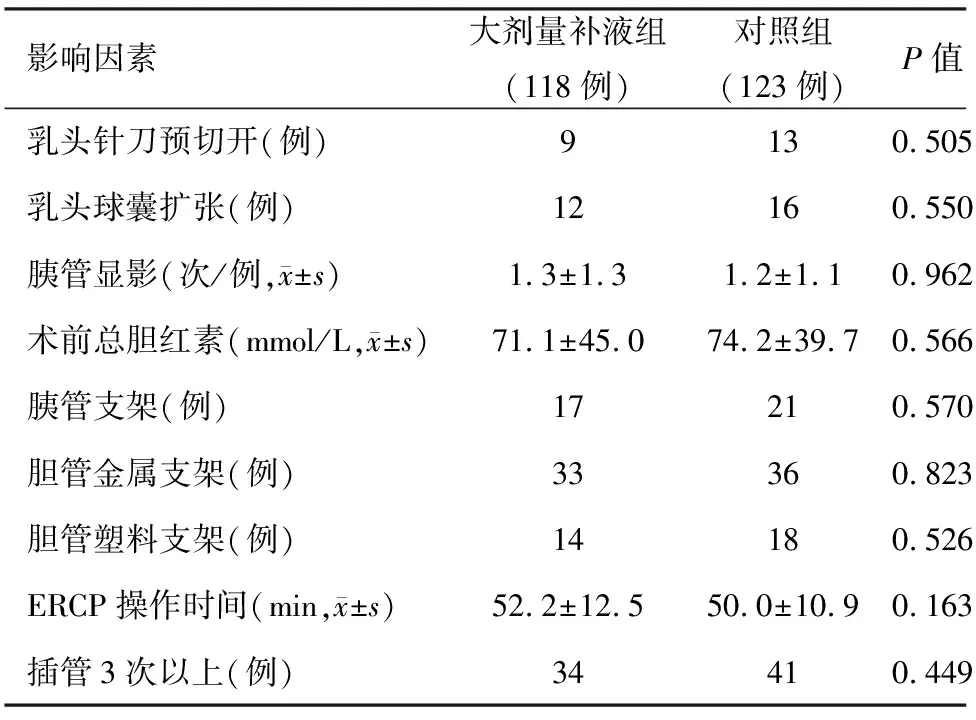
表2 两组患者并发PEP的影响因素比较
4.术后血CRP水平变化及患者平均住院时间:大剂量补液组术后血CRP水平为(15.24±10.69)mg/L,显著低于对照组的(26.79±25.76)mg/L,差异有统计学意义(P=0.001)。
大剂量补液组患者平均住院时间为(5.3±1.3)d,较对照组的(6.97±1.93)d显著缩短,差异有统计学意义(P=0.001)。
5.并发症和不良事件: 1例胆管下段癌因术中插管困难并发胆道穿孔转外科行胆肠吻合手术治疗,3例术中乳头切开后出血量大,经积极内科非手术治疗好转,这4例均退出研究。对照组中2例术后12 h出现腹胀、腹痛明显,CT示腹腔积液,胰腺肿大渗出,提示重症胰腺炎,经相应处理后好转出院。所有患者均无其他并发症或不良事件。
讨论Cotton等[5]通过对15 000例接受ERCP治疗患者的数据分析,建立了PEP的诊断标准。尽管此标准尚不完善,但目前仍是临床最明确和实用的诊断标准[6]。文献报道[7],PEP的发生率为1.0%~15.7%。本研究PEP发生率为4.97%。
为预防PEP的发生,明确发生PEP的危险因素是前提。现已报道,球囊扩张乳头、胰管括约肌切开、乳头括约肌切开、手术操作时间、Oddi括约肌功能障碍、胰管多次显影、年轻患者、术前胆红素浓度高、既往有PEP病史、插管困难等均为PEP发病的危险因素[8]。预防PEP措施主要包括应用非甾体类抗炎药塞肛、胰管支架的置入、选择性插管等操作方法[9-11]。
文献报道,AP大鼠出现微血管的灌注不足,导致组织缺氧、坏死[12]。临床研究结果也显示,AP患者血细胞高度浓缩和容量不足预示着胰腺发生坏死和预后不良[3]。这些结果均证明液体复苏在AP治疗中起着重要的作用。AP早期液体复苏治疗可以减轻AP时的全身炎症反应、降低并发症的发生率、缩短患者的住院时间[13]。Pandol等[14]认为,液体复苏能通过改善组织的灌注,加强器官的供氧从而减轻胰腺细胞、组织和器官的损伤。Wu等[15]通过随机对照实验发现,林格液能有效避免机体内环境酸中毒状态从而减轻AP的严重程度。Kellum等[16]报道林格液在代谢性酸中毒环境中能参与巨噬细胞等多种免疫细胞及免疫因子的调节,从而激活免疫系统。
虽然PEP的发生机制与AP不完全相同,但Sashidhar等[4]通过回顾性队列研究发现ERCP术后并发轻度PEP患者的围手术期输注液体量明显大于并发中、重度PEP患者;未住院的ERCP患者更易并发中、重度PEP而再次入院,考虑PEP的发生可能与术后补液量少有关。 Elmunzer等[17]报道,39例ERCP患者术后8 h内给予3 ml·kg-1·h-1的林格液补液患者的PEP发生率显著低于给予1.5 ml·kg-1·h-1的林格液补液患者(0vs4%,P=0.016),表明围手术期补液量与PEP的发生率相关。
本研究结果显示,大剂量补液组与对照组间的患者一般情况(年龄、性别、病种构成比)比较差异无统计学意义;胰管支架置入、胆管金属、塑料支架置入、ERCP操作时间、插管困难等影响PEP发生率的因素比较差异亦无统计学意义。然而,大剂量补液组PEP及HA发生率显著低于对照组。此外,大剂量补液组患者的血CRP水平、平均住院天数均较对照组减少。提示ERCP术前给予大剂量补充电解质液可能成为预防PEP的一种有效方法,并可节省大量的医疗费用,具有临床应用的前景。
因本研究的纳入标准排除了高龄及充血性心力衰竭、慢性肾功能不全患者、应用非甾体类抗炎药塞肛等预防PEP的患者,且研究对象主要为胆总管结石患者及样本量较小,所以需要多中心、大样本且纳入高风险患者为研究对象,进一步评价早期大剂量补液在预防PEP中的价值。
参 考 文 献
[1] Chen B, Fan T, Wang C H. A meta-analysis for the effect of prophylactic GTN on the incidence of post-ERCP pancreatitis and on the successful rate of cannulation of bile ducts[J]. BMC Gastroenterol, 2010,10:85.
[2] Elmunzer BJ, Scheiman JM, Lehman GA, et al. A randomized trial of rectal indomethacin to prevent post-ERCP pancreatitis[J]. N Engl J Med, 2012,366(15):1414-1422.
[3] Muddana V, Whitcomb DC, Khalid A, et al. Elevated serum creatinine as a marker of pancreatic necrosis in acute pancreatitis[J]. Am J Gastroenterol, 2009,104(1):164-170.
[4] Sagi SV, Schmidt S, Fogel E, et al. Association of greater intravenous volume infusion with shorter hospitalization for patients with post-ERCP pancreatitis[J]. J Gastroenterol Hepatol, 2014, 29(6):1316-1320.
[5] Cotton PB, Lehman G, Vennes J, et al. Endoscopic sphincterotomy complications and their management: an attempt at consensus[J]. Gastrointest Endosc, 1991,37(3):383-393.
[6] Artifon EL, Chu A, Freeman M, et al. A comparison of the consensus and clinical definitions of pancreatitis with a proposal to redefine post-endoscopic retrograde cholangiopancreatography pancreatitis[J]. Pancreas, 2010,39(4):530-535.
[7] Anderson MA, Fisher L, Jain R, et al. Complications of ERCP[J]. Gastrointest Endosc, 2012,75(3):467-473.
[8] 徐晓丹, 戴建军, 钱建清, 等. 十二指肠乳头括约肌切开取石术后胰腺炎的预测因素[J]. 中华胰腺病杂志, 2011,11(3):214-215.
[9] 钱建清, 戴建军, 王卫军, 等. 吲哚美辛对内镜下逆行性胰胆管造影术后胰腺炎的预防[J]. 中华胰腺病杂志, 2011,11(5):326-328.
[10] Cennamo V,Fuccio L,Zagari RM,et al.Can a wire-guided cannulation technique increase bile duct cannulation rate and prevent post-ERCP pancreatitis?:A meta-analysis of randomized controlled trials[J].Am J Gastroenterol,2009,104(9):2343-2350.
[11] Mazaki T, Masuda H, Takayama T. Prophylactic pancreatic stent placement and post-ERCP pancreatitis: a systematic review and meta-analysis[J]. Endoscopy, 2010,42(10):842-853.
[12] Kusterer K, Enghofer M, Zendler S, et al. Microcirculatory changes in sodium taurocholate-induced pancreatitis in rats[J]. Am J Physiol, 1991,260(2 Pt 1):G346-G351.
[13] Fisher JM, Gardner TB. The "golden hours" of management in acute pancreatitis[J]. Am J Gastroenterol, 2012,107(8):1146-1150.
[14] Pandol SJ, Saluja AK, Imrie CW, et al. Acute pancreatitis: bench to the bedside[J]. Gastroenterology, 2007,132(3):1127-1151.
[15] Wu BU, Hwang JQ, Gardner TH, et al. Lactated Ringer′s solution reduces systemic inflammation compared with saline in patients with acute pancreatitis[J]. Clin Gastroenterol Hepatol, 2011,9(8):710-717.
[16] Kellum JA, Song M, Li J. Lactic and hydrochloric acids induce different patterns of inflammatory response in LPS-stimulated RAW 264.7 cells[J]. Am J Physiol Regul Integr Comp Physiol, 2004,286(4):R686-R692.
[17] Buxbaum J, Yan A, Yeh K, et al. Aggressive hydration with lactated ringer′s solution reduces pancreatitis after endoscopic retrograde cholangiopancreatography[J]. Clin Gastroenterol Hepatol, 2014,12(2):303-307.

