急性坏死性胰腺炎大鼠Ghrelin表达的变化及GHRP-2对其的影响
梁志海 唐国都 方春芸 覃蒙斌
重症急性胰腺炎(server acute pancreatitis, SAP)患者早期病情变化迅速、病死率高,虽然近年SAP的治疗手段有很大进步,但寻找早期干预疾病进程、减少疾病重症化仍是本领域的研究热点之一。生长激素释放肽-2(growthhormone releasing peptides,GHRP-2)是ghrelin受体激动剂,它可以减轻肝脏炎症、急性肺损伤[1-2],而且外源性ghrelin对急性胰腺炎(acute pancreatitis, AP)的炎症反应有抑制作用[3],但内源性ghrelin与AP发病机制的关系未明确。本研究观察GHRP-2干预急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)大鼠后内源性ghrelin表达的变化。
一、材料与方法
1.实验动物及分组:健康雄性SD大鼠,12周龄,体质量250~350 g,清洁级,购自广西医科大学实验动物中心。按数字表法随机分为假手术组、ANP组、GHRP-2组,每组30只。大鼠造模前禁食12 h,自由饮水。采用胆胰管逆行注射2%牛磺胆酸钠(日本TCI公司)1 ml/kg体质量的方法制备ANP模型。GHRP-2组在制模前30 min给予腹腔注射GHRP-2(杭州中肽公司)200 g/kg体质量;ANP组制模前30 min注射等容积生理盐水。对照组仅剖腹翻动胰腺。术后3、6、12、24、48 h分批处死大鼠,每时点每组处死6只。采血分离血清,置-80℃冰箱保存备用。取胰腺组织,部分放入RNA保存液(广州东盛公司)中置液氮保存备用,部分用10%甲醛液固定。
2.胰腺组织病理学检查及评分:固定的胰腺组织常规切片、HE染色。由病理科医师盲法读片,并参考Schmit标准[4]从水肿、出血、坏死、炎症4个项目进行评分,每个项目由轻到重共分5级,分别计0~4分,4个项目评分之和作为总的病理评分,最高16分。
3.血清淀粉酶活性检测:送广西医科大学第一附属医院检验科使用全自动生化分析仪检测。
4.血清ghrelin、IL-1β水平检测:采用ELISA法检测。ghrelin试剂盒购自武汉华美公司,IL-1β试剂盒购自杭州联科公司,按说明书操作。
5.胰腺组织ghrelin mRNA检测:采用实时荧光定量PCR法检测胰腺组织ghrelin mRNA表达。ghrelin引物序列:上游5′-CAGAAAGCCCAGCAGAGAAAGG-3′,下游5′-GCCAACATCGAAGGGAGCAT-3′,产物153 bp;内参β-actin引物序列:上游5′-CCCATCTATGAGGGTTACGC-3′,下游5′-TTTAATGTCACGCACGATTTC-3′,产物150 bp。引物由上海生工生物工程有限公司合成。取液氮保存的胰腺组织,先用液氮研磨粉碎组织,按总RNA小量制备试剂盒(美国Axygen公司)提供的方法提取总RNA,按逆转录反应试剂盒(美国Fermentas 公司)的说明书进行逆转录获得cDNA。取其中一个样本的cDNA按1∶4的稀释比例等比稀释,上荧光定量PCR仪扩增。PCR反应条件:95℃ 10 min,95℃ 15 s,40个循环,60℃ 1 min。由仪器自带软件分析数据,绘制标准曲线。所绘制的标准曲线R2均>0.99,扩增效率为90%~110%。按上述体系以及反应条件分别测定待测样本的Ct值,采用公式2-△△Ct计算ghrelin mRNA的表达量。
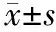
二、结果
1.胰腺组织病理改变:对照组大鼠胰腺组织无明显变化。ANP组在腹腔内可见淡黄色腹水、鼓肠、腹腔脏器粘连、出现皂化斑;胰腺坏死,部分呈胶冻状,部分有暗红色出血样改变。光镜下见胰腺组织水肿、炎症、出血、坏死,程度较轻者见胰腺腺泡、间质水肿,少量炎症细胞浸润;较重者见胰腺凝固性坏死、腺小叶结构消失;胰腺实质内、小叶间有大量中性粒细胞、淋巴细胞浸润以及出血。GHRP-2组大鼠的胰腺组织病理改变与ANP组无明显差异。ANP组、GHRP-2组大鼠的胰腺病理评分均显著高于对照组,差异有统计学意义(P值均<0.01),而GHRP-2组与ANP组间胰腺组织病理评分差异无统计学意义(表1)。
2.血清淀粉酶、ghrelin、IL-1β水平的变化:除48 h点外,ANP组各时点血淀粉酶活性均显著高于对照组(P<0.05或<0.01);除24 h点外,GHRP-2组各时点血淀粉酶活性均显著高于对照组(P<0.05或<0.01)。但ANP组与GHRP-2组间差异无统计学意义(表1)。
ANP组6、12、48 h点血清ghrelin水平显著高于对照组(P<0.05或<0.01);GHRP-2组3、12、48 h点血清ghrelin水平显著高于对照组(P<0.05或<0.01),3 h点的ghrelin水平显著高于ANP组(P<0.05,表1)。
ANP组3、6 h点血清IL-1β水平显著高于对照组(P值均<0.05);GHRP-2组3、6 h点血清IL-1β水平显著低于ANP组(P值均<0.05),其他时点两组与对照组差异无统计学意义(表1)。
血清ghrelin水平与血清IL-β水平、胰腺组织水肿及炎症细胞浸润评分、病理总评分均呈正相关(r值分别为0.355、0.229、0.330、0.292,P<0.05或<0.01)。
3.胰腺组织ghrelin mRNA表达的变化:ANP组6、12、24 h点胰腺组织ghrelin mRNA表达显著高于对照组(P<0.05或<0.01,表1);GHRP-2组24 h点胰腺组织ghrelin mRNA表达显著高于对照组(P<0.05),其他各时点无显著差异;GHRP-2组与ANP组间差异无统计学意义。
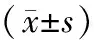
表1 各组大鼠各项检测指标比较
讨论GHRP-2是一种人工合成的小分子多肽,是ghrelin的受体激动剂,具有抗氧化应激、抗炎等功能。Kato等[5]报道,GHRP-2可以提高心肌组织谷胱甘肽/氧化型谷胱甘肽的比值,同时改善实验动物的左心室功能。体外实验还发现,GHRP-2对氧化修饰型低密度脂蛋白诱导的动脉平滑肌细胞氧化应激也有抑制作用[6]。新近研究结果显示,GHRP-2对脂多糖(LPS)引起的肝损伤有保护作用,作用机制可能与同时降低肝细胞TNF-α表达和提高IGF-1 mRNA表达有关[1]。在LPS注射引起的肺损伤研究中,GHRP-2预处理可以减少LPS引起的炎症介质释放、中性粒细胞浸润,从而改善实验动物的氧合能力[2]。因此,GHRP-2有可能通过抗氧化应激、抑制炎症反应的途径对疾病发展有保护作用。
Ghrelin在炎症反应中的保护作用已经在多项研究中得到证实。在AP、急性肾损伤实验研究中,外源性ghrelin干预可以使实验动物的炎症反应减轻[3, 7-9],还可以抑制脓毒症引起的炎症反应和多器官功能障碍[10],其机制可能与NF-κB、促分裂素原活化蛋白激酶(mitogen-activated protein kinases, MAPK)等信号通路有关[7,9,11]。
本研究结果显示,血清IL-1β水平在制模后3 h达峰值,然后逐渐到正常水平,提示ANP大鼠早期炎症反应最明显。制模后,ANP组、GHRP-2组大鼠血清ghrelin逐渐升高,在12 h达峰值,且血清ghrelin水平与血清IL-1β水平、胰腺组织的病理损伤呈正相关,与Dembinski等[12]采用雨蛙肽诱导的AP动物模型结果类似,可作为预测AP严重程度的指标。此外,ANP组大鼠胰腺组织ghrelin mRNA表达显著高于对照组,提示胰腺组织ghrelin mRNA表达上调也是ANP发病的早期事件。制模前应用GHRP-2干预ANP大鼠,结果显示GHRP-2组大鼠血清IL-1β水平较ANP组下降,血清ghrelin水平仅在制模后3 h高于ANP组,其他各时点均无显著差异;而且胰腺组织病理评分、胰腺组织ghrelin mRNA表达均与ANP组无显著差异,表明GHRP-2干预虽然在AP发病早期发挥一定的抗炎作用,同时引起血ghrelin水平升高,但对ANP胰腺的ghrelin mRNA表达无影响,也不足以改善ANP胰腺的病理损伤。这可能与ghrelin在胰腺外分泌腺泡细胞的表达量不高有关[13]。因此,GHRP-2干预ANP大鼠是否具有应用前景尚待探讨。
参 考 文 献
[1] Granado M, Martin AI, Lopez-Menduina M, et al. GH-releasing peptide-2 administration prevents liver inflammatory response in endotoxemia[J]. Am J Physiol Endocrinol Metab,2008,294(1): E131-141.
[2] Li G, Li J, Zhou Q, et al. Growth hormone releasing peptide-2, a ghrelin agonist, attenuates lipopolysaccharide-induced acute lung injury in rats[J]. Tohoku J Exp Med,2010,222(1):7-13.
[3] Dembinski A, Warzecha Z, Ceranowicz P, et al. Ghrelin attenuates the development of acute pancreatitis in rat[J]. J Physiol Pharmacol,2003,54(4):561-573.
[4] Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy[J]. Ann Surg,1992,215(1):44-56.
[5] Kato Y, Iwase M, Ichihara S, et al. Beneficial effects of growth hormone-releasing peptide on myocardial oxidative stress and left ventricular dysfunction in dilated cardiomyopathic hamsters[J]. Circ J,2010,74(1):163-170.
[6] Titterington JS, Sukhanov S, Higashi Y, et al. Growth hormone-releasing peptide-2 suppresses vascular oxidative stress in ApoE-/- mice but does not reduce atherosclerosis[J]. Endocrinology,2009,150(12):5478-5487.
[7] Zhou X, Xue C. Ghrelin inhibits the development of acute pancreatitis and nuclear factor kappaB activation in pancreas and liver[J]. Pancreas,2009,38(7):752-757.
[8] Wang W, Bansal S, Falk S, et al. Ghrelin protects mice against endotoxemia-induced acute kidney injury[J]. Am J Physiol Renal Physiol,2009,297(4):F1032-F1037.
[9] Peng Z, Zhu Y, Zhang Y, et al. Effects of ghrelin on pulmonary NOD2 mRNA expression and NF-κB activation when protects against acute lung injury in rats challenged with cecal ligation and puncture[J]. Int Immunopharmacol,2012,13(4):440-445.
[10] Cheyuo C, Jacob A, Wang P. Ghrelin-mediated sympathoinhibition and suppression of inflammation in sepsis[J]. Am J Physiol Endocrinol Metab,2012,302(3):E265-E272.
[11] Jacob A, Rajan D, Pathickal B, et al. The inhibitory effect of ghrelin on sepsis-induced inflammation is mediated by the MAPK phosphatase-1[J]. Int J Mol Med,2010,25(1):159-164.
[12] Dembinski A, Warzecha Z, Ceranowicz P, et al. Role of growth hormone and insulin-like growth factor-1 in the protective effect of ghrelin in ischemia/reperfusion-induced acute pancreatitis[J]. Growth Horm IGF Res,2006,16(5-6):348-356.
[13] Lai KC, Cheng CH, Leung PS. The ghrelin system in acinar cells: localization, expression, and regulation in the exocrine pancreas[J]. Pancreas,2007,35(3):e1-e8.

