胰腺导管内管状乳头状肿瘤三例临床病理学特征
陈颖 陈星晔 朱明华
胰腺导管内管状乳头状肿瘤(intraductal tubulopapillary neoplasm, ITPN)是一种少见类型的胰腺外分泌部肿瘤。2010版WHO消化系统肿瘤分类将其列为胰腺上皮源性肿瘤的新类型,与导管内黏液性乳头状肿瘤(intraductal papillary mucinous tumor, IPMT)同属于胰腺导管内肿瘤。ITPN在正式被命名之前一直都被诊断为IPMT。但这两种类型的导管内肿瘤从大体形态、镜下改变以及免疫表型上都存在较大差异。本研究报道3例ITPN的临床资料、病理学参数,并综合文献报道的16例,从形态学、免疫表型上与IPMT加以比较,以提高对ITPN的认知度。
材料和方法
一、临床资料
收集2008年至2011年上海长海医院病理诊断为“胰腺导管内乳头状黏液性肿瘤”的84例患者的临床资料,并对组织标本重新切片行病理组织学检查,其中3例修正诊断为ITPN。3例患者均为男性,年龄分别为24、43、64岁,中位年龄43岁。2例肿瘤位于胰头部,1例位于胰体部。3例ITPN患者血清肿瘤标志物CEA、CA19-9和AFP均在正常范围内,CT检查表现为胰管不规则扩张,临床诊断为“IPMT”。其余81例仍诊断为IPMT,其中男性57例,女性24例,年龄17~78岁,中位年龄60岁。62例肿瘤位于胰头部,19例位于胰体尾部。
二、肿瘤细胞免疫表型检测
采用常规Envision二步法免疫组化染色检测细胞的免疫表型。细胞内出现棕黄色颗粒为阳性信号。使用的抗体及稀释浓度见表1。
三、K-ras基因突变检测
采用荧光PCR法检测肿瘤细胞的K-ras基因突变。人类K-ras基因7种突变检测试剂盒(ADx-KR01)购自厦门艾德生物医药科技有限公司,按试剂盒说明书操作。
结 果
一、ITPN的临床表现
综合长海医院3例、Yamaguchi等[1]报道的10例及常晓燕等[2]报道的6例ITPN患者资料,19例患者中男性10例,女性9例,年龄23~73岁。临床表现为腹痛10例,黄疸2例,腹部不适1例,糖尿病症状加重1例,无明显症状5例。肿块位于胰头部11例,胰体部4例,胰头体部1例,胰体尾部1例,全胰2例。9例检测CA19-9,其中2例升高。13例记录肿瘤大小,最大径1~15 cm。
二、ITPN的临床病理学特征
长海医院3例ITPN的肿瘤组织主要表现为导管内高度增生的结节,绝大部分为背靠背腺管样及筛孔样排列,乳头结构少见,有的腺腔内面可见类似顶浆分泌样的分泌物,有的瘤巢中央可见粉刺样坏死(图1a);细胞为立方形,核深染,可见核仁,呈中至重度异型增生改变(图1b),胞质可轻度嗜酸或嗜碱性,细胞内没有明确的黏液分泌,部分区域可见胞质透亮改变(图1c)。1例可见导管周围浸润性导管腺癌成分,并伴有胰腺周围淋巴结转移(图1d)。
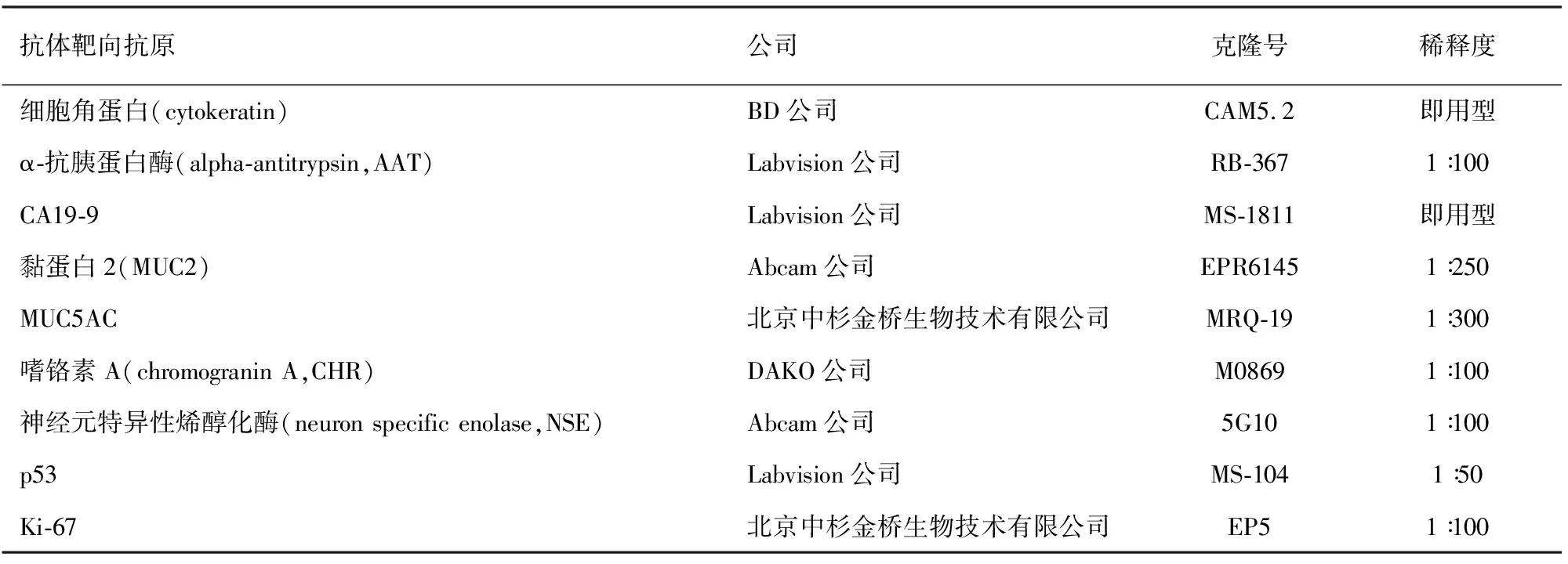
表1 免疫组化所用抗体
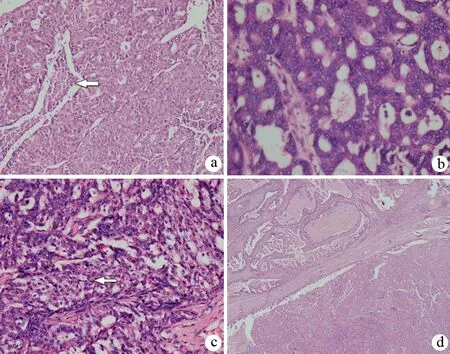
图1 ITPN的病理学特征(HE ×100,×400,×200,×40)
三、IPMT的临床病理学特征
IPMT肿瘤组织主要于导管内呈乳头状排列,乳头分支比较复杂,常常交错,可见筛孔结构。大部分细胞为黏液上皮或含较多杯状细胞(肠型),少部分为嗜酸性上皮(嗜酸细胞型)和立方上皮(胰胆管型)。
根据2010版WHO消化系统肿瘤分类的描述,81例IPMT中34例肿瘤细胞排列成分支乳头状结构,细胞核靠近基底部,为低级别上皮内瘤变(图2a),14例为高级别上皮内瘤变(图2b),33例伴有明确的浸润性癌成分,其中17例浸润成分为导管腺癌,16例为浸润性胶样癌。
四、ITPN的免疫表型及K-ras基因突变
本组3例结合文献报道的16例中10例(6例无免疫组化详细结果)ITPN的免疫表型见表2。肿瘤细胞均阳性表达上皮标志物细胞角蛋白(cytokeratin);部分肿瘤细胞p53阳性表达;神经内分泌标志物CHR、NSE及黏蛋白家族中的MUC2、MUC5AC均阴性表达。
本组3例结合文献报道的16例共19例检测K-ras基因,仅2例出现突变,分别为12号密码子的GGT>GAT、35G>T和34G>A位点[2]。
五、ITPN与IPMT的临床病理参数比较
13例ITPN(本组3例及文献报道的10例)和81例IPMT患者均以男性患者居多,发病年龄相近,肿瘤多位于胰头部,临床症状比较相似,但病理形态学特征不同(表3)。
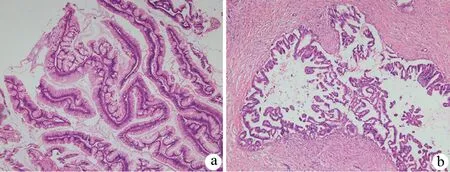
图2 IPMT的组织病理学特征(HE ×100,×40)
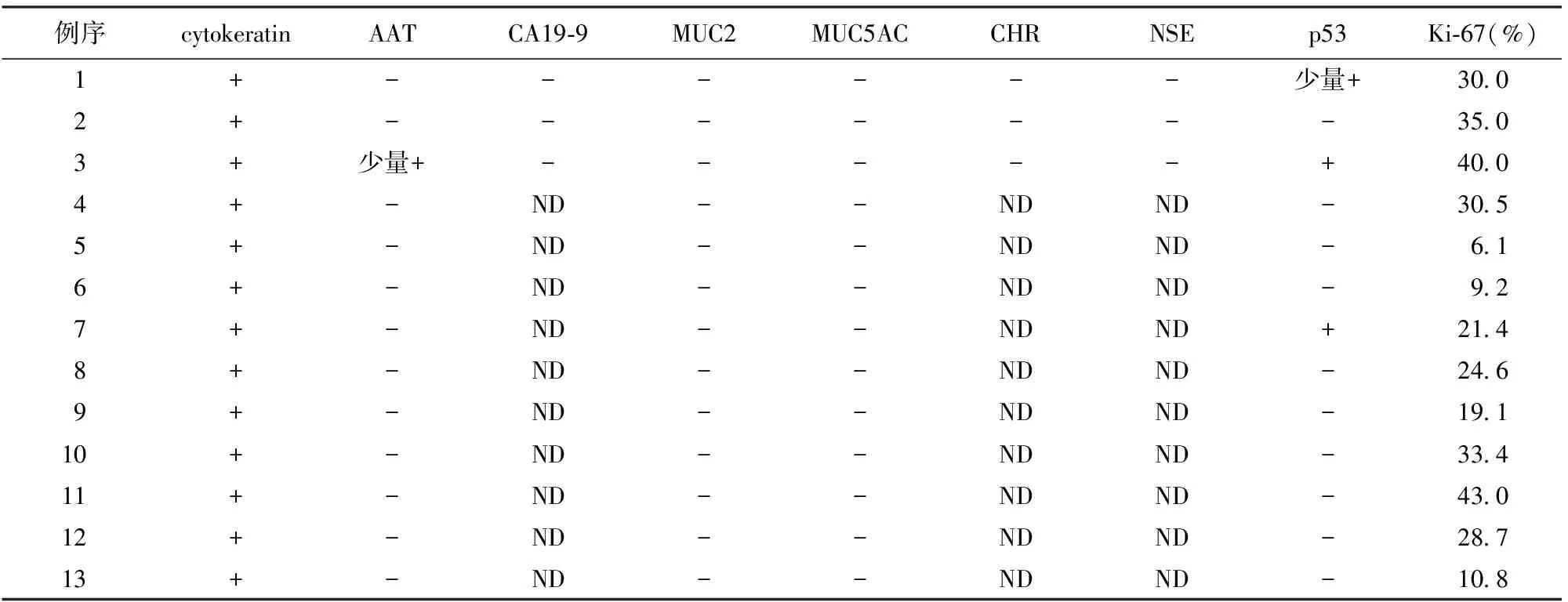
表2 ITPN的免疫表型
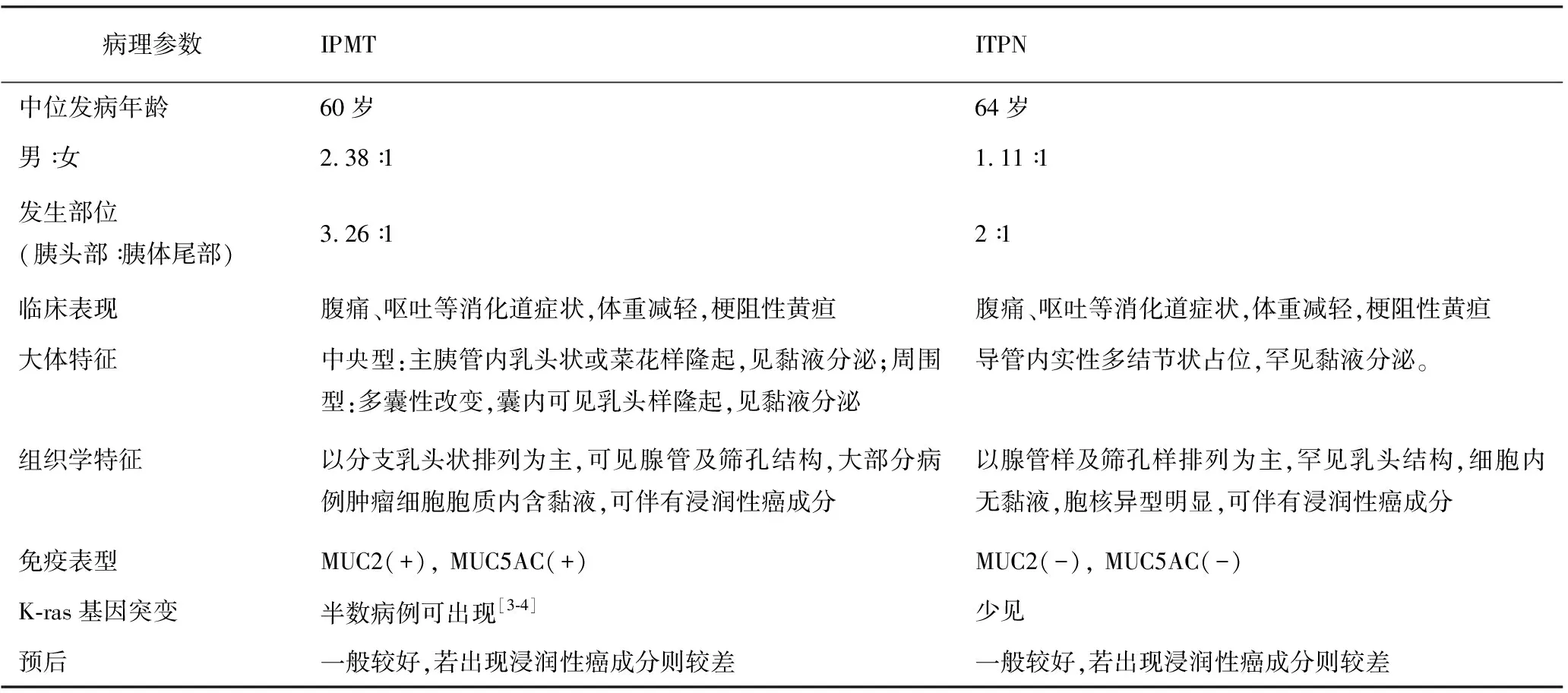
表3 ITPN与IPMT的临床病理参数比较
讨 论
ITPN是一类少见的胰腺肿瘤。2010新版WHO消化系统肿瘤分类将其单独列为一种胰腺导管内生长的上皮源性肿瘤[3]。根据本组及文献报道,ITPN患者发病中位年龄为64岁,男性稍多见,临床症状无特异性;肿瘤多位于胰头部,肿瘤标志物CEA、CA19-9和AFP均在正常范围;影像学检查表现为胰管不规则扩张。肿瘤位于导管内,呈实性多结节状占位,罕见黏液分泌。镜下呈腺管样及筛孔样排列为主,间质稀少,罕见乳头结构;胞核异型明显,胞内无黏液;多为高级别上皮内瘤变,可伴浸润性癌成分(以导管腺癌成分为主)及淋巴结转移;肿瘤细胞均表达上皮标志物,部分肿瘤细胞p53阳性表达,神经内分泌标志物及黏蛋白表达均阴性;少见K-ras基因突变。
ITPN最主要是与IPMT的鉴别诊断。IPMT可源自主胰管或分支胰管,其主要的形态学特征就是导管扩张明显,细胞成乳头状和腺管状排列,腔内见较多黏液。上皮成分可以为胃型黏液上皮、胰胆管型上皮、肠型上皮或嗜酸性上皮。根据上皮细胞的异型程度分为轻、中、重度,根据有无间质浸润分为浸润性和非浸润性。其中浸润性IPMT中最多见的浸润成分为黏液性非囊性癌或“胶样癌”,其次为导管腺癌。
根据两者的肿瘤细胞排列形式,是否分泌黏液,细胞异型程度基本可以对ITPN和IPMT进行鉴别诊断。Ahls等[4]首次报道了一例具有透明细胞形态的ITPN,表达CK8/18、CK7、CD10、MUC1和MUC6,而MUC2和MUC5AC阴性,经淀粉酶消化的PAS染色阴性,腺泡细胞和神经内分泌标志物均为阴性。除了细胞胞质透亮,从组织形态、免疫表型和分子病理学特征都符合ITPN的特点。
ITPN和IPMT的细胞免疫表型也各具特点,主要为黏蛋白类型的表达差异。ITPN通常不表达MUC2(肠型IPMT)和MUC5AC,部分肿瘤可表达MUC1、MUC6[5]、Fascin[1]。而IPMT通常表达MUC2和MUC5AC。
ITPN的K-ras基因突变较少见,是低频的分子事件;而胰腺PanIN病变及约50%的IPMT可出现K-ras基因的突变[5-6]。
总之,ITPN与IPMT从大体改变、形态学特征、免疫表型和分子病理学等方面均有所不同,属于独立的病理学类型。
Yamaguchi等[1]报道10例ITPN,随访7~66个月,仅1例因肿瘤死亡,其余9例均存活,平均20.9个月。常晓燕等[2]随访了6例ITPN患者,随访时间为12~112个月,其中1例于19个月后死于肿瘤,5例仍存活,其中1例84个月后复发。他们认为,浸润性癌的深度超过1 cm,患者出现淋巴结和远处器官转移的概率会显著增加,预后也较差,其临床分期需要参照胰腺癌的分期标准。
参 考 文 献
[1] Yamaguchi H, Shimizu M, Ban S, et al. Intraductal tubulopapillary neoplasms of the pancreas distinct from pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms[J]. Am J Surg Pathol, 2009, 33(8):1164-1172.
[2] 常晓燕,卢朝辉,李星奇,等.胰腺导管内管状乳头状肿瘤的临床病理学分析[J]. 中华病理学杂志,2013,42(4):248-251.
[3] Adsay NV, Kloppel G, Fukushima N, et al. Intraductal neoplasms of the pancreas[M]. 4th ed. Lyon: International Agency for Research on Cancer, 2010.
[4] Ahls MG, Niedergethmann M, Dinter D, et al. Case report: Intraductal tubulopapillary neoplasm of the pancreas with unique clear cell phenotype[J]. Diagnc Pathol, 2014, 9:11.
[5] Schonleben F, Qiu W, Bruckman KC, et al. BRAF and KRAS gene mutations in intraductal papillary mucinous neoplasm/carcinoma (IPMN/IPMC) of the pancreas[J]. Cancer letters, 2007, 249(2):242-248.
[6] Sasaki M, Matsubara T, Nitta T, et al. GNAS and KRAS mutations are common in intraductal papillary neoplasms of the bile duct[J]. PloS one, 2013, 8(12):e81706.

