胰十二指肠切除术后胰瘘发生的危险因素分析
刘巍 花荣 孙勇伟 张军峰 霍砚淼 刘德军 吴志勇
胰十二指肠切除术操作复杂,涉及脏器较多,术后并发症发生率及病死率较高。术后胰瘘是胰十二指肠切除术后最主要的并发症,其发生受多因素影响。本研究回顾性分析因恶性疾病接受胰十二指肠切除术患者的临床资料,分析术后胰瘘发生的危险因素,指导围手术期治疗,为减少术后胰瘘发生提供理论依据。
资料与方法
一、一般资料
2009年9月至2012年9月上海交通大学医学院附属仁济医院普外科共收治352例因癌症行胰十二指肠切除术患者,其中男性242例,女性110例;年龄32~89岁,平均57岁。胰头癌175例,壶腹部癌119例,胆总管下端癌36例,十二指肠乳头癌22例。术前根据美国麻醉师协会分级Ⅰ~Ⅱ级293例,Ⅱ级以上59例。术中消化道重建方式采用捆绑式胰肠吻合119例,胰管空肠黏膜吻合131例,改良Child吻合102例。根据患者术后是否发生胰瘘分为胰瘘组和非胰瘘组进行对列研究。术后胰瘘的诊断依据国际胰瘘研究组制定的标准[1],即术后3 d以上,不论腹腔引流量如何,引流液淀粉酶值超过血淀粉酶值上限3倍。两组一般资料具有可比性。
二、影响术后胰瘘发生可能的危险因素
影响术后胰瘘发生的危险因素包括三大方面:患者因素(性别、年龄、糖尿病病史、术前血清胆红素水平、术前黄疸时间、术前血清白蛋白水平、),胰腺因素(胰腺质地、胰管直径),手术因素(手术时间、术中出血量、是否行血管切除重建、胰管内是否留置支撑管、胰肠吻合时间、消化道重建方式)。
三、统计学处理
结 果
一、影响胰瘘发生的单因素分析
49例患者术后发生胰瘘。单变量分析结果显示,性别、年龄、糖尿病病史、手术时间、术中出血量、是否行血管切除重建、胰管内是否留置支撑管、胰肠吻合时间、消化道重建方式等因素与胰瘘的发生无关(P值均>0.05);而术前血清白蛋白水平、术前血清总胆红素水平、术前黄疸持续时间、胰管直径及胰腺质地是影响胰瘘发生的因素(P值均<0.05,表1)。
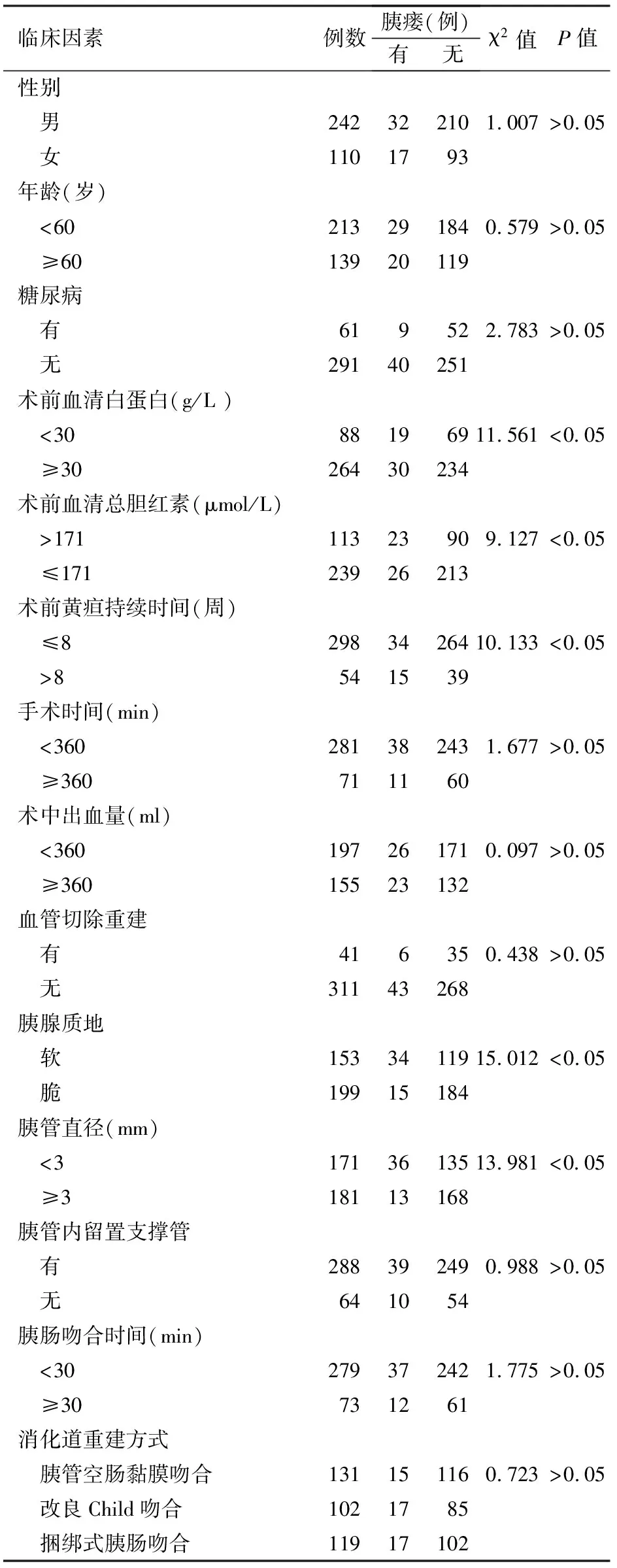
表1 术后发生胰瘘的单因素分析
二、影响胰瘘发生的多因素分析
胰腺质地脆、胰管直径<3 mm、术前血清总胆红素>171 μmol/L、术前黄疸持续时间>8周、术前血清白蛋白<30 g/L是术后发生胰瘘的独立危险因素(OR值分别为5.911、5.748、5.112、5.090、4.464,P值均<0.05,表2)。
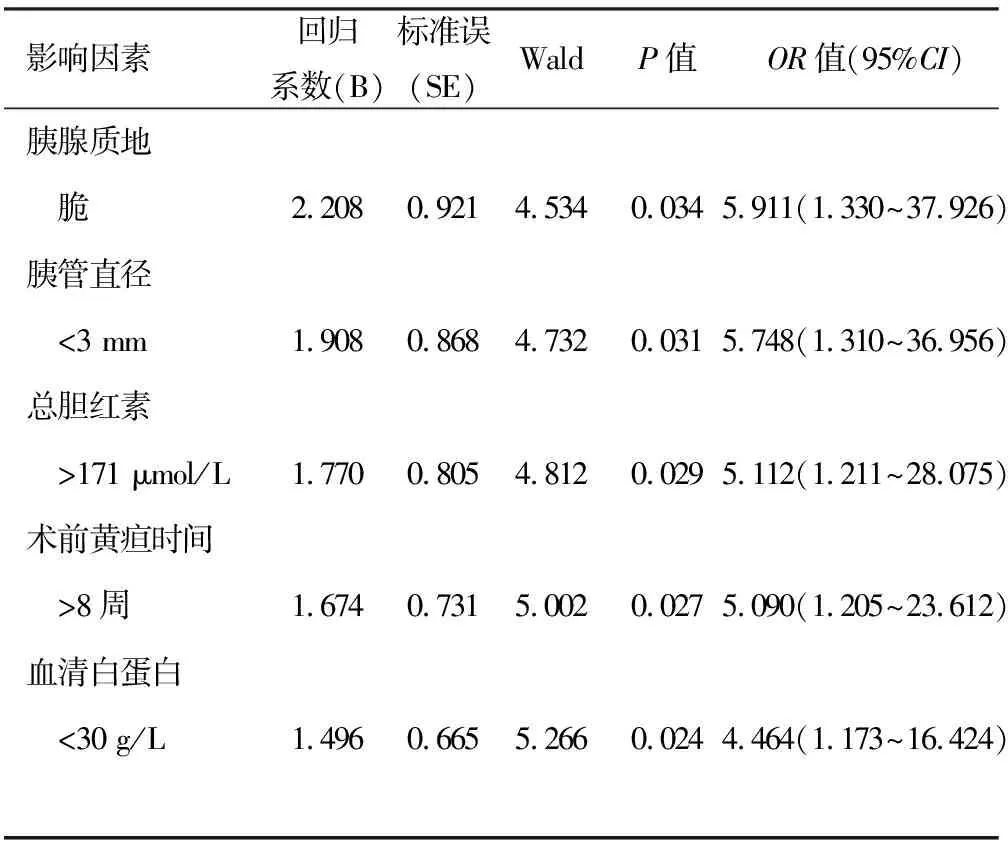
表2 术后发生胰瘘的多因素分析
讨 论
胰腺位于腹膜后,周围毗邻复杂,血管丰富。胰十二指肠切除术一直作为外科重大复杂手术,围手术期死亡率曾经超过5%[2]。术后胰瘘是胰十二指肠切除术后最常见、最严重的并发症,不同医学中心报道胰瘘的发生率差异较大,为5%~30%,这与各中心的胰瘘诊断标准不同有关,严重的胰瘘是导致其他并发症的重要因素[3-4]。一旦发生胰瘘,胆汁和胰液混合进入腹腔,胰酶被激活后感染、腐蚀血管,可发生致命性的大出血。如何有效地减少术后胰瘘是施行胰十二指肠切除术的关键。分析术后发生胰瘘可能的相关危险因素,指导临床工作针对性制定围手术期治疗方案,以达到更显著减少术后胰瘘发生、促进手术成功的目的。
胰腺质地脆及胰管直径细小被公认为是术后发生胰瘘的高危独立因素,本研究也证实了这一点。但本结果表明,消化道吻合方式并没有影响术后胰瘘的发生,这一方面与本医院每年手术量较大、手术技能熟练有关,另一方面与本研究组多年来总结的根据胰腺质地及胰管直径采取的胰肠吻合方式选择策略有关。本研究组采用的胰管空肠黏膜吻合术由于保证了胰管和空肠黏膜的通畅和连续,能较好地保持吻合口的通畅和胰腺外分泌功能,是最符合生理要求的术式。空肠浆膜覆盖在胰腺断面,封闭了胰腺残端,避免胰液对吻合口的腐蚀,减少了胰腺残端出血、感染的概率。但是胰管空肠黏膜吻合并不适合所有的患者。理论上胰管直径越大,实施该术式的安全性越高,然而在实践中即使术者掌握熟练的手术技巧,也需胰管直径≥3 mm才能确保实施胰管空肠黏膜吻合术的质量。对于胰腺质软、胰管较细的患者,胰管空肠黏膜吻合术的实施存在技术困难,无法保证吻合质量,勉强实施反而可能增加术后胰瘘的发生[5]。因此,胰管直径<3 mm时不建议行胰管空肠黏膜吻合。传统观点认为,增加胰肠吻合缝合层数能减少胰瘘,但事实证明由于过多地缝合、切割胰腺组织,更易出现针眼处的胰液渗漏。捆绑式胰肠吻合最大优点在于“以捆代缝”。胰腺断端与空肠黏膜的缝合,不穿透浆肌层,无针孔外漏,胰腺残端套入空肠浆肌鞘,利于迅速愈合,将空肠浆肌层与胰腺断端捆绑可消除空肠与胰腺之间的间隙,使胰液不能渗入间隙[6]。不足之处在于捆绑式胰肠吻合不适用于胰腺残端过大的病例[7]。当胰腺残端过于粗大,往往胰腺质地也相对较软、胰管直径无明显扩张,选择适应性最强的改良Child胰肠吻合法是最明智的。本研究的结果显示,这种吻合方式同样可以保证术后较低的胰瘘发生率。根据患者不同的胰腺条件作出良好的胰肠吻合方式决策对于减少术后胰瘘的发生具有积极作用。
本研究结果显示,术前总胆红素水平、术前黄疸持续时间及术前血清白蛋白水平是影响术后胰瘘发生的因素。术前黄疸持续时间愈长肝功能损害愈重。有学者认为,术前重度黄疸患者即使应用维生素K1改善凝血功能,体内内毒素的吸收引起肝脏及全身多器官病理生理损害也容易导致胰瘘发生[8]。围手术期低蛋白血症是导致伤口感染、腹腔感染以及术后胰瘘及死亡的危险因素[9]。为降低术后胰瘘的发生,本研究组认为应采取以下措施:(1)对于营养状态较差的患者,围手术期充分补充人体白蛋白,使其高于正常值水平。(2)黄疸持续时间较长者需行经皮经肝胆管引流术(percutaneous transhepatic cholangial drainage, PTCD)或内镜下鼻胆管引流术(endoscopic nasobiliary drainage, ENBD)引流,同时使用维生素K1及纠正内毒素血症,改善肝功能和整体功能状态。(3)行捆绑式胰肠吻合时游离胰腺残端的长度宜>3 cm,使胰腺套入空肠的距离足够3 cm。(4)行胰肠捆绑式吻合时要注意捆绑空肠和胰腺的力度,切勿一味追求捆绑严实而用力过度造成胰腺切割或造成胰腺残端缺血。(5)胰瘘的发生与术者经验亦存在相关性。充分暴露视野,无张力、适宜的吻合针距,良好血供及胰腺断面的覆盖等是保证胰肠吻合质量的重要因素[10]。 McPhee等[2]研究结果表明,高通量医疗单位(>18例/年)的手术并发症显著低于低通量医疗单位。这一结果反映术者经验仍然是决定胰瘘发生率的重要因素[11]。(6)引流液检查未发现胰瘘且对手术过程中胰肠吻合满意者应早期拔出引流管。一旦发生胰瘘,为确保引流管的通畅,必要时在影像学定位下重新穿刺置管,避免胰液积聚,继发腹腔感染及腹腔出血。
因此,术前准确、全面地评价相关危险因素有助于采取措施减少术后胰瘘的发生;术者根据自身的经验及患者胰腺条件选择合适的吻合方式是减少术后胰瘘发生的重要环节。
参 考 文 献
[1] Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition[J]. Surgery,2005,138(1):8-13.
[2] McPhee JT, Hill JS, Whalen GF, et al. Perioperative mortality for pancreatectomy: a national perspective[J]. Ann Surg,2007,246(2):246-253.
[3] Daskalaki D, Butturini G, Molinari E, et al. A grading system can predict clinical and economic outcomes of pancreatic fistula after pancreaticoduodenectomy: results in 755 consecutive pantients[J]. Lanenbecks Arch Surg,2011,396(1):91-98.
[4] Ansorge C, Strommer L, Andren-Sandberg A, et al. Structured intraoperative assessment of pancreatic gland characteristics in predicting complications after pancreaticoduodenectomy[J]. Br J Surg,2012,99(8):1076-1082.
[5] Peng SY, Mou YP, Cai XJ, et al. Binding pancreaticojejunostomy is a new technique to minimize leakage[J]. Am J Surg,2002,183(3):283-285.
[6] Buc E,Flamein R,Golffier C,et al.Peng′s binding pancreaticojejunostomy after pancreaticoduodenectomy:a French prospective study[J].J Gastrointest Surg,2010,14(4):705-710.
[7] Butturini G, Daskalaki D, Molinari E, et al. Pancreatic fistula: definition and current problems[J].J Hepatobiliary Panereat Surg,2008,15(3):247-251.
[8] Fernandez-Cruz L, Belli A, Acosta M, et al. Which is the best technique for pancreaticoenteric reconstruction after pancreaticoduodenectomy?A critical analysis[J].Surg Today,2011,41(6):761-766.
[9] Choe YM, Lee KY, Oh CA, et al. Risk factors affecting pancreatic fistulas after pancreaticoduodenectomy[J]. World J Gastroenterol,2008,14(45):6970-6974.
[10] Osada S, Imai H, Sasaki Y, et al. Reconstruction method after pancreaticoduodenectomy. Idea to prevent serious complications[J]. JOP,2012,13(1):1-6.
[9] Goh BK, Tan YM, Chung YF, et al. Critical appraisal of 232 consecutive distal pancreatectomies with emphasis on risk factor,outcome,and management of the postoperative pancreatic fistula: a 21-year experience at a single institution[J]. Arch Surg,2008,143(10):956-965.
[10] Adams DB. The pancreatic anastomosis:the danger of a leak, which anastomotic technique is better[J]? J Gastrointest Surg,2009,13(7):1182-1183.
[11] Kawai M, Yamaue H. Analysis of clinical trials evaluating complications after pancreaticoduodenectomy: a new era of pancreatic surgery[J]. Surg Today,2010,40(11):1011-1017.

