山楂承气汤对高脂血症性胰腺炎大鼠肠道屏障功能障碍的治疗作用
陈亚峰 田继云 谢金昆 王康 李红昌 孔娉婷 樊信娟 涂佳敏 潘丽芸 张晓芬 孙桂芳 奉典旭
近年来,高脂血症性急性胰腺炎(hyperlipidemic acute pancreatitis,HAP)作为临床常见的急腹症发生率越来越高。HAP患者早期极易发生微循环障碍和肠道功能障碍,后期胰腺脓肿及假性囊肿等并发症发生率也较高[1]。研究表明,毛细血管渗漏是HAP肠道功能障碍发病机制中十分重要的一环。连接黏附分子(junctional adhesion molecules, JAMs)位于内皮细胞连接处,在细胞通透性中起重要作用。然而HAP时JAM-C表达的状况及其与毛细血管通透性的关系尚不清楚。目前,临床上通过胃管注入山楂承气汤治疗急性胰腺炎患者可显著改善症状,缓解病情,减少并发症发生。本研究应用山楂承气汤干预高脂血症性急性坏死性胰腺炎(hyperlipidemic acute necrotizing pancreatitis,HANP)大鼠,观察其对肠壁组织JAM-C表达及毛细血管内皮屏障的影响。
材料与方法
一、实验动物及分组
雄性SD大鼠120只,清洁级,体质量(80±10)g,购自上海西普尔-必凯实验动物有限公司,生产许可证号为SCXK(沪)2003-0002。按数字表法随机分为高脂血症(HL)组、HANP组、辛伐他汀治疗组、山楂承气汤治疗组,每组30只。所有大鼠均先经高脂饲料喂养4周,并称重,禁食过夜后采用Takahashi等[2]和王亚军等[3]方法经股静脉注入Triton WR1339 400 mg/kg体质量以诱导高胆固醇、高三酰甘油血症。6 h后HL组大鼠不做处置。其余3组采用Kimura等[4]的方法于腹腔内注射雨蛙素50 μg/kg体质量,间隔1 h,连续4次,并在第1次注射雨蛙素后6 h腹腔内注射脂多糖(LPS)30 mg/kg体质量制备HANP模型。辛伐他汀组于HANP制模前2 h,制模后2、4、12 h分别用辛伐他汀药液灌胃1次,每次2.6 mg/kg体质量。山楂承气汤组同时间点灌胃1次,每次2 ml。方剂:大黄12 g、厚朴24 g、枳实12 g、芒硝6 g,山楂20 g,最后浓缩成100 ml。制模后(注射脂多糖后)6、12、24 h分批处死大鼠,每个时间点处死8只。处死前1 h经阴茎静脉按1 ml/kg体质量剂量注入2%伊文思蓝染料(EB)。处死后抽取腹主动脉血,离心分离血清,留取回肠部组织。剩余6只脱颈椎处死,不注射EB,但留取血及回肠组织。
二、血清淀粉酶、三酰甘油(TG )、游离脂肪酸(FFA)、JAM-C含量测定
血清淀粉酶活性由本院检验科全自动生化检测仪(INTEGRA 400, COBAS)测定。TG 、FFA、JAM-C含量均采用酶联免疫吸附法(ELISA)检测,按试剂盒说明书操作。
三、肠壁组织病理及超微结构检查
病理检查按常规操作。超微结构检查采用透射电镜观察。
四、肠壁组织毛细血管通透性检查
按照Seria等[5]报道的EB血管外渗法测定。取回肠组织300 mg,匀浆后加入1 ml甲酰胺,置60℃恒温水浴24 h,离心取上清液,检测杯调零,测620 nm处吸光度(A620)值。将EB粉剂倍比稀释后,溶于1%白蛋白溶液,取300 μl,加入1 ml甲酰胺溶液,60℃恒温水浴24 h,检测杯调零,测定各标准浓度的A620值,绘制标准曲线。
五、肠壁组织JAM-C mRNA表达检测
取新鲜冻存的回肠组织,按试剂盒说明抽提总RNA,逆转录为cDNA,行荧光定量PCR(FQ-PCR)法测定JAM-C mRNA表达。JAMC-C正义引物:5′-GCACAAGGAAGACTCTGGGCAA-3′,反义引物5′-ATCACAGCAAGAACAATAAGGA-3′,扩增产物150 bp;内参β-actin 正义引物5′-GAGCTATGAGCTGCCTGACG-3′,反义引物5′-AGCACTTGCGGTCCACGATG-3′,扩增产物410 bp。引物由上海闪晶生物科技公司合成。PCR反应条件:95℃ 10 min,95℃ 15 s、60℃ 1 min,40个循环。由PCR仪自带软件获取Ct值,△Ct值=CtJAM-C-CtGAPDH,采用公式2-△Ct×100%计算mRNA的表达量。
六、统计学处理
结 果
一、血清淀粉酶、TG、FFA、JAM-C水平变化
HANP组、辛伐他汀组血清淀粉酶水平均显著高于HL组(P值<0.05或<0.01),但辛伐他汀组与HANP组间的差异无统计学意义。山楂承气汤组血清淀粉酶水平较HANP组及辛伐他汀组下降,其中12、24 h点与这两组间的差异具有统计学意义(P值<0.05或<0.01)。此外,在24 h点亦较HL组显著下降,差异有统计学意义(P<0.01,表1)。
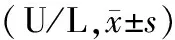
表1 各组大鼠血清淀粉酶含量的变化
HANP组血清TG水平与HL组比较差异无统计学意义。辛伐他汀组和山楂承气汤组血清TG水平均较HANP组显著降低,且山楂承气汤组的下降较辛伐他汀组更显著(P值均<0.01,表2)。
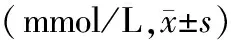
表2 各组大鼠血清TG含量的变化
HANP组血清FFA水平与HL组比较差异无统计学意义。辛伐他汀组和山楂承气汤组血清FFA均较HANP组显著下降,且12、24 h点山楂承气汤组的下降较辛伐他汀组更显著,差异均有统计学意义(P值均<0.01,表3)。
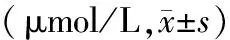
表3 各组大鼠血清FFA含量的变化
HANP组血清JAM-C含量与HL组比较差异无统计学意义。辛伐他汀组血清JAM-C含量仅在6 h点较HANP组显著下降,差异有统计学意义(P<0.05)。山楂承气汤组JAM-C含量均较HANP组及辛伐他汀组显著下降,差异均有统计学意义(P值均<0.01,表4)。

表4 各组大鼠血清JAM-C含量的变化
二、肠壁组织病理改变
HL组大鼠肠黏膜轻度水肿;HANP组大鼠肠黏膜水肿,部分肠黏膜微绒毛脱落,局灶出血和坏死明显,且随时间的延长而逐渐加重;山楂承气汤组和辛伐他汀组的肠黏膜损伤均较HANP组减轻(图1)。
三、肠壁组织超微结构改变
HL组毛细血管结构完整,管内少量红细胞,形状完整,组织间隙无明显渗出。HANP组及辛伐他汀组肠壁组织毛细血管变薄,管壁有部分断裂,管内红细胞聚集,细胞核向边缘固缩,内皮腔面不规整,褶皱及突起增加,基质增厚,吞饮小泡融合,溶酶体肿胀,内皮细胞核边集,内皮细胞连接除“窗孔”增加,周围组织细胞变形,核膜增厚,组织间隙增宽。山楂承气汤组毛细血管损伤较HAJP组减轻(图2)。
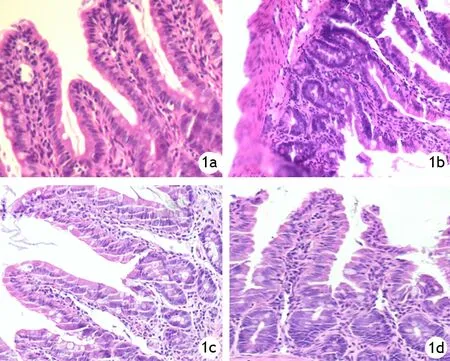
图1 HL组(1a)、HANP组(1b)、辛伐他汀组(1c)、山楂承气汤组(1d)大鼠12 h点的肠黏膜病理变化(HE ×200)
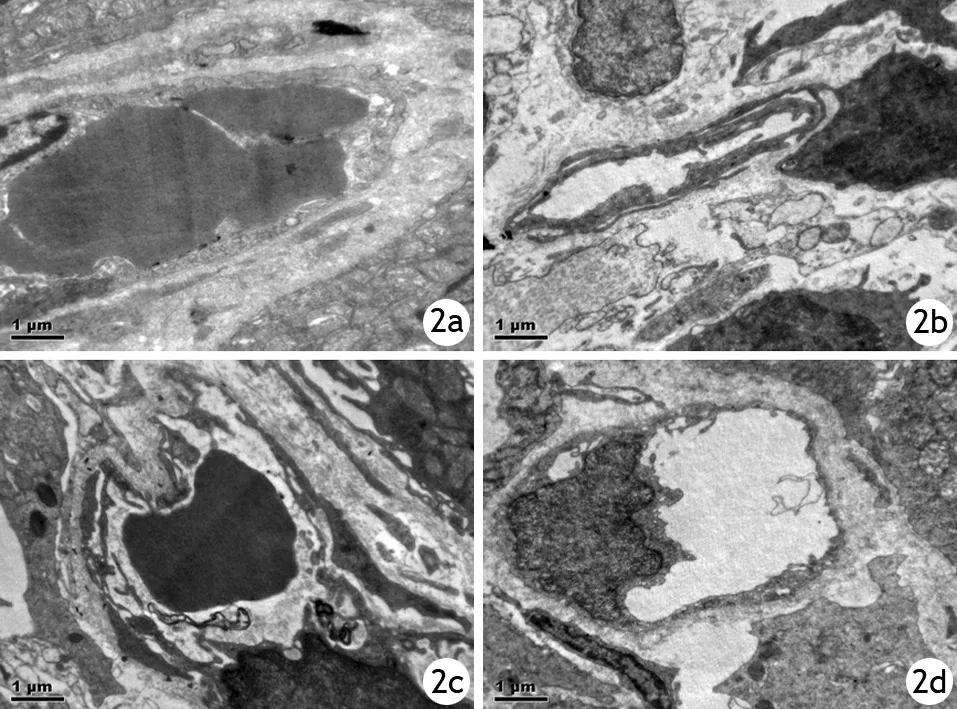
图2 HL组(2a)、HANP组(2b)、辛伐他汀组(2c)、山楂承气汤组(2d)大鼠12 h点的肠壁组织毛细血管超微结构变化(×8200)
四、肠壁组织毛细血管通透性变化
HANP组、辛伐他汀组大鼠肠壁组织毛细血管通透性均显著高于HL组(P值均<0.01),但这两组间的差异无统计学意义。山楂承气汤组肠壁组织毛细血管通透性仅在6 h点较HL组显著升高(P<0.01),其余时间点与HL组差异无统计学意义,但较HANP组及辛伐他汀组均显著下降,差异有统计学意义(P值均<0.01,表5)。
五、肠壁组织JAM-C mRNA表达
HANP组、辛伐他汀组大鼠12、24 h点肠壁组织JAM-C mRNA表达量均显著高于HL组(P值均<0.01),但这两组间的差异无统计学意义。山楂承气汤组肠壁组织JAM-C mRNA表达量与HL组的差异无统计学意义,但较HANP组及辛伐他汀组均显著下降,差异有统计学意义(P值均<0.01,表6)。
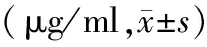
表5 各组大鼠肠壁组织EB含量变化

表6 各组大鼠肠壁组织JAM-C mRNA表达的变化
讨 论
国内外的研究表明,由高脂血症引起的AP占AP病因的4%~8.5%[6-7]。高脂血症引起的AP组织缺血严重,病情进展迅速,可以很快发生广泛的组织坏死,并发症多,疗效相对较差,病死率高。本研究制备的HANP大鼠与高脂饮食制备的HL组大鼠比较,血清TG、FFA、JAM-C含量差异无统计学意义,但HANP组血清淀粉酶活性,肠黏膜损伤程度及通透性均较HL组大鼠显著增加,提示HL不能直接导致胰腺炎的发生,但是是胰腺炎加重的重要因素,HANP组更符合临床高脂血症性重症急性胰腺炎的状况。
中医学认为HANP属实热蕴结,腑气不通证之症。治疗原则为通里攻下、清热解毒、活血化瘀。本课题所用通里攻下经典方剂大承气汤,出自《伤寒论》,方中君药大黄,味苦性寒,苦能降泻,寒能清热;厚朴《本草求真》言其:“气辛则散,故于湿满则宜;味苦则降,故于实满则下。”枳实苦辛微寒,行气消痞;芒硝则为中医“热淫于内,治以咸寒”的代表药。大承气汤古代多主治外感热病,现代多用于急腹症的治疗,其症状多见便秘、发热及从胸至腹的胀满疼痛[8],现代药理显示大承气汤能有效抑制细菌增殖生长、降低血中内毒素及各种炎症介质,清除体内有毒性的自由基,增强组织细胞的抗氧化能力等[9]。常用中药山楂,酸甘,微温,入脾、胃、肝经,具有消食化积、行气散瘀的功效[10]。在AP治疗中,山楂多与通里攻下、清热解毒、活血化瘀等药合用取得良好的疗效。现代研究发现,山楂提取物能明显降低高脂血症患者和实验性高脂血症大鼠血TG和低密度脂蛋白浓度,升高高密度脂蛋白百分比值,这表明山楂能够有效地降低血脂,并阻止自由基的生成[11]。辛伐他汀是临床常用的降脂药,尤其是降低胆固醇的水平。
本研究结果显示,辛伐他汀组和山楂承气汤组大鼠的血清淀粉酶、TG、FFA含量、肠黏膜损伤程度及通透性均较HANP组下降,且山楂承气汤组的下降更显著,提示辛伐他汀和山楂承气汤均可以降低血脂水平及减轻胰腺、肠黏膜的损伤及肠壁通透性,其中又以山楂承气汤组疗效更显著。
JAM-C是JAMs家族中重要的一员,在各种组织、器官中分布广泛,在内皮细胞、上皮细胞、血小板、T细胞、自然杀伤细胞、成纤维细胞以及淋巴管上均有表达。研究表明,JAM-C在内皮细胞间的黏附与连接中起重要作用,并与单核细胞的跨内皮浸润、微血管通透性有关,在神经细胞功能、眼科、肿瘤侵袭转移、炎症性疾病等病变中起重要作用,因此可能成为临床治疗上述疾病的新靶点[12-14]。
在发生炎症反应时,分布在血管内皮细胞上的JAM-C可以在血管内皮细胞因子和组胺的作用下迅速且短暂地分布到细胞连接处,并且在中性粒细胞向炎症部位和组织损伤处的浸润和聚集过程中起重要作用[15]。Vonlaufen等[16]报道,雨蛙素诱导的AP小鼠,其内皮细胞上JAM-C的过度表达可以促进胰腺炎病情的加重。本研究结果显示,HANP组大鼠血清JAM-C含量与高脂血症大鼠差异无统计学意义,但肠壁组织JAM-C mRNA表达量显著增加,表明JAM-C mRNA的过表达参与对肠壁的损伤,增加肠黏膜的通透性。辛伐他汀组大鼠肠壁组织JAM-C mRNA的表达量与HANP组的差异无统计学意义,而山楂承气汤组大鼠肠壁组织JAM-C mRNA的表达量较HANP组显著下降,提示山楂承气汤通过下调JAM-C的表达,改善毛细血管内皮屏障,促进组织水肿的吸收,减少组织间的出血及坏死,有效缓解高脂血症性急性胰腺炎的病情。
参 考 文 献
[1] 汤耀卿.重症急性胰腺炎的监测与治疗[J].中国实用外科杂志, 2003, 23(1): 62-64.
[2] Takahashi Y,Inaba N,Kuwahara S, et al. Effects of gamma-terpinene on lipid concentrations in serum using triton WR1339 treated rats[J]. Biosci Biotechnol Biochem, 2003, 67(11):2448-2450.
[3] 王亚军, 孙家邦, 李非, 等. 高脂血症对大鼠急性胰腺炎影响及白蛋白的干预效应[J].肝胆胰外科杂志, 2008, 20(4):254-257.
[4] Kimura Y, Hirota M, Okabe A, et al. Dynamic aspects of granulocyte activation in rat severe acute pancreatitis[J]. Pancreas, 2003,27(2):127-132.
[5] Saria A, Lundberg JM. Evans blue fluorescence: quantitative and morphological evaluation of vascular permeability in animal tissues[J]. J Neurosci Methods, 1983, 8(1):41-49.
[6] Gao YJ,Li YQ,Wang Q,et al. Analysis of the clinical features of recurrent acute pancreatitis in China[J].J Gastroenterol,2006,41(7):681-685.
[7] Bessembinders K, Wielders J, van de Wiel A. Severe hypertriglyceridemia influenced by alcohol(SHIBA)[J]. Alcohol Alcohol,2011,46(2)113-116.
[8] 孙玄 ,邢斌,任宏丽,等.大承气汤类方主治病症规律探析[J].环球中医药,2009,2(2):121-123.
[9] 张艳丽,杨克雅.大承气汤泻热作用机制研究[J].山东中医杂志, 2009, 28(3): 198-199.
[10] 高学敏.实用中药学[M].1版.北京:中国中医药出版社,2006:476.
[11] 张文洁,杨英,张辉.山楂叶提取物对高血脂大鼠的影响[J].辽宁中医杂志, 2008, 35(2): 307-308.
[12] Wyss L, Schäfer L, Liebner S,et al. Junctional adhesion molecule (JAM)-C deficient C57BL/6 mice develop a severe hydrocephalus[J]. PLoS One, 2012, 7(9): e45619.
[13] Christen S, Coppieters K, Rose K, et al. Blockade but not overexpression of the junctional adhesion molecule C influences virus-induced type 1 diabetes in mice[J]. PLoS One, 2013, 8(1): e54675.
[14] Leinster DA, Colom B, Whiteford JR, et al. Endothelial cell junctional adhesion molecule C plays a key role in the development of tumors in a murine model of ovarian cancer[J]. FASEB J, 2013, 27(10): 4244-4253.
[15] Ody C, Jungblut-Ruault S, Cossali D, et al. Junctional adhesion molecule C (JAM-C) distinguishes CD27+ germinal center B lymphocytes from non-germinal center cells and constitutes a new diagnostic tool for B-cell malignancies[J]. Leukemia, 2007,21(6): 1285-1293.
[16] Vonlaufen A,Aurrand-Lions M,Pastor CM,et al. The role of junctional adhesion molecule C (JAM-C) in acute pancreatitis[J]. J Pathol, 2006,209(4):540-548.

