维生素D3通过Hedgehog信号通路对胰腺癌PANC1细胞增殖与凋亡的影响
商建 邹金艳 伍威 易三凤 张海平 林军
Hedgehog信号通路成员主要包括Hedgehog配体、PTCH受体、SMO受体、转录因子Gli蛋白及位于下游的其他相关信号分子[1]。维生素D3又名烟碱酸胺、胆骨化醇,在钙磷代谢中发挥重要作用。Garland等[2]发现,不同地区的肿瘤发生率与该地区所接受的日照成反比,该差异可能与维生素D3水平有关。近年来有研究报道维生素D3可通过阻断Hedgehog信号通路发挥抗瘤效应[3-5]。本研究应用不同浓度维生素D3干预胰腺癌PANC1细胞系,检测细胞增殖、凋亡及PTCH、Gli-1基因表达的变化,探讨维生素D3通过阻断Hedgehog信号通路抗胰腺癌的作用机制。
材料与方法
一、细胞增殖检测
人胰腺癌PANC1细胞系购自中国科学院上海细胞库常规培养、传代。取对数生长期细胞,接种于96孔板,每孔104个细胞。应用25、50、75、100 μmol/L的维生素D3干预PANC1细胞24、48、72 h,以未加维生素D3处理的细胞作为阴性对照组,以未接种细胞作为空白对照组,每组均设5个复孔。常规培养24、48、72 h,然后每孔加入20 μl MTT溶液,继续孵育4 h,每孔加入100 μl DSMO震荡5 min,上酶标仪检测波长为570 nm处的吸光度值(A570值),计算细胞抑制率。细胞抑制率=[1-(实验组A570值-空白组A570值)/(阴性对照组A570值-空白组A570值)]×100%。实验重复3次,取均值。
二、细胞凋亡检测
同上述的细胞分组培养24 h,收集细胞。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作,上流式细胞仪检测细胞凋亡。
三、PTCH、Gli-1 mRNA表达量检测
同上述的细胞分组培养24 h,收集细胞,同时应用75 μmol/L的维生素D3干预PANC1细胞0、12、24、36、48 h,收集各时间点细胞。采用Trizol提取细胞总RNA。逆转录合成cDNA,然后进行PCR扩增。PCR引物序列:PTCH正义引物5′-TCTCGGATCATTGTGATGGA-3′,反义引物5′-AGGCTCAGCACTAGGCATGT-3′,扩增产物104 bp;Gli-1正义引物5′-CTGGATCGGATAGGTGGTCT-3′,反义引物5′-CAGAGGTTGGGAGGTAAGGA-3′,扩增产物226 bp;内参GAPDH正义引物5′-CAAGGTCATCCATGACAACTTTG-3′,反义引物5′-GTCCACCACCCTGTTGCTGTAG-3′,扩增产物496 bp。引物由上海生工生物工程股份有限公司合成。PCR反应程序:95℃ 5 min,95℃ 30 s、58℃(PTCH)或61℃(Gli-1)或58℃(GAPDH)30 s、72℃ 40 s,共35个循环,最后72℃延伸10 min。扩增产物经2.0%琼脂糖凝胶电泳分离,凝胶成像分析系统扫描条带灰度值,以目的条带与内参条带的灰度值比表示mRNA相对表达量。实验重复3次,取均值。
四、统计学处理
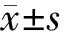
结 果
一、维生素D3干预对胰腺癌PANC1细胞增殖的影响
维生素D3干预24 h不影响PANC1细胞的增殖;干预48 h后,PANC1细胞的生长随维生素D3浓度的增加而被抑制,其中50、75、100 μmol/L组与阴性对照组,100 μmol/L组与25、50 μmol/L组之间的差异均具有统计学意义(P值均<0.05);干预72 h后,PANC1细胞的生长亦随维生素D3浓度的增加而被抑制,其中75、100 μmol/L组与阴性对照组及25、50 μmol/L组之间的差异均具有统计学意义(P值均<0.05)。干预48 h的各浓度组细胞生长抑制率均较干预24 h同浓度组升高,而干预72 h的各浓度组细胞生长抑制率均较干预24 h同浓度组降低(表1)。
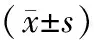
表1 维生素D3干预后PANC1细胞增殖的变化
二、维生素D3干预对胰腺癌PANC1细胞凋亡的影响
阴性对照组PANC1细胞的早期凋亡率为(5.89±0.57)%;维生素D3干预24 h后, 25、50、75、100 μmol/L组PANC1细胞的早期凋亡率分别为( 6.06±0.44)%、(16.21±1.62)%、(16.94±0.91)% 、(20.96±0.98)%,早期凋亡率随浓度的增加而增加,差异有统计学意义(F=142.062,P<0.05),其中50、75、100 μmol/L组与阴性对照组、25 μmol/L组之间,100 μmol/L与50、75 μmol/L组之间的差异均有统计学意义(P值均<0.05,图1),以100 μmol/L的效果最佳。
三、维生素D3干预后PANC1细胞PTCH、Gli-1 mRNA表达的变化
不同浓度维生素D3作用PANC1细胞24 h后,阴性对照组及25、50、75、100 μmol/L组细胞的PTCH mRNA表达量分别为0.117±0.009、0.104±0.011、0.069±0.011、0.052±0.009、0.056±0.007,随浓度的增加而下调,差异有统计学意义(F=27.279,P<0.05,图2),其中50、75、100 μmol/L组与阴性对照组、25 μmol/L组之间的差异均有统计学意义(P值均<0.05);75 μmol/L维生素D3干预0、12、24、36、48 h后,PTCH mRNA表达量分别为0.142±0.008、0.127±0.009、0.111±0.010、0.115±0.003、0.102±0.007,随时间的延长而下调,差异有统计学意义(F=11.602,P<0.05),其中12、24、36、48 h点与0 h点之间,24、48 h点与12 h点之间的差异有统计学意义(P值均<0.05)。
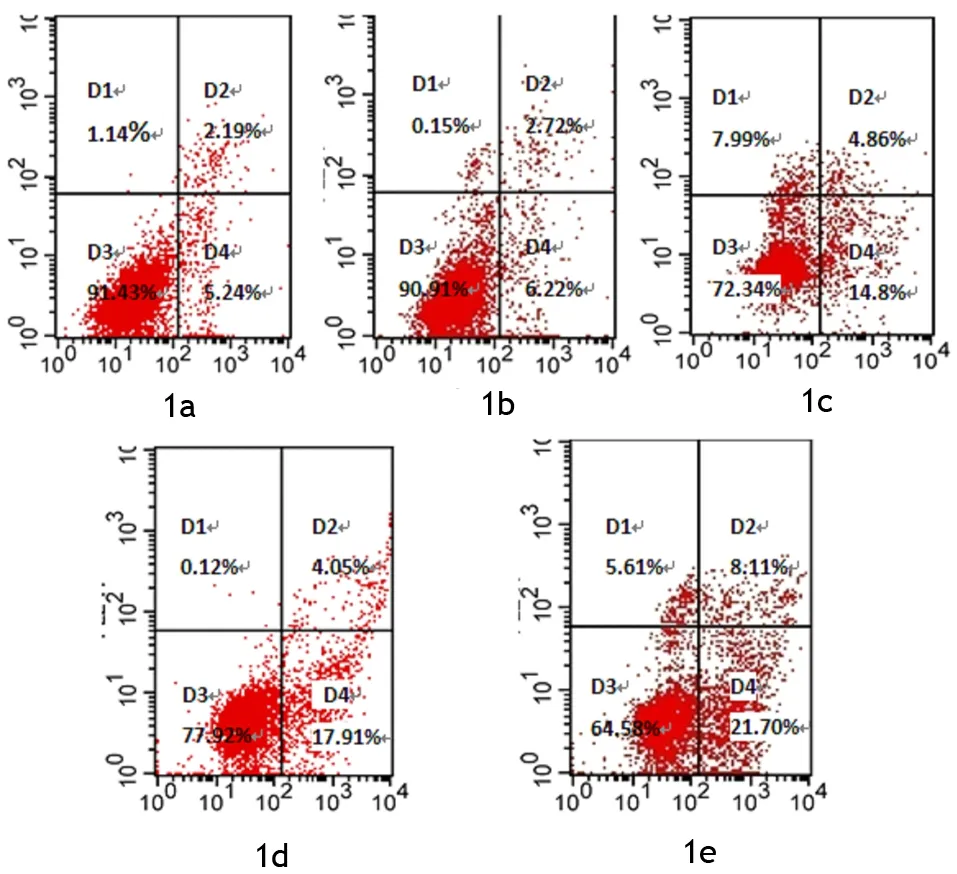
D1象限代表测量误差,D2象限代表中晚期凋亡细胞,D3象限代表正常细胞,D4象限代表早期凋亡细胞
图1阴性对照组(1a)及维生素D3 25(1b)、50(1c)、75(1d)、100 μmol/L(1e)组PANC1的凋亡细胞
不同浓度维生素D3作用24 h后,阴性对照组及25、50、75、100 μmol/L组细胞的Gli-1 mRNA表达量分别为0.323±0.007、0.312±0.015、0.299±0.015、0.233±0.007、0.175±0.014,随浓度的增加而下调,差异有统计学意义(F=74.653,P<0.05,图2),其中50、75、100 μmol/L组与阴性对照组之间,75、100 μmol/L与25、50 μmol/L组之间,100 μmol/L与75 μmol/L组之间的差异均有统计学意义(P值均<0.05);75 μmol/L维生素D3干预0、12、24、36、48 h后,Gli-1 mRNA 分别为0.341±0.011、0.317±0.017、0.320±0.018、0.226±0.011、0.191±0.010,随时间的延长而下调,差异有统计学意义(F=66.465,P<0.05,图2),其中36、48 h点与0、12、24 h点之间,48 h点与36 h点之间的差异均有统计学意义(P值均<0.05)。
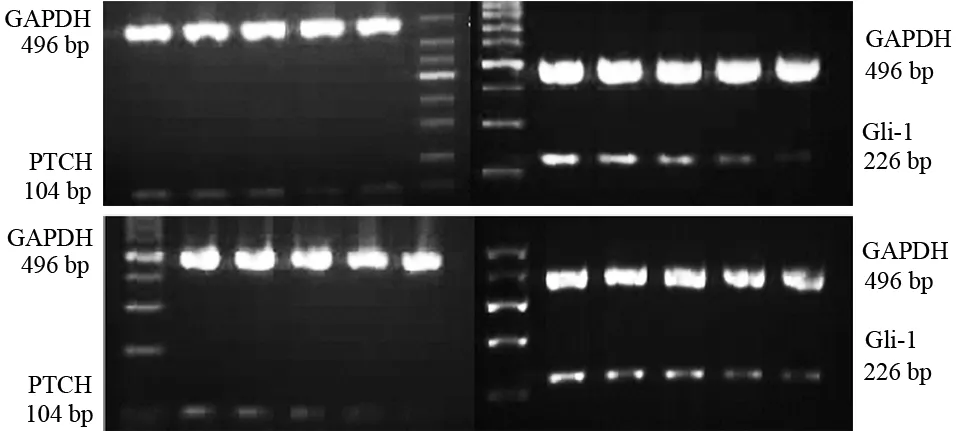
图2 不同浓度(0、25、50、75、100 μmol/L)维生素D3干预PANC1细胞24 h(上)及75 μmol/L维生素D3干预PANC1细胞不同时间(0、12、24、36、48 h)后(下)PTCH mRNA(左)及Gli-1 mRNA(右)表达量
讨 论
胰腺癌的恶性程度极高,是人类21世纪急需攻破的难题。 传统治疗(手术、放疗、化疗以及综合治疗)并不能完全有效地缓解症状,只有充分了解胰腺癌发病的分子生物学机制才能更好地预防、诊断和治疗疾病。胰腺癌的发病主要涉及原癌基因、抑癌基因及基因组维护基因的异常[6],它们通过一条或多条信号通路引起细胞不断恶化,最终导致肿瘤的发生、发展。常见的信号通路包括TGF-β/SMAD、Wnt/β-Catenin、IGF、Notch、Ras/RAF/MAPK、NF-κB和Hedgehog信号通路[7],其中Hedgehog信号通路是近些年研究的热点。近年研究报道,阻滞Hedgehog信号通路可有效抑制胰腺癌的增殖浸润和恶性进展[8],具有较强的抗胰腺癌作用。
维生素D3是一种新近发现的Hedgehog通路阻滞剂。Bijlsma等[3]在2006年首先提出了维生素D3与Hedgehog信号通路的关系,维生素D3通过直接和smo受体结合抑制下游信号。Tang等4]研究表明维生素D3通过Hedgehog信号通路抑制小鼠基底细胞癌的增殖。Baek等[5]发现维生素D3可使胃癌及胆管癌细胞系中Ptch1、Gli、CCND1、Bcl2等基因的表达下调,并与其他的抗肿瘤药物有协同作用。
本研究结果显示,不同浓度维生素D3干预后,胰腺癌PANC1细胞的增殖受到不同程度的抑制,且以较大剂量更为明显(75、100 μmol/L)。同时,本研究发现干预48 h时的细胞生长抑制较24 h时明显上升,但72 h时的抑制率反而降低,其原因可能因48h后维生素D3的药效已衰弱,而残留的癌细胞开始继续增殖,甚至有的癌细胞已进入新的细胞周期开始旺盛的繁殖所致。本研究结果还显示,维生素D3可以有效促进PANC1细胞的早期凋亡,在较大浓度组(100 μmol/L)的凋亡率增加更显著;呈浓度和时间依赖性下调PTCH、Gli-1 mRNA的表达,表明维生素D3通过抑制Hedgehog信号通路中PTCH、Gli-1基因的表达而有效抑制胰腺癌PANC1细胞的增殖,促进细胞的凋亡,发挥抗胰腺癌作用。
参 考 文 献
[1] Nakamura M, Tanaka H, Nagayoshi Y, et al. Targeting the hedgehog signaling pathway with interacting peptides to Patched-1[J]. J Gastroenterol,2012,47(4):452-460.
[2] Garland CF, Garland FC, Gorham ED, et al. The role of vitamin D in cancer prevention[J]. Am J Public Health,2006,96(2):252-261.
[3] Bijlsma MF, Spek CA, Zivkovic D, et al. Repression of smoothened by patched-dependent (pro-)vitamin D3 secretion[J]. PLoS Biol,2006,4(8):e232.
[4] Tang JY, Xiao TZ, Oda Y, et al. Vitamin D3 inhibits hedgehog signaling and proliferation in murine Basal cell carcinomas[J]. Cancer Prev Res (Phila),2011,4(5):744-751.
[5] Baek S, Lee YS, Shim HE, et al. Vitamin D3 regulates cell viability in gastric cancer and cholangiocarcinoma[J]. Anat Cell Biol,2011,44(3):204-209.
[6] Sakorafas GH, Tsiotos GG. Molecular biology of pancreatic cancer: potential clinical implications[J]. BioDrugs,2001,15(7):439-452.
[7] Vaccaro V, Melisi D, Bria E, et al. Emerging pathways and future targets for the molecular therapy of pancreatic cancer[J]. Expert Opin Ther Targets,2011,15(10):1183-1196.
[8] Feldmann G, Dhara S, Fendrich V, et al. Blockade of hedgehog signaling inhibits pancreatic cancer invasion and metastases: a new paradigm for combination therapy in solid cancers[J]. Cancer Res,2007,67(5):2187-2196.

