胰腺癌循环微小核糖核酸载体的研究
冯慧 王亚雷 陈熹 张辰宇 袁耀宗 姚玮艳
近年来微小核糖核酸(microRNA, miRNA)在肿瘤的诊断和治疗中的作用越来越受到关注,其中循环miRNA的发现为胰腺癌的早期诊断提供了极大的契机,同时也为研究胰腺癌发生、发展的可能分子机制提供了全新的思路和途径。但是在胰腺癌中,循环miRNA是如何产生、如何稳定存在的,其生物学功能又是什么,这一系列的问题还有待阐明。本研究采用梯度离心法分离人胰腺癌细胞系培养上清、健康人群和胰腺癌患者血清中的微囊泡(microvesicle,MV),了解细胞培养上清及血清中的MV是否包含循环的miRNA,探讨循环miRNA的载体。
材料和方法
一、血清MV的分离
采集6例病理证实的尚未行手术治疗、放疗及化疗的胰腺导管腺癌患者外周血,以6例同年龄段健康体检者的外周血作为对照组。加入3.8%的柠檬酸钠溶液抗凝后上下混匀,室温1 000 r/min离心10 min后取上层血浆,然后4℃ 300 g/min离心5 min去除残留血细胞,4℃ 1 500 g/min离心20 min去除血小板及其他细胞碎片,4℃ 3 000 g/min离心30 min去除残存细胞器,最后4℃ 110 000 g/min离心70 min弃上清,沉淀即为血清的MV。用500 μl PBS反复吹打溶解后置4℃保存。同时将含有游离miRNA的上清4℃保存。
二、细胞培养上清的MV分离
胰腺癌SW1990、BxPC3细胞系由上海交通大学附属瑞金医院内科实验室馈赠,常规培养,每2~3 d传代。收集细胞培养液,室温1 000 r/min离心5 min后取上清,然后4℃ 3 000 g/min离心30 min,4℃ 110 000 g/min离心70 min弃上清,沉淀即为细胞培养上清的MV。用500 μl PBS反复吹打溶解后置4℃保存。
三、miRNA水平检测
采用酸性酚法提取血清miRNA,采用Trizol(Invitrogen公司)提取细胞培养上清和血清MV中miRNA。应用实时PCR法检测miRNA水平。PCR反应体系:Taq酶0.33 μl,cDNA 1 μl,MgCl21.2 μl,dNTP mixture(2.5 mmol/L) 1.6 μl,10×PCR buffer 2 μl, TaqMan probe+primer 1 μl,ddH2O 12.5 μl;反应条件:95℃ 2 min,95℃ 15 s、60℃ 60 s,40个循环,最后60℃延伸5 min。通过仪器自带软件获取Ct值,通过公式2-ΔΔCt计算miRNA的水平。
四、MV的Ago2、CD63蛋白水平检测
分离的血清MV直接用裂解液裂解,细胞培养上清MV用预冷的PBS洗涤2次后加入预冷的裂解缓冲液冰上裂解30 min,其间用枪吹打几次,12 000 g离心15 min取上清,BCA法定量蛋白后常规行蛋白质印迹法检测RNA诱导沉默复合体(RNA-induced silencing complex、RISC)的核心元件Ago2蛋白及MV的标志性糖蛋白CD63的水平。兔抗人Ago2、CD63抗体购自Abcam公司,工作浓度分别为1∶200及1∶400,羊抗兔IgG购自Santa Cruz公司,工作浓度1∶1 500。最后ECL发光,X线曝光、显影、定影。
五、统计学处理
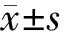
结 果
一、胰腺癌细胞和培养上清MV的Ago2、CD63蛋白表达水平
为了解所离心物质是否为MV,本研究检测胰腺癌细胞及其培养上清MV的Ago2、CD63蛋白。结果它们均表达Ago2、CD63蛋白(图1)。
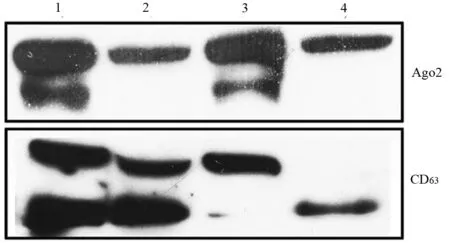
图1 SW1990、 BxPC3(1、3)细胞及其培养上清MV(2、4)的Ago2、CD63蛋白表达
二、SW1990、 BxPC3培养上清MV包裹的和游离的(MV-free)miRNA水平
参考文献[1-2],本研究检测胰腺癌患者血清中显著升高的10个miRNA水平。两株细胞培养上清中均存在MV包裹的miRNA及游离的miRNA,但其含量存在较大差异(图2)。
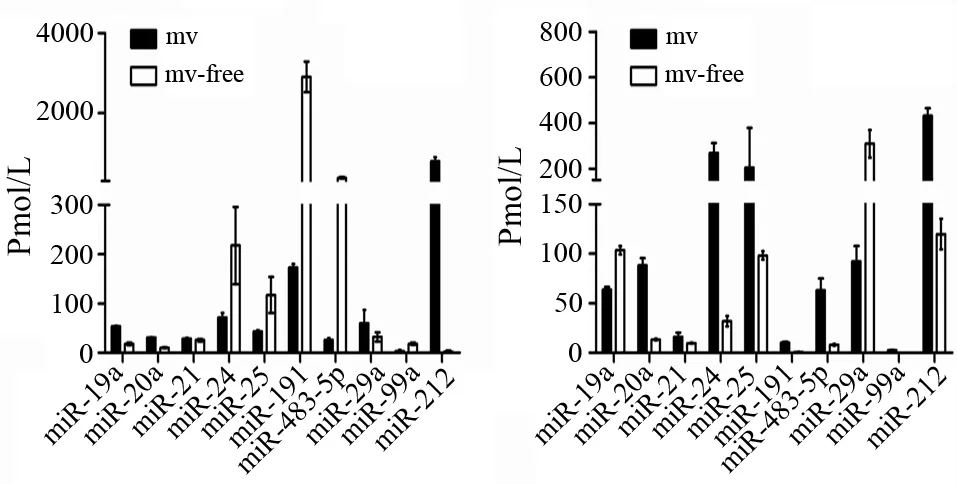
图2 SW1990(a)、BxPC3(b) 培养上清MV内包裹的和游离的miRNA表达量
三、胰腺癌患者血清MV包裹的和游离的miRNA水平
选择6个在胰腺癌患者血清中含量相对较高的miRNAs(miR-20a、miR-21、miR-24、miR-25、miR-191、miR-483-5p)进行研究[1-2]。胰腺癌组、对照组的血清及MV中均存在miR-20a、miR-21、miR-24、miR-25、miR-191、miR-483-5p(图3),但以MV包裹的量较多,且胰腺癌组MV包裹的miRNA量与对照组不完全一致,miR-20a、miR-24、miR-191分别为对照组的(2.93±0.29)、(2.73±0.46)、(2.39±0.51)倍,差异有统计学意义(F值分别为75.97、25.80、12.94,P<0.05或<0.01,图4)。
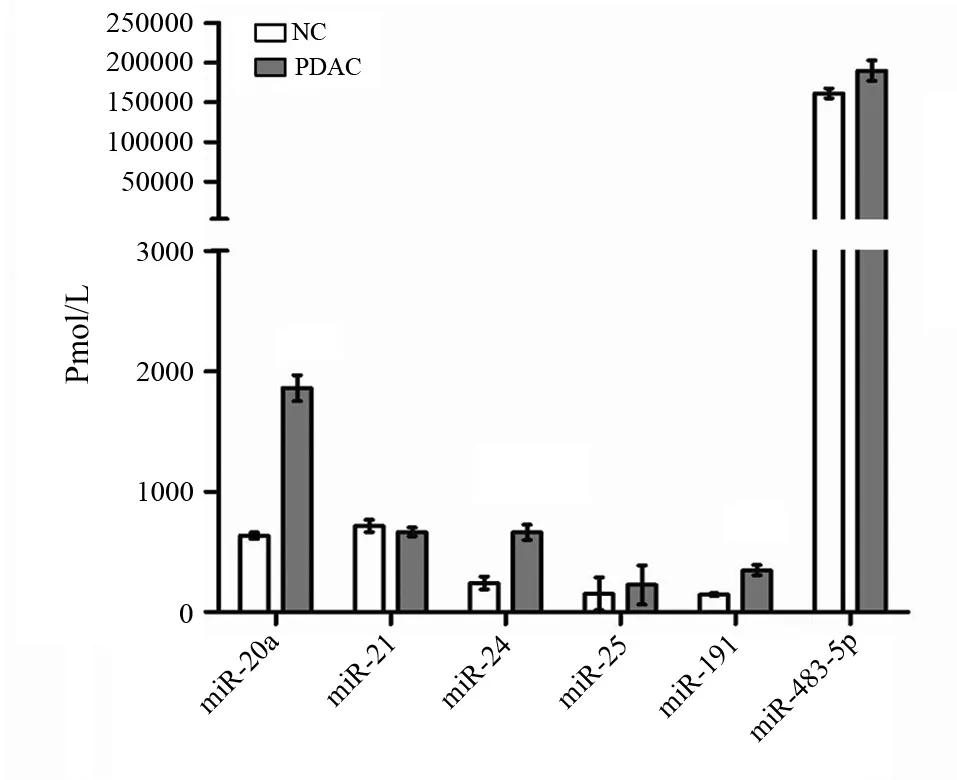
图3 对照组(NC)和胰腺癌患者(PDAC)血清中miRNA的水平
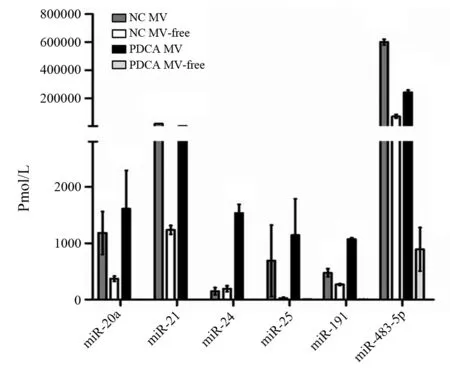
图4 对照组(NC)和胰腺癌患者(PDAC)血清中MV包裹的和游离的(MV-free)miRNA含量
讨 论
近年来研究发现miRNAs与肿瘤的发生、发展关系密切。miRNAs是19~25个核苷酸、非蛋白质编码的小RNA家族,通过与靶miRNA3′端的非编码区结合,降解或者抑制mRNA的翻译,导致靶基因转录后沉默,从而参与靶基因功能的调节。癌相关性miRNA可以在肿瘤患者的周围循环中检测到。国内外研究发现,在食道癌[3]、肺癌[4]、乳腺癌[5]、弥漫性B细胞淋巴瘤[6]、前列腺癌[7]等疾病中,循环miRNA可作为临床诊断和预后评估的分子标志物。Liu等[1]通过对血清和组织中的miRNA比较,得出血清中的miRNA来源于肿瘤细胞,并发现7种miRNA(miRNA20a、miRNA21、miRNA 24、miRNA 25、miRNA 99a、miRNA 185、miRNA 191)联合检测可以区别胰腺癌、慢性胰腺炎以及正常健康者,且这7种miRNA在早期病变时就有变化。在26例Ⅰ期胰腺癌患者中,联合诊断率为96.2%,在48例Ⅱ期胰腺癌患者中,联合诊断率达91.7%。
MV是机体内细胞在正常和病理状态下都会分泌的直径在30~1 000 nm之间的膜结构小体,包括exosome和shedding vesicle两种[8-9]。红细胞、B细胞、T细胞、树突状细胞、肥大细胞、上皮细胞和肿瘤细胞等多种细胞均能分泌MV。细胞把特异的生物活性分子如蛋白质等包裹到MV中,这些生物活性分子通过MV被运输到相应的受体细胞并调节受体细胞的生物功能,这种由MV介导的细胞间信息传递在一些生理和病理过程中起着十分重要的作用[8-9]。
Ogawa等[10]应用miRNA芯片分析技术发现源自脂肪细胞的MV中也富含大量的miRNA,同时脂肪细胞分泌的miRNA会调控其靶细胞巨噬细胞的成熟和分化。Collino等[11]发现造血干细胞分泌的MV中包裹的miRNA会调控小鼠血管内皮细胞内多个与其生理过程密切相关的基因的表达。而Sun等[12]在分泌miRNA领域的后续研究发现,牛奶中富含的免疫相关miRNA会通过MV行使免疫调节功能。为了解血清中miRNA作用途径及是否存在相应载体,他们通过梯度离心法分离血清和T淋巴细胞培养上清中的MV,发现血清及细胞培养上清中的MV包含miRNA,并且MV可能是循环miRNA的主要载体[13]。本研究通过梯度离心方法胰腺癌细胞系SW1990、BxPC3培养上清及胰腺癌患者及对照组上清中的MV,它们均含有外核体表面的标志性蛋白CD63及miRNA行使功能的蛋白Ago2,并且这些MV富含miRNA。表明MV是miRNA最主要的载体。进一步检测胰腺癌患者和对照组血清miRNA的表达,发现miR-20a、miR-24、miR-191在胰腺癌患者血清中表达较对照组显著升高,而且血清中的miRNA绝大部分被包裹在MV中。胰腺癌患者与对照组血清MV包裹的miRNA不同,且包裹的量也不同,有些游离的miRNA量较MV包裹的高,这可能与在不同的生理或疾病状态下MV选择性包裹miRNA相关。这种选择性的包裹是细胞主动地、特异性地分泌miRNA的基础。
参 考 文 献
[1] Liu R, Chen X, Du Y, et al. Serum MicroRNA expression profile as a biomarker in the diagnosis and prognosis of pancreatic cancer[J]. Clin Chem, 2012, 58(3):610-618.
[2] Wang J, Sen S.MicroRNA functional network in pancreatic cancer: From biology to biomarkers of disease[J]. J Biosci, 2011, 36(3):481-491.
[3] Zhang C, Wang C, Chen X, et al. Expression profile of microRNAs in serum: a fingerprint for esophageal squamous cell carcinoma[J]. Clin Chem, 2010,56(12):1871-1879.
[4] Chen X, Hu Z, Wang W, et al. Identification of ten serum microRNAs from a genome-wide serum microRNA expression profile as novel noninvasive biomarkers for nonsmall cell lung cancer diagnosis[J]. Int J Cancer, 2012,130(7):1620-1628.
[5] Hu Z, Dong J, Wang LE, et al. Serum microRNA profiling and breast cancer risk: the use of miR-484/191 as endogenous controls[J]. Carcinogenesis, 2012,33(4):828-834.
[6] Lawrie CH, Gal S, Dunlop HM, et al. Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma[J]. Br J Haematol, 2008, 141(5):672-675.
[7] Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci U S A, 2008,105(30):10513-10518.
[8] Cocucci E, Racchetti G, Meldolesi J. Shedding microvesicles: artefacts no more[J]. Trends Cell Biol, 2009,19(2):43-51.
[9] Thery C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2:569-579.
[10] Ogawa R, Tanaka C, Sato M, et al. Adipocyte-derived microvesicles contain RNA that is transported into macrophages and might be secreted into blood circulation[J]. Biochem Biophys Res Commun, 2010, 398(4):723-729.
[11] Collino F, Deregibus MC, Bruno S, et al. Microvesicles derived from adult human bone marrow and tissue specific mesenchymal stem cells shuttle selected pattern of miRNAs[J]. PLoS One, 2010,5(7):e11803.
[12] Sun Q, Chen X, Yu J, et al. Immune modulatory function of abundant immune-related microRNAs in microvesicles from bovine colostrum[J]. Protein Cell, 2013, 4(3):197-210.
[13] Zhang Y, Liu D, Chen X, et al. Secreted monocytic miR-150 enhances targeted endothelial cell migration[J]. Mol Cell,2010,39(1):133-144.

