表柔比星长循环脂质体冻干粉的制备*
周晖,贺霞,杨文涛,姜伟化,杨磊,王东凯
(1.中国医科大学附属第一医院药剂科,沈阳 110001;2.沈阳药科大学药学院,沈阳 110016)
表柔比星是一种高效、广谱的抗肿瘤药,单一用药对多种肿瘤有广谱抑制作用,主要应用于肺癌、乳腺癌、肝癌、卵巢癌和白血病的化学治疗(化疗)。虽然上市的表柔比星注射剂疗效确切,但仍有不少毒副作用,目前人们已采用多种方法来减少该药物的全身毒副作用,特别是心脏毒性,主要是应用药物载体,改变表柔比星的生物分布,减少表柔比星在全身特别是心脏组织中的分布,提高其在局部肿瘤中的含量。这些药物载体包括乳剂[1]、纳米粒[2]、微球[3]、脂质体等。脂质体混悬液的物理化学稳定性差,是脂质体应用于临床的主要困难,因为混悬液中磷脂不可避免地存在水解氧化,并且药物也容易泄露,且粒子的聚集导致粒径变大[4]。1978年,VANLEBERGHE等首次报道采用冷冻干燥法提高脂质体的贮存稳定性,制成冻干脂质体可以显著降低磷脂和药物的水解和氧化速度,同时,冻干保护剂也保持了脂质体膜结构的完整性,克服脂质体聚集、融合以及药物渗漏等不稳定因素,显著提高贮存稳定性。目前,该法已成为较有前途的改善脂质体制剂长期稳定性的方法之一[5]。吴燕等[6]选择二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidyl choline,DPPC)、二硬脂酰磷脂酰甘油(distearoyl phosphatidyl glycerol,DSPG)、1-肉豆蔻酰基-2-硬脂酰基磷脂酰胆碱(1-myristoyl-2-stearoyl-sn-glycero-3-phosphatidylcholine,MSPC)等材质制备盐酸表柔比星长循环热敏脂质体,并对其体外释放机制进行了研究。方瑜等[7]以四氧化三铁(Fe3O4)为磁核,聚乙二醇单甲醚(methoxy polyethylene glycol,mPEG)为修饰剂制得盐酸表柔比星长循环磁性脂质体,结果表明脂质体磁响应性和缓释效果均良好。笔者前期制备了甲氧基聚乙二醇2000-二硬脂酰磷脂酰乙醇胺(methoxy polyethylene glycol 2000-2 stearyl phosphatidyl ethanolamine,PEG2000-DSPE)长循环脂质体,笔者在本实验中重点考察表柔比星脂质体冻干粉针的制备及制剂的稳定性。
1 仪器与试药
1.1 仪器 LC-10A高效液相色谱仪(日本岛津株式会社)、色谱柱:Diamonsil ODS C18[250mm × 4.6mm,5 μm,迪马科技(天津)有限公司]、COULTER LS230 粒径分析仪(美国BECKMAN公司)、COULTER DELSA440 SX Zeta电位及粒径测定仪(美国BECKMAN公司)、冷冻干燥机(北京四环科学仪器厂)。
1.2 试药 表柔比星原料药(哈尔滨三联药业有限公司提供,批号:110901,含量:99.7%)、蔗糖(天津市博迪化工有限公司,批号:20120302)、甘露醇(天津市博迪化工有限公司,批号:20120124)、海藻糖(广西南宁中诺生物制品有限公司,批号:20120401)、葡萄糖(天津市大茂化学试剂厂,批号:20110902)、乳糖(美剂乐,批号:NT1008)、大豆磷脂(SPC,S100,纯度 >95%,批号:DPC120406)(Lipoid)、PEG2000-DSPE(批号:110803)(Lipoid)、胆固醇(天津市博迪化工有限公司,批号:20111202)。
2 方法与结果
2.1 表柔比星长循环脂质体的制备 称取适量大豆磷脂、胆固醇及PEG2000-DSPE,按质量比4∶1∶0.5混合,加入适量乙醇超声溶解,水浴加热挥去部分乙醇,注入预热至相同温度的250mmol·L-1的硫酸铵溶液,孵育30min,制得脂质体初品。以超声波细胞粉碎机在480 W超声90 s处理所得脂质体,依次通过孔径0.45,0.22 μm 的微孔滤膜整粒,即得空白脂质体。采用透析法(0.9%氯化钠溶液4 L中透析2 h,重复3次)建立脂质体跨膜硫酸铵梯度[8],加入适量表柔比星溶液(药脂比1∶10,W/W),于50℃孵育30min即得载药脂质体。
2.2 脂质体混悬液稳定性考察 由于脂质体中磷脂的不稳定性,该脂质体的预计储存条件为冰箱4℃冷藏保存,将优化的表柔比星长循环脂质体置于西林瓶中,充氮密封,置于4℃条件下避光放置,分别于0,1,4,7,15,30 d 取样,考察制剂的外观、包封率、含量,以及光学显微镜下形态变化,结果见表1。
包封率(%)=C2/C1*100%。式中C1为不经微柱离心脂质体中表柔比星的浓度;C2为微柱离心后包封于脂质体中表柔比星的浓度。
含量测定方法:精密称取长循环脂质体适量,置10mL量瓶,加入甲醇5mL,超声破坏5min,加水稀释至刻度,移取1mL 至10mL量瓶,以水定容,0.45 μm滤膜过滤,作为供试品溶液,另准确配制20 μg·mL-1表柔比星对照溶液,分别取上述对照及供试品溶液20 μL进样,测得表柔比星峰面积,连续5次,按外标法计算表柔比星含量。
含量(Cx)=Cr*(Ax/Ar)。Ax为供试品峰面积;Cr为对照品溶液的浓度;Ar为对照品的峰面积。
由脂质体混悬液在4℃的稳定性结果可见,长循环脂质体4℃放置30 d时包封率略降低,为94.87%,外观、药物含量以及显微镜下形态无显著变化。
2.3 表柔比星脂质体冷冻干燥研究
2.3.1 冻干保护剂种类的筛选 一般而言,脂质体的双层膜结构对冷冻和干燥工艺敏感,加入适宜的冻干保护剂则可减弱或者消除冻干工艺对脂质体造成的破坏[9]。为确定冻干保护剂对脂质体冻干的影响,考察了葡萄糖、甘露醇、蔗糖、海藻糖、乳糖等保护剂对表柔比星脂质体冻干的影响。固定冻干保护剂与脂质比例为2∶1,以冻干产品的外观、再分散性以及显微形态为评价指标,评价冻干制品的质量。实验结果见表2。

表1 表柔比星长循环脂质体在4℃条件下的稳定性考察结果Tab.1 Stability results of long-circulation epirubicin liposomes at 4℃

表2 不同保护剂对冻干产品的影响Tab.2 Effect of various protective agent on freeze-dried products
由表2可知,保护剂对冻干品有明显的保护作用,未加入冻干保护剂的处方外观及复溶性均较差。以甘露醇作为冻干保护剂,冻干品的外观较好,但复溶困难,复溶后有磷脂碎片;以蔗糖和葡萄糖、乳糖作为冻干保护剂,冻干品外观差,且复溶后浑浊,粒径变化较大,这可能是蔗糖和葡萄糖形成的样品溶液的玻璃化转变温度较低,冻干过程不能形成玻璃态,以致磷脂膜破裂[10]。以海藻糖作冻干保护剂,冻干品外观好,重建容易,无粒子聚集,故初步确定海藻糖作为冻干保护剂。
2.3.2 冻干保护剂浓度的考察 初步确定以海藻糖作为冻干保护剂,考察不同保护剂和脂质的比例时冻干产品的外观、再分散性、再分散后粒径大小,结果见表3。
由以上结果可知,当保护剂和脂质的比例为3∶1时,冻干产品的外观、再分散、再分散后粒径大小及分布均达到理想的效果,继续增加保护剂和脂质的比例,效果不明显,故选择保护剂和脂质的比例为3∶1。

表3 不同比例的冻干保护剂与脂质体对冻干产品的影响Tab.3 Effect of the ratio of protective agent to liposome on freeze-dried products
2.3.3 冻干工艺的考察 将表柔比星长循环脂质体的装量定为每支2mL,各50支。考察速冻(将样品直接放入-70℃冰箱中预冻)和慢冻(样品随冷却温度逐渐降低到-50℃)两种预冻方式对冻干产品的影响,结果见表4。

表4 两种预冻方式对产品的影响Tab.4 Effect of two precool ways on the product
实验结果显示,两种预冻方式得到的产品性状差异不大。预冻时间为5 h,产品收率较低。可能是因为预冻时间短,制剂内部未充分冻实。干燥过程中,首先上表面形成一层外壳,内部水分较难挥发,达到一定温度后内部融化导致塌陷。预冻8,10 h产品收率较高,均>90%。从便于实验的角度,选择速冻法进行预冻,预冻温度为-70℃,预冻时间为8 h。
2.3.4 干燥时间考察 表柔比星长循环脂质体的装量定为每支2mL,各50支。本实验所考察的干燥时间为两个阶段的总干燥时间,考察冻干时间分别为24,30,36 h时冻干产品的外观及收率,结果见表5。
由表5可知,冻干时间为24 h时产品的合格率可达96%,再增加干燥时间对产品的收率影响不大,因此确定24 h为总干燥时间。
2.4 冻干产品的表征
2.4.1 粒径 取表柔比星长循环冻干脂质体冻干前后产品(冻干制剂用注射用水复溶后稀释适当倍数,备用),COULTER LS230粒径分析仪测定其粒径及粒度分布。见图1。

表5 冻干时间对产品的影响Tab.5 Effect of freeze-drying time on the product
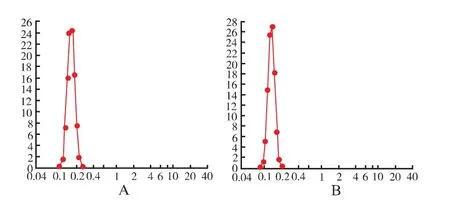
图1 表柔比星长循环脂质体冻干前样品(A)和冻干后样品(B)的粒径分布Fig.1 Particle size distribution of long-circulation epirubicin liposomes samples before(A)and after(B)freezedrying
结果表明表柔比星长循环脂质体冻干前后粒径分别为128和137 nm,均为单峰分布,冻干复溶后长循环脂质体的粒径及分布范围变化不大。
2.4.2 透射电镜 取表柔比星脂质体混悬液与冻干后样品溶解并适当稀释后,用质量分数1%磷钨酸负染,于透射电镜下观察形态,见图2。

图2 表柔比星长循环脂质体冻干前样品(A)和冻干后样品(B)的透射电镜图(×40 000)Fig.2 Transmission electron microscopy oflongcirculation epirubicin liposomes samples before(A)and after(B)freeze-drying(×40 000)
由透射电镜照片可见,脂质体呈球形或椭球形,冻干前后外观基本无变化,脂质体之间没有相互粘连聚集现象。
2.4.3 Zeta电位 分别取表柔比星长循环脂质体冻干前及冻干后产品,用BECKMAN公司的COULTER DELSA440 SX Zeta电位及粒径测定仪测定其Zeta电位。结果表明表柔比星长循环脂质体冻干前后的Zeta电位分别为-35.3 mV和-28.9 mV,复溶后长循环脂质体的Zeta电位变化相对不大(图3)。
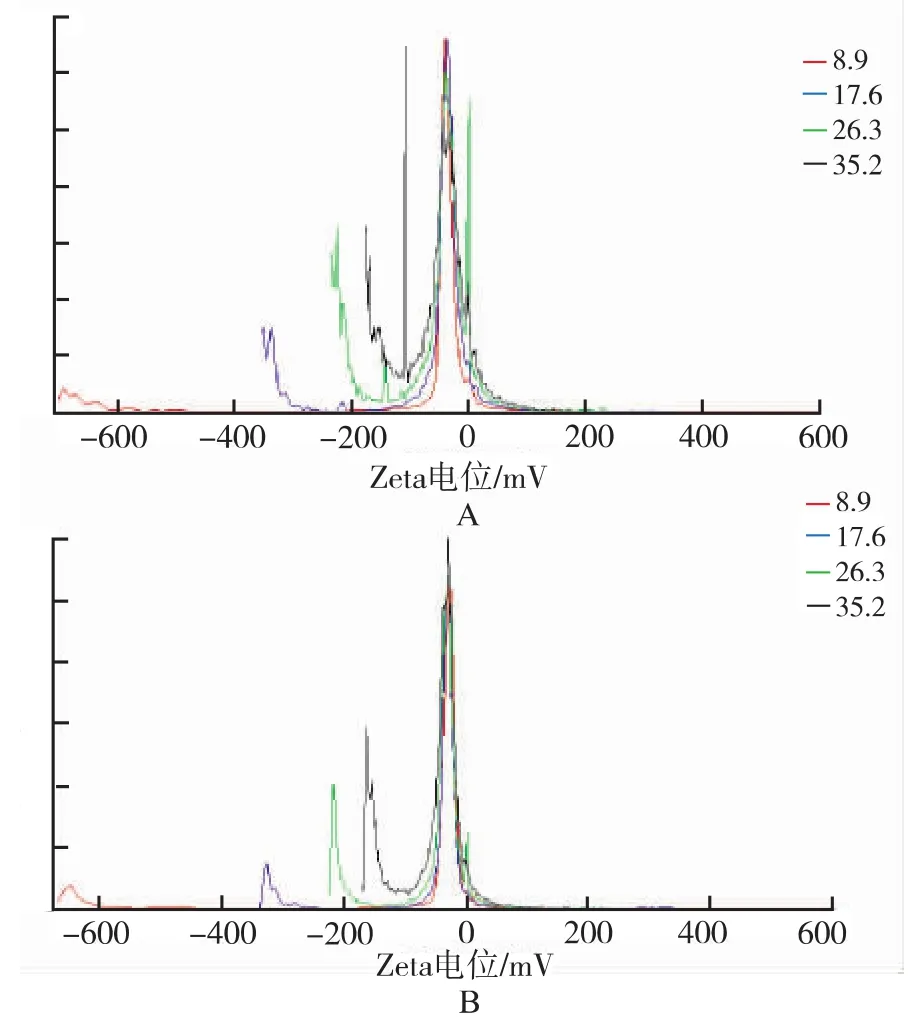
图3 表柔比星长循环脂质体冻干前样品(A)和冻干后样品(B)的Zeta电位分布Fig.3 Zeta potential of long-circulation epirubicin liposomes samples before(A)and after(B)freeze-drying
2.4.4 包封率 分别取表柔比星长循环脂质冻干前后的制剂,显微镜镜检均未见聚集的大粒子,按照包封率测定方法测定3批样品,结果见表6。表明表柔比星长循环脂质体冻干前后包封率无明显变化。

表6 表柔比星长循环脂质冻干前后样品包封率测定结果Tab.6 Entrapment rate of long- circulation epirubicin liposomes samples before(A)and after(B)freeze-drying%
2.4.5 含量 分别取表柔比星长循环脂质体冻干前后样品各一支(其中冻干制剂用水2mL振摇复溶,备用),完全转移至10mL量瓶加入适量甲醇破乳,用水稀释至刻度,精密量取1mL所得混悬液,用水定量稀释至10mL得透明澄清溶液,所得样品溶液注入高效液相色谱仪中,记录峰面积,按照外标法计算含量,分别测定3批样品的含量。结果表明表柔比星长循环脂质体冻干前后样品的平均含量分别为1.97 mg·mL-1,1.98 mg·mL-1。由结果可知,冻干后药物含量无明显变化,冻干工艺不影响制剂含量。
2.4.6 与葡萄糖注射液的配伍稳定性 冻干脂质体应采用一定的介质稀释以满足临床应用,常用的临床使用方法为采用5%葡萄糖注射液稀释后静脉滴注,故本实验考察了表柔比星长循环脂质体与5%葡萄糖注射液的配伍稳定性,并以表柔比星普通脂质体作为对照。取表柔比星普通及长循环脂质体冻干粉各5支,复溶后分别加入5倍量5%葡萄糖注射液,室温25℃放置,分别于0,1,2,4,6 h 取样,测定含量及包封率变化情况。结果表明6 h内两种脂质体包封率均无明显变化。两种脂质体药物含量在配伍6 h后分别为99.78%和98.96%,含量无明显变化。见图4。
2.4.7 冻干脂质体稳定性考察 以外观、再分散性、药物含量、包封率、粒径为指标考察表柔比星冻干脂质体的稳定性。
外观评定标准:桔红色,无结块,记作(-);桔红色,变粘,记作(+);暗紫色,萎缩变粘,记作(++)。
粒径评价方法:10×100倍油镜下观察多个视野,粗略观察脂质体的粒径变化。
评价标准:视野均一,无粒径 >1 μm粒子记作(-);视野基本均一,有粒径>1 μm的粒子,但不聚集记作(+);粒径 >1 μm,有聚集(++)。
取3批冻干表柔比星长循环脂质体,充氮加盖密封,按照2010年版《中华人民共和国药典》附录XIX原料药与药物制剂稳定性实验指导原则中的规定,选择加速条件为(25±2)℃,相对湿度(60±10)%,定期取样考察,结果见表7。

图4 表柔比星长循环脂质体及普通脂质体与葡萄糖注射液的配伍结果Fig.4 The compatibility of epirubicin conventional liposome and long-circulation liposome with glucose injection

表7 表柔比星冻干脂质体的加速稳定性考察Tab.7 Accelerating stability teston lyophilized epirubicin liposomes
稳定性结果表明,脂质体的冻干粉在温度(25±2)℃、相对湿度(60±10)%的条件下分别放置3个月比较稳定。
3 讨论
冻干是提高脂质体稳定性的一个有效途径。然而,冷冻和干燥过程都会引起脂质体结构和功能的破坏。当脂质体被冷冻时,冰核的形成首先在脂质体的外水相,然后无规则地形成冰晶,而后内水相形成冰晶,这样造成了外水相溶质浓度的升高。因此当冰晶在外水相一旦生成,双分子膜内外的渗透压随之产生。结晶的形成和渗透压的产生同时对脂质体膜造成了严重的机械破坏,最后导致脂质体膜破裂,失去原来的完整结构。脂质膜的破裂可能由于渗透压的产生、冰晶对磷脂基团的粘附力、溶解于脂质体内的气体聚集成气泡排出以及磷脂的相变温度转变。
文献中测得当浓度为15%时葡萄糖、蔗糖、甘露醇、海藻糖的玻璃化转变温度分别为-38.5、-32.4、-30.4、-29.2℃,玻璃化转变温度较低时,得到的冻干品常出现明显的药物渗漏[11]。海藻糖为非还原性二糖,玻璃化转变温度较高,可以使脂质体在完全脱水时保持完整形态,本研究中海藻糖对表柔比星脂质体保护作用显著优于其他保护剂,故选择海藻糖单用作为冻干保护剂。在冷冻干燥过程中,如果温度高于药品的玻璃化转变温度,药品的黏度会迅速降低,导致表面萎缩,发生塌陷现象。
[1]ICHIRO I,SHUSHI H,SEGUCHI K,et al.Transarterial infusion chemotherapy with epirubicin in water-in-oil-inwater emulsion for recurrent hepatocellular carcinoma in the residual liver after hepatectomy[J].Eur J Radiol,2009,69(1):114-119.
[2]郭立文.表柔比星壳聚糖隐形纳米粒的制备及其抗肿瘤活性的检测[D].广州:南方医科大学,2009.
[3]周志敏,崔强,陈欣,等.载阿霉素聚乳酸微球的制备及性质研究[J].厦门大学学报:自然科学版,2007,46(2):209-212.
[4]CHEN C J,HAN D D,CAI C F,et al.An overview of liposome lyo-philization and its future potential[J].J Controlled Rel,2010,142(3):299-311.
[5]王健,李明轩.冷冻干燥对提高脂质体稳定性的研究概况[J].中国医药工业杂志,2005,36(9):576-580.
[6]吴燕,吴诚,梅兴国,等.盐酸表柔比星长循环热敏冻干脂质体的处方工艺研究与体外释药机制探讨[J].军事医学科学院院刊,2010,34(2):139-145.
[7]方瑜,陈进,吴询,等.盐酸表柔比星长循环磁性脂质体的制备及表征[J].江苏大学学报:医学版,2013,23(3):254-267.
[8]郑佳昳,黄华.脂质体主动载药及其研究进展[J].国外医学:药学分册,2005,32(4):271-274.
[9]唐文雅,宋艳志,邓意辉.脂质体冻干保护剂的种类及其作用机制研究进展[J].沈阳药科大学学报,2012,29(7):560-569.
[10]吴燕.盐酸表柔比星长循环热敏脂质体与复方脂质体[D].北京:中国人民解放军军事医学科学院,2008.
[11]刘占杰,华泽钊,陶乐仁,等.不同保护剂浓度和不同降温速率对脂质体玻璃化转变温度的影响[J].低温工程,2006,118(6):1-5.

