正交法优选红花抗肝纤维化的水溶性成分提取工艺*
李文静,蔡德富,于庆莲,牛英才,郭丽娜,洪博
(齐齐哈尔医学院药学院,齐齐哈尔 161006)
红花系菊科植物红花(Carthamus tinctoriusL.)的干燥管状花,主产于我国新疆、甘肃、河南等地。作为活血化瘀的传统中药,具有活血通经、祛瘀止痛之功效[1]。学者们对红花化学成分和药理作用研究较多[2-7],其中红花黄色素是红花活血化瘀功效的有效成分。红花常被中医用于慢性肝病尤其是肝硬化的治疗,并有研究报道,红花水提物对实验性肝纤维化、肝硬化具有抑制作用[8-10]。目 前,已 经 明 确 羟 基 红 花 黄 色 素 A(hydroxysafflor yellow A,HYSA)是红花黄色素中含量最高的成分[11],而且是红花的有效水溶性部位,为了更好地发挥其药用功效,需制定合理的提取工艺。本实验以HYSA含量、浸膏得率和抗肝纤维化药理作用为指标,采用正交实验对红花的抗肝纤维水溶性成分的提取工艺进行了优选,以期为确定红花抗肝纤维化的水溶性成分的提取和生产工艺提供更全面的科学依据。
1 仪器与试药
1.1 仪器 Waters 2695高效液相色谱仪(UV2489检测器,四元高压梯度泵,柱温箱;美国Waters公司);LAC214型电子分析天平(常熟市百灵天平仪器厂);HHS型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂)。
1.2 试药 红花(来源于新疆维吾尔自治区吉木萨尔县,经齐齐哈尔医学院中药教研室郭丽娜教授鉴定为菊科植物红花Carthamus tinctoriusL.的干燥管状花);HYSA对照品(中国食品药品检定研究院,批号:111647-200801,规格:20 mg);色谱纯甲醇(北京北医大医疗科技有限责任公司,批号:27771);磷酸、无水乙醇为分析纯(天津市凯通化学试剂有限公司,批号分别为20120322,20101125);水为纯净水;四氯化碳(CCl4,天津市博迪化工有限公司,批号:20110506);丙氨酸氨基转移酶(alanine aminotransferase,ALT,批号:201111)、谷氨酸氨基转移酶(glutamate pyruvic aminotransferase,AST,批号:201121)试剂盒均购于南京建成生物工程研究所。
1.3 实验动物 选用清洁级SD雄性大鼠50只,体质量(200±10)g,由北京维通利华实验动物技术有限公司提供,动物使用许可证编号:SCXK(京)2007-0001。
2 方法与结果
2.1 HPLC测定HYSA的含量
2.1.1 色谱柱 Agilent C18柱(4.6mm ×250mm,5 μm);流动相:乙腈-0.2% 磷酸水溶液(30∶70);分析时间为15min;流速:1.0mL·min-1;进样量:5 μL;柱温:30℃;HYSA含量测定检测波长为400 nm。
2.1.2 待测溶液的制备 ① 对照品溶液的制备:取HYSA对照品1.0 mg精密称定,置10mL量瓶中,加甲醇溶解,定容至刻度,得质量浓度为0.1 mg·mL-1的对照品母液;② 供试品溶液的制备:精密量取正交实验样品提取液1~9号药液,用孔径0.22 μm微孔滤膜过滤,备用。
2.1.3 专属性考察 空白实验:吸取溶剂色谱纯甲醇,按色谱条件进行测定,结果见图1A;对照实验:吸取对照品溶液进样分析,结果见图1B;样品实验:吸取2号供试品溶液,进样分析,结果见图1C。空白实验和对照实验表明,空白无干扰,样品溶液和对照品溶液在相同保留时间有相应色谱峰,其他组分无影响,可以对HYSA进行定量分析。

1.羟基红花黄色素A图1 空白甲醇(A)、对照品(B)与供试品(C)的HPLC色谱图1.hydroxysafflor yellow AFig.1 HPLC chromatograms of methanol(A),reference substance(B)and sample(C)
2.1.4 方法学考察 ① HYSA线性关系考察:取0.1 mg·mL-1HYSA对照品溶液稀释为系列浓度(50,25,12.5,6.25,3.12,1.56,0.78 μg·mL-1)的对照品溶液,依次进样5 μL。以峰面积为纵坐标,样品浓度为横坐标进行线性回归,回归方程Y=8 479X-3 607.7,r=0.999 8。表 明 HYSA 在 0.78 ~100.00 μg·mL-1范围内与峰面积线性关系良好;②仪器精密度实验:取3.12 μg·mL-1HYSA 对照品溶液,连续进样6次,测定峰面积,计算得RSD为1.5%,表明仪器精密度良好;③方法精密度实验:取同一批红花药材各约0.5 g,精密称定,按表2中序号1的操作方法制备供试品溶液,平行操作6份,测定含量,计算得RSD值1.4%;④ 稳定性实验:取同一份供试品溶液,分别于 0,2,5,10,12,15 h 各进样 5 μL,测定峰面积。结果HYSA峰面积RSD为1.1%,表明供试品溶液在15 h内稳定;⑤加样回收率实验:取已知含量的同一批红花药材各约0.5 g,精密称定,共9份,按样品处理方法制备低、中、高浓度样品溶液,计算得每个浓度的平均加样回收率分别为93.08%,96.91%,99.28%,RSD 分别为 1.2%,0.9%,1.7%。
2.1.5 样品的制备 取红花药材约0.5 g,精密称定,按表2中方法制备样品,所得提取液配制成250mL,过滤后采用高效液相色谱分析,并做肝纤维化实验分析。
2.2 肝功能指标ALT、AST的测定
2.2.1 大鼠分组及模型制备 雄性SD大鼠适应性饲养1周,饮食、饮水、活动正常者纳入实验。将50只大鼠编号半随机分为10组:第1组(正常对照组)、第2~10组(按照正交表的9个实验排序),每组5只。第1组为正常雄性SD大鼠,第2~10组用CCl4复合制作肝纤维化(hepatic fibrosis,HF)模型[12]。
2.2.2 给药处理 造模后第3周起,腹腔注射给予药物处理,每周5次,第1组腹腔注射0.9%氯化钠溶液,第2~10组给予不同方法处理的多种红花水溶液样品,剂量为 1mL·kg-1(0.5 g·mL-1)。连续注射8周,于第10周末处死全部大鼠,取材。
2.2.3 ALT、AST测定 第10周末各组大鼠末次给药后,禁食12 h,3.5%水合氯醛麻醉,摘除眼球取血后处死大鼠。将血液室温静置1 h后,4℃离心15min(3 500 r·min-1),取上清液,严格按照试剂盒操作检测ALT、AST含量。
2.3 提取工艺的正交实验
2.3.1 正交表设计 对影响提取工艺的主要因素溶剂用量(因素A)、提取时间(因素B),提取次数(因素C),提取溶剂(因素D)进行L9(34)实验,因素水平见表1,正交实验结果见表2。
2.3.2 综合评分方法 采用排队评分法[13](将全部实验结果按照指标从优到劣进行排队)对正交实验数据进行综合分析,对于每个指标找到最好的结果,排在第一名,给10分,最后一名,给1分,其他号实验结果视其与该指标最好的结果的差异按比例打分,然后对每号实验的所有分数相加即得综合评分,综合评分结果见表2。

表1 红花水溶性成分提取工艺因素水平表Tab.1 Factors and levels of extraction process of water solubility component from Carthamus tinctorius L.
2.4 测定结果分析 综合评分方差分析结果见表3。
2.4.1 水平优劣分析 表2的A列K值,A1>A2>A3,说明A1比A2和 A3好;B 列K值,B1>B3>B2,说明 B1比B2和B3好;C 列K值,C2>C3>C1,说明 C1比 C2和 C3好,D 列K值,D2>D1>D3,说明D2比 D1和D3好。
2.4.2 因素主次分析 由直观分析表明,因素D的极差R最大,因此是主要影响因素。其次是因素A和C,最后是因素B。
2.4.3 最佳工艺条件分析 由方差分析结果可得出,因素A和D对实验结果有显著影响,从具有抗肝纤维化作用和工业生产提高生产效率的角度出发,优选出的最佳提取工艺条件为A1B1C2D2,即用10倍量10%乙醇,提取2次,每次0.5 h。
2.5 提取工艺验证 为验证该工艺的稳定性,按优选出的最佳工艺进行3批验证性实验。分别取同一批红花药材0.5 g,平行3份进行提取,得到的HYSA的含量分别为 16.1,15.9,16.4 mg·g-1,RSD 为 1.5%,说明优选出的提取工艺合理可行。
3 讨论
文献报道,红花的主要成分是红花黄色素,红花黄色素的主要成分为HYSA,是活血化瘀的主要成分。文献[14]报道称红花与HYSA均具有明显的降酶保肝作用,而且HYSA作用有优于红花的趋势。ALT和AST是用于判断肝纤维化和肝实质受损的主要酶类,所以本研究选择以HYSA含量和血清中ALT、AST含量为考察指标,优选红花抗肝纤维化水溶性成分的最佳工艺,保证了工艺的有效性和科学性。
本实验比较了提取时间对结果的影响,发现提取1.5 h有效成分含量不比1 h多,部分甚至更低,推测可能是加热时间过长使有效成分降解所致。
排队评分法综合考虑各指标,排序给出评分值,并作为单指标分析数据,方法简单,是处理多指标问题常用方法,本文综合评分法结果与单因素直观分析和方差分析相结合确定最佳提取工艺结果相一致。
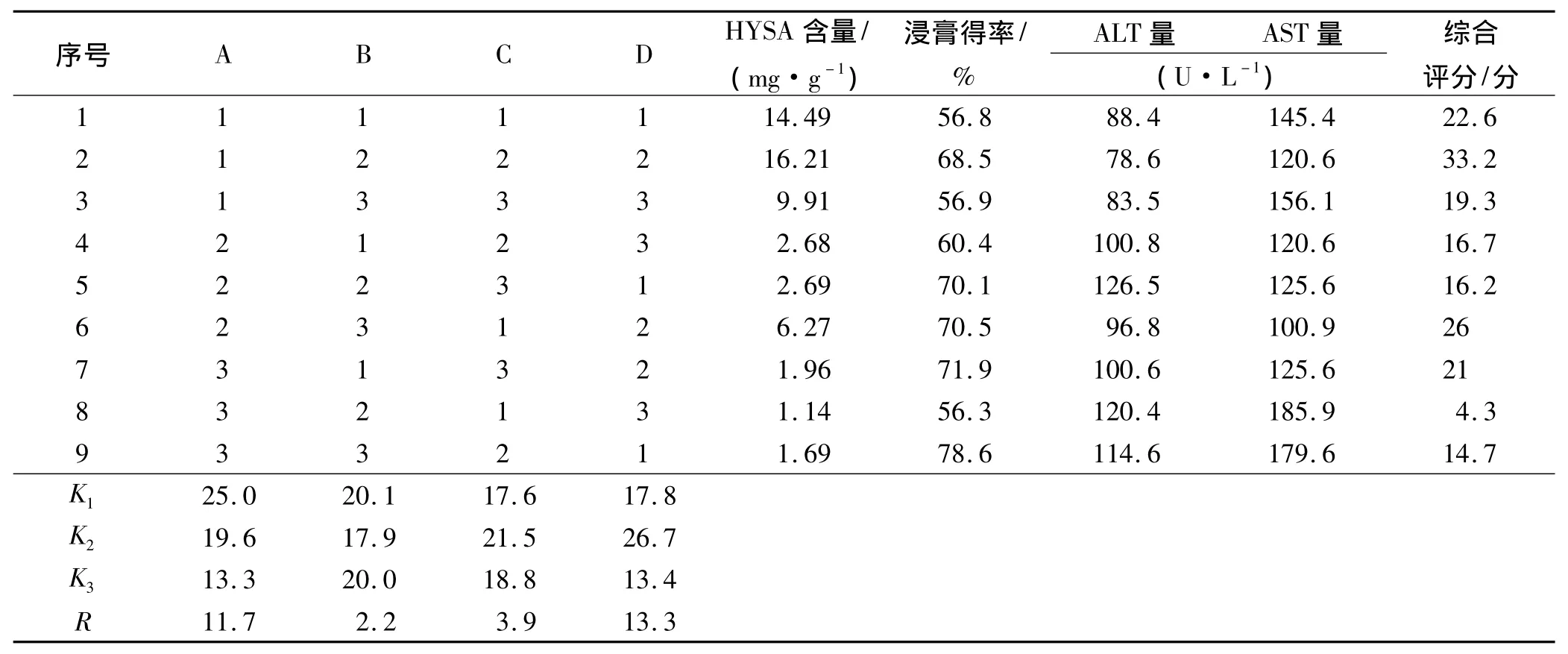
表2 红花水溶性成分提取工艺正交实验结果Tab.2 Results of orthogonal experiment on extraction process of water solubility component from Carthamus tinctorius L.

表3 综合评分方差分析Tab.3 Variance analysis on comprehensive score
中药材药效是多成分、多靶点整体作用的结果,中药提取工艺优选过程中,若采用某单体成分含量为优化指标,不能反映全方的整体效应。笔者尝试以药理作用为考察指标与有效成分含量相结合的形式,进行多指标综合评定优化红花水溶性抗肝纤维化成分的提取工艺,较以往可以更有针对性地得到有效成分。
[1]唐旭利,刘静,李国强,等.红花药材水溶性成分 HPLC指纹图谱研究[J].中药材,2007,30(8):923-926.
[2]任爱农,邹义芳,陆颖,等.红花多糖的分离纯化及单糖组成分析[J].药物分析杂志,2013,33(7):1190-1194.
[3]TSUTOMU K,SUSUMU T,HIDETAKA N,et al.A novel and potentbiologicalantioxidant,Kinobeon A,from cellculture of safflower[J].Life Sci,2003,74(1):87- 97.
[4]张戈,郭美丽,李颖,等.红花的化学成分研究Ⅱ[J].第二军医大学学报,2005,26(2):220-223.
[5]刘玉明,杨峻明,刘庆华.红花化学成分研究[J].中药材,2005,28(4):288-291.
[6]郑丽娜,韩涛,刘皓,等.红花促进肝星状细胞胶原降解的分子机制[J].武警医学院学报,2006,15(3):190-192.
[7]袁玉梅,钱晓东,曹恒斌.羟基红花黄色素A抗脑缺血损伤作用研究进展[J].医药导报,2012,31(8):1046-1050.
[8]赵文丽,姜庆久,吴影.红花对实验性大鼠肝纤维化的抑制作用[J].黑龙江医药科学,2004,27(4):4-8.
[9]杨洁,蔡刁龙,谭献文,等.柴胡、红花、川芎中药单体对大鼠肝纤维化治疗作用的实验研究[J].临床和实验医学杂志,2009,8(7):1-5.
[10]施韵,盛亮,钱之玉,等.西红花酸对大鼠酒精性脂肪肝的改善作用及机制探讨[J].中国新药杂志,2008,17(24):2115-2119.
[11]姚苗苗,任爱农,董仲才.RP-HPLC法同时测定红花中羟基红花黄色素A与红花黄色素A的含量[J].药物分析杂志,2010,30(2):263-266.
[12]游广辉,张琨.银杏叶提取物抗大鼠肝纤维化作用及机制的研究[J].河南职工医学院学报,2008,20(2):109-111.
[13]苑玉凤.多指标正交实验分析[J].湖北汽车工业学院学报,2005,19(4):53-56.
[14]李中原,涂秀华.红花黄色素的药理研究进展[J].中药新药与临床药理,2005,16(2):153-156.

